異丙酚對胎鼠離體海馬神經元腦源性神經營養因子表達的影響*
韋 祎,周 沾,覃銀瑩,謝玉波,利 莉
(廣西醫科大學第一附屬醫院麻醉科,南寧 530021)
異丙酚是快速短效的靜脈麻醉藥物,為GABA受體激動劑,常用于誘導和維持小兒麻醉以及重癥監護[1]。長期體內外大劑量異丙酚給藥會引起神經元損傷,導致認知和學習能力障礙[2]。從胚胎時期起持續2~3 年這一時期大腦發育最快,神經元、軸突、樹突和突觸數量迅速增加,在此期間內長時間大劑量接觸異丙酚會誘發神經元發育性神經毒性[3]。然而,關于新生兒中異丙酚安全性的研究報道較少。因此,減少麻醉藥品對發育性腦神經元的損傷成為一個日益熱門的研究課題。本研究擬評價異丙酚對胎鼠離體海馬神經元腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)表達的影響,探討異丙酚神經毒性的分子作用機制。
1 材料與方法
1.1 實驗動物 采用廣西醫科大學實驗動物中心提供SPF級SD大鼠(實驗動物許可證號:SCXK[桂]2003-0005),實驗遵循實驗動物福利倫理審查指南(GB/T35892—2018)。
1.2 細胞培養 將SD 大鼠腹中14 d 胎鼠處死,分離海馬組織,剪碎至1 mm×1 mm×1 mm并與DMEM/F12移入離心管中,加入不含EDTA 胰酶的膠原酶,吹打,37 ℃溫水浴,直至剪碎的海馬組織液呈現混濁不清并可拉出絲狀,然后加入不含EDTA的胰酶,吸除胰酶并加培養基終止消化。吸管上下吹打直至肉眼看不到明顯組織塊,離心,棄上清液,加培養液,制備單細胞懸液。篩網過濾,取過濾后液體0.5 mL,加入臺盼蘭染液,染色。鏡下細胞計數,藍色細胞為死細胞,無色透明為活細胞,密度以1~2×106個/mL接種于培養板中。顯微鏡下觀察并記錄海馬神經元的生長情況包括胞體形態、樹突、軸突和排列密度程度等。
1.3 免疫組化法鑒定神經元 保溫箱取出培養板,甲醛固定30 min,棄去甲醛后PBST輕洗;在室溫下通透15 min;用與二抗同源的5%的血清封閉30 min;棄掉培養基,PBST 輕洗,神經元特異性的MAP2 單克隆抗體標記神經元孵育過夜,滴加生物素化二抗工作液孵育30 min;PBS漂洗3次,每次3 min;辣根酶標記鏈霉卵白素工作液,恒溫箱孵育30 min;PBS漂洗3次,DAB顯色劑顯色,終止。蘇木素染色,沖洗,鹽酸酒精分化,分別用濃度80%、95%、100%的酒精梯度脫水,每次5 s;二甲苯2 次,每次5 s;脫水透明后封片,取其陽性細胞數均值計算海馬神經元純度。
1.4 實驗分組 神經元體外培養至第8 天,分為3組:空白對照組(C組)不做任何處理,I組加入脂肪乳劑(20%),P組加入異丙酚孵育3 h使其最終濃度為100 μmol/L。
1.5 CCK-8試劑盒測定海馬神經元細胞活力
L-左旋多聚賴氨酸預先處理96 孔板并分別每組設置6個復孔,孵育神經元細胞。每2 d測定1次吸光度值,記錄至第16天。用酶標儀(BioTek公司,美國)測定波長于450 nm 處P 組(a)、C 組(b)和I 組(c)的吸光度值(OD)并繪制生長曲線。細胞活力%=(a-b)/(c-b)×100%。
1.6 實時熒光定量PCR(RT-qPCR)檢測BDNF mRNA基因表達 按試劑盒(TARAKA公司,日本)提取總RNA 后逆轉錄cDNA。引物序列如下:GAPDH 引物F:5’-ACAGCAACAGGGTGGTGGAC-3’,R:5’-TTTGAGGGTGCAGCGAACTT-3’。BDNF 引物F:5’-CAGCGCGAATGTGTTAGTGGTTA-3’,R:5’-CAGTGGACAGCCACTTTGTTTCA-3’;RT-qPCR 擴增條件:95 ℃預變性30 s,95 ℃變性5 s,60 ℃退火34 s,反復40組。以GAPDH為內參,使用2-ΔΔCT法檢測mRNA的表達。
1.7 Western blotting檢測BDNF蛋白表達含量
10% SDS-PAGE 凝膠電泳將上樣的蛋白質分離,轉至PVDF 膜,5%脫脂奶粉封閉,1×TBST 稀釋兔抗鼠BDNF(1∶1 000,CST 公司,美國),兔抗鼠Cleaved-Caspase3(1∶1 000,CST公司,美國)孵育過夜,加入山羊抗兔熒光二抗(稀釋度1∶10 000,LI-COR公司,美國)避光孵育1 h,內參GAPDH(1∶5 000,CST公司,美國),使用凝膠成像系統和Image J軟件掃膜和條帶分析灰度值。
1.8 統計學方法 采用SPSS 22.0統計學軟件對數據進行分析,計量資料以均數±標準差(±s)表示,兩組數據方差齊,采用獨立樣本t檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 原代海馬神經元的形態結構 顯微鏡下觀察海馬神經元胞體飽滿程度和突起連接情況。接種4 h 后,大部分胞體已明顯貼壁,第1 天大部分胞體緊貼壁生長,突起延長;第3~5天胞體形態多樣,突起連接成網;第7天胞體飽滿排列緊密,突起縱橫交錯;第9天胞體皺縮,且部分胞體裂解。
2.2 免疫細胞化學鑒定結果 顯微鏡下觀察體外培養至第8 天的胎鼠海馬神經元細胞,神經元胞體豐滿,突起明顯延長并相互連接,細胞核被DAPI染成藍色。按照判斷原代海馬神經元細胞體外培養成功的標準,由此判斷新生大鼠海馬神經元細胞培養成功。計算陽性細胞數在10 個視野內平均值為(95.2±3.6)%。純度較高可滿足進一步的實驗的需求。
2.3 CCK-8檢測細胞活力 每2 d測定并記錄1次OD值,共測定8次。觀察到細胞活力上升速度越來越快,第8 天上升速度達到頂峰,然后上升速度變慢,由此得出第8天進行藥物干預為最佳時間,見圖1。與C 組比較,P 組海馬神經元活性降低(P<0.05);I 組海馬神經元活性幾乎無變化(P>0.05),見圖2。
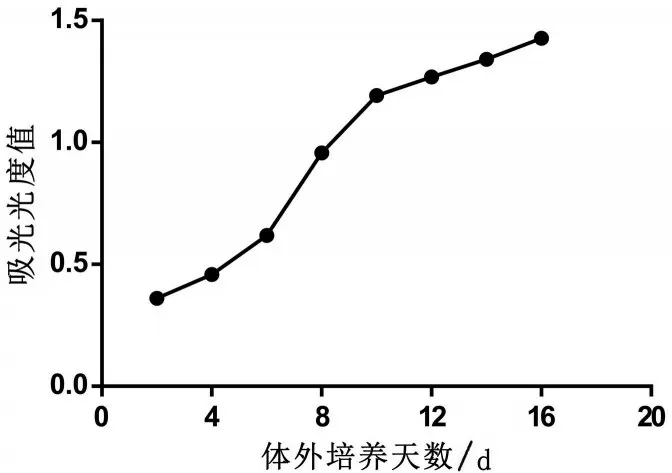
圖1 海馬神經元生長曲線
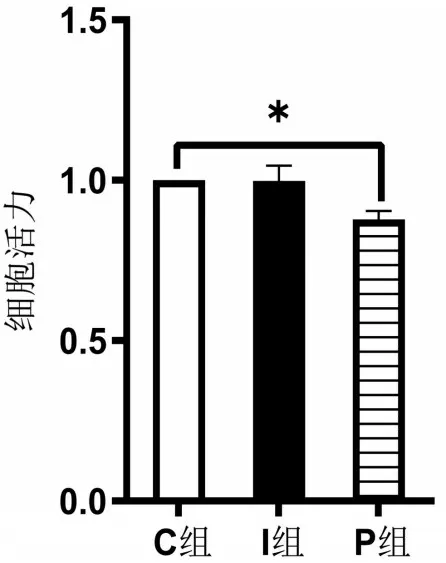
圖2 各組海馬神經元細胞活力比較
2.4 Western blotting檢測BDNF蛋白表達量 與C組比較,P組BDNF蛋白表達量下調(P<0.05);I組神經元BDNF蛋白未見明顯差異(P>0.05),見圖3。
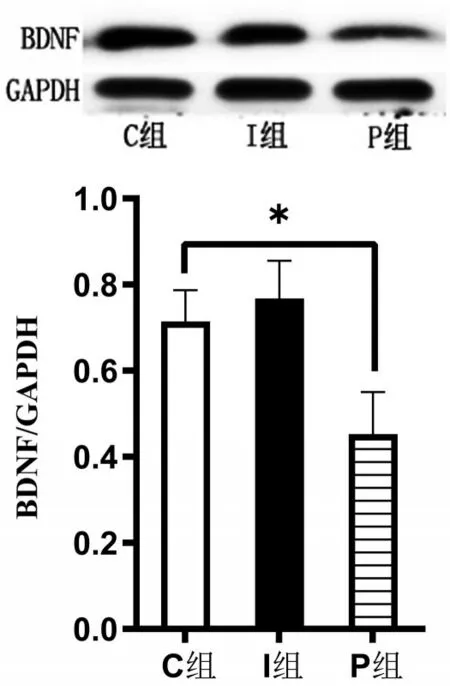
圖3 各組BDNF相對表達量比較
2.5 RT-qPCR 檢測BDNF mRNA 表達含量 與C組比較,P組BDNF mRNA的表達量降低(P<0.05);I 組神經元BDNF mRNA 未見明顯差異(P>0.05),見圖4。
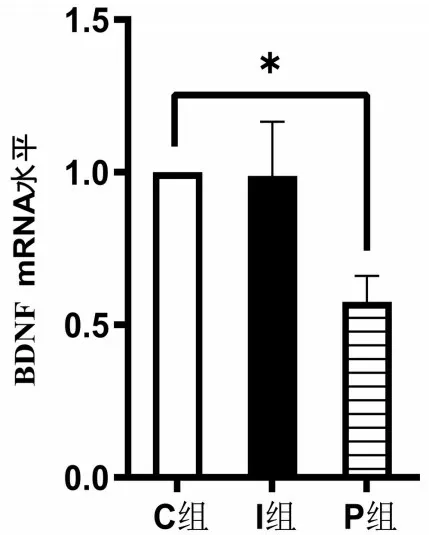
圖4 各組BDNF mRNA相對表達量
3 討論
異丙酚GABA 受體激動劑以及NMDA 拮抗劑(如氯胺酮、異氟醚和氧化亞氮)對各種神經傳遞系統產生劑量依賴性和年齡依賴性影響[4]。研究提示,全麻對嬰幼兒神經發育神經毒性的影響不僅僅取決于麻醉次數、時間和深度等因素,神經易損性是另一個至關重要的原因[5]。全麻藥可能具有神經毒性,這已引起麻醉醫生對小兒麻醉安全性的關注。幼兒長期大劑量暴露于異丙酚麻醉中,將對神經發育的各個方面產生不良影響,導致學習和行為缺陷,神經元損傷和神經元凋亡水平升高,以及增加神經認知損害風險且將對兒童后天的學習能力產生不良的影響[6]。研究報道,3個月以內嬰幼兒異丙酚劑量為25 mg/(kg·h),3~6個月的嬰幼兒異丙酚劑量為20 mg/(kg·h),6~12 個月的嬰幼兒異丙酚劑量為15 mg/(kg·h),幼兒期1~3歲異丙酚劑量為12 mg/(kg·h),且與成人相比早產兒和足月新生兒的藥物清除率僅為藥物有效形式的10%~38%,這一事實極大地限制尤其是在新生兒中異丙酚的使用[7]。50 μmol/L 異丙酚對神經細胞的短期暴露(<3 h)沒有明顯的神經毒性作用;異丙酚暴露如超過12 h,神經細胞活性顯著降低。幼兒大腦模型可用培養至第7 天海馬神經元替代,此時麻醉藥作用于海馬神經元反應性最強,海馬神經元在100 μmol/L異丙酚作用下出現神經毒性[8]。
BDNF 是神經營養因子,能促進海馬學習記憶和神經形成,促進神經元突觸可塑性并參與軸突和樹突的分化。BDNF通常通過兩個關鍵的信號級聯途徑在發育中的神經元發揮其生存效應。其一,BDNF通過其受體TrkB誘導的PI3K活性激活Akt;其二,BDNF通過TrkB誘導的Erk1/2激活GSK3β或MSK1[9-10]。BDNF促進神經元和膠質細胞的同步成熟,并提高神經細胞的存活率,BDNF上調對許多神經疾病產生有益的影響[11]。BDNF 表達水平的改變,可能導致神經元突觸丟失從而影響認知能力。臨床濃度異丙酚可致發育期神經元凋亡,抑制BDNF 分泌是其中一種重要損傷機制[12]。本研究中異丙酚孵育海馬神經元,胎鼠海馬神經元活性明顯降低,BDNF蛋白及其mRNA表達下調,揭示異丙酚對胎鼠離體海馬神經元神經毒性機制可能是通過下調BDNF蛋白完成的。
綜上所述,異丙酚通過影響BDNF 蛋白的表達從而抑制胎鼠海馬神經元活性,產生神經毒性作用。

