雪茄煙葉(BESNO H382)不同組織器官及鹽脅迫條件下內參基因的篩選
張 慧,金靜靜,徐國云,翟 妞,鄭慶霞,劉萍萍,陳千思,金立鋒,周會娜
中國煙草總公司鄭州煙草研究院,鄭州高新技術產業開發區楓楊街2 號 450001
雪茄煙葉按照其用途可以分為三類:茄衣、茄套和茄芯[1]。優良品種的缺乏和現有品種的退化已成為我國茄衣煙葉生產上的主要問題[2]。目前在茄衣煙葉的栽培和調制方面研究較多[3-5],但對于茄衣煙葉的分子生物學及遺傳育種方面的研究則十分匱乏。隨著測序技術的不斷發展,利用二代測序和三代測序相結合的方法獲取雪茄煙葉(茄衣)基因組的序列及表達數據,進而挖掘基因功能,創制出雪茄煙葉優良性狀的育種材料成為可能[6-8]。
基因表達分析是分子遺傳學的基礎研究內容,實時熒光定量PCR(quantitative real-time PCR,qRT-PCR)是基因表達分析的重要技術手段[9-10],常用來檢測不同組織、不同試驗條件下特定基因的表達情況或者驗證轉錄組測序數據的準確性。選擇合適的內參基因是保證qRT-PCR分析結果準確性的前提[11]。常用的內參基因包括ACTIN(肌動蛋白家族基因)、RPL(Ribosomal protein L,核糖體蛋白基因)、UBQ(ubiquitin,多 聚 泛 素 酶 基 因)、EF-1 α(Elongation factors 1 alpha,轉錄延伸因子基因)、GAPDH(glyceraldehyde-3-phosphate dehydrogenase,甘油醛-3-磷酸脫氫酶基因)、TUB(tubulin,β微管蛋白基因)[12-14]等。盡管這些基因高度保守,但在不同植物及組織中、不同生理狀態條件下的表達量并不穩定,因此研究者需要根據具體的物種和不同的處理條件選擇合適的內參基因[15-16],如藜麥中選擇肌動蛋白(ACT-1)和微管蛋白(TUB-6)作為鹽脅迫下的內參基因等。
關于普通栽培煙草的內參基因,最早Schmidt等[17]研究挑選了L25 和EF-1α兩個基因。王燃等[13]基于煙草芯片數據篩選獲得了HSC70-1基因作為內參。由于烤煙與晾曬煙的遺傳相似性差異較大[18],因此普通栽培煙草(烤煙)的內參基因是否適用于雪茄煙葉(晾曬煙)尚不明確。基于前期對雪茄煙葉的三代測序和轉錄組測序數據分析,已經得到了較為完整的雪茄煙葉基因信息[19]。通過序列比對發現,雪茄煙葉中未找到完整的L25 基因序列,這可能與測序及拼接有關;而EF-1α基因根據轉錄組測序數據判斷在根莖葉中的表達量較低且并不一致。此外,目前已報道的栽培煙草L25 和EF-1α的qPCR 引物在雪茄煙葉里特異性差,因此不適合作為雪茄煙葉的內參基因。結合雪茄煙葉的三代測序和轉錄組測序數據,從中篩選各組織較高表達且表達量一致的10 個基因作為候選內參基因。利用qRT-PCR 獲得這10個基因在雪茄煙葉不同組織器官以及鹽處理前后雪茄煙葉葉片中的表達量,并使用geNorm[20]、NormFinder[21]和BestKeeper[22-23]等3 個軟件對候選基因的表達穩定性進行分析評價,旨在篩選出適合用于雪茄煙葉不同組織器官和鹽脅迫條件下基因表達研究的內參基因。
1 材料與方法
1.1 植物材料
雪茄煙葉(品種BESNO H382)種植在國家煙草基因研究中心的植物生長室中(培養條件:溫度28 ℃,相對濕度70%~75%,光照16 h,黑暗8 h)。雪茄煙葉不同組織器官(旺長期根、莖、葉,盛花期花萼、花冠、柱頭、子房、雄蕊、雌蕊及種子)取樣后,于液氮中迅速冷凍后保存在-80 ℃超低溫冰箱中。鹽脅迫試驗:待煙苗長至6片真葉時,移至1/2 MS液體培養基中繼續培養,1周后向培養液中加入300 mmol/L的NaCl溶液處理0 h、3 h、1 d、3 d和7 d,選取同一葉位的葉片進行取樣,經液氮速凍后置于-80 ℃冰箱保存備用。所有樣品均設置3次生物學重復。
1.2 總RNA提取及cDNA的合成
總RNA的提取及反轉錄cDNA的合成方法具體為:將采集的樣品在液氮中充分研磨,根據植物RNA提取試劑盒[天根生化科技(北京)有限公司]說明書提取總RNA。通過Nano Drop 2000[賽默飛世爾科技(中國)有限公司]檢測RNA的濃度和純度(A260/A280=1.8~2.1,A260/A230>1.8),并通過1.0%的瓊脂糖凝膠電泳檢測總RNA 的質量和完整性。檢測合格的總RNA 用于cDNA 第一鏈的合成,具體步驟參照Roche 第一鏈cDNA 合成試劑盒Transcriptor First Strand cDNA Synthesis Kit說明書。合成的cDNA按1∶5稀釋后于-20 ℃保存備用。
1.3 候選內參基因的篩選及qRT-PCR引物設計
根據前期已完成的雪茄煙葉三代測序及根莖葉轉錄組測序數據[19],篩選在不同組織表達量接近且高表達的持家基因,從中選取10個文獻報道的常用內參基因作為本研究中的候選內參基因,設計特異性引物(表1),并將設計好的引物提交至北京六合華大基因科技股份有限公司合成。
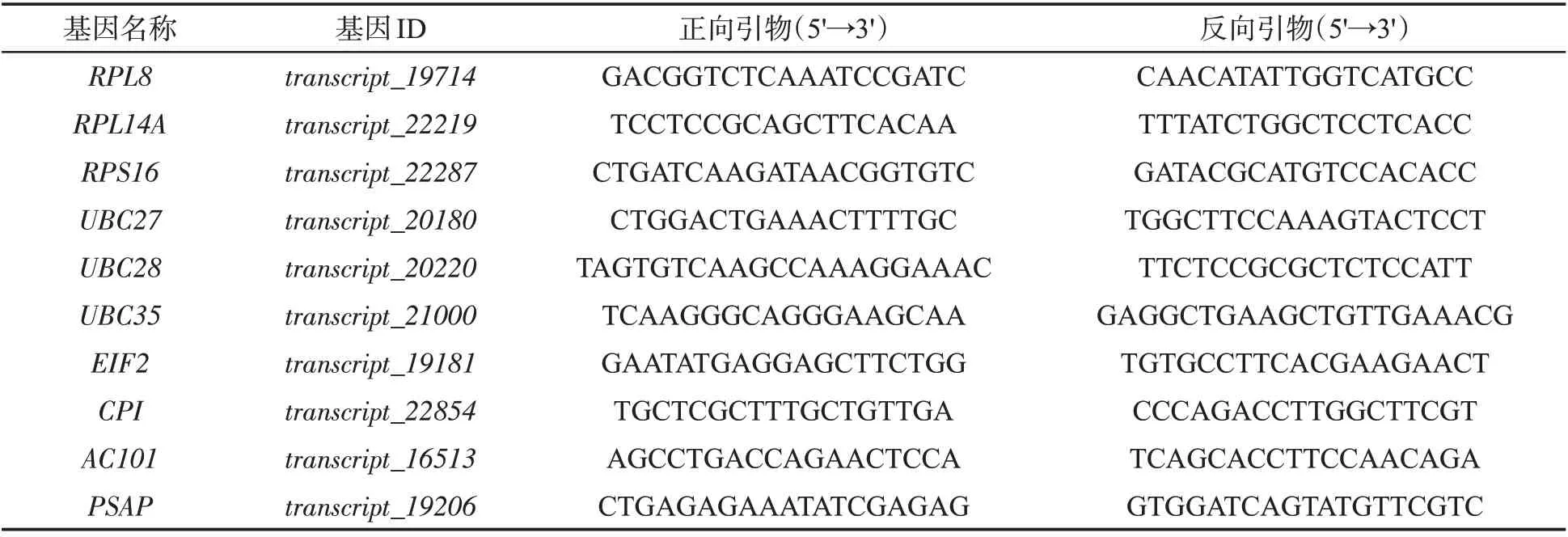
表1 候選內參基因qRT-PCR引物Tab.1 qRT-PCR primers for candidate reference genes
1.4 實時熒光定量PCR擴增及引物擴增效率的計算
用Roche Light Cycler 96 實時熒光定量PCR 儀進行qRT-PCR 擴增反應。反應體系20 μL:10 μL 2×SYBR I Master,上下游引物各0.5 μL,cDNA 模板1 μL,加ddH2O 至20 μL。PCR 反應程序:94 ℃預變性30 s;94 ℃變性5 s,60 ℃退火10 s,72 ℃延伸10 s,45 個循環;60 ℃~95 ℃持續15 s 作為熔解曲線分析程序。脯氨酸合成酶基因(P5CS)的相對表達量采用2-ΔΔCT方法計算,其中P5CS 基因的定量引物為:上游5′-CTGCAAGAGAATGCGCCAG-3′ ,下游5′-GCCAGGATTTCCTCTTCATT-3′ 。參考文獻[24]計算引物擴增效率。
1.5 數據分析
利用Prism6 軟件繪制10 個候選基因在所有樣品中CT值的分布箱線圖。利用geNorm、NormFinder和Bestkeeper 軟件對候選內參基因的穩定性進行評價。
2 結果與分析
2.1 RNA質量檢測
瓊脂糖凝膠電泳檢測結果(圖1)表明,RNA 條帶清晰,無彌散現象;經過Nano drop 2000 的檢測,所 有 樣 本A260/A280介 于1.8~2.1 之 間,A260/A230介 于1.8~2.2 之間。說明RNA 完整性好,純度高,且沒有降解。證明RNA樣品純度較高,滿足后續實驗要求。

圖1 雪茄煙葉不同組織器官中提取的總RNA的瓊脂糖凝膠電泳圖Fig.1 Agarose gel electrophoresis of total RNA from different tissues and organs of cigar tobacco
2.2 候選內參基因擴增特異性分析及擴增效率
將雪茄煙葉不同組織的總RNA 分別反轉錄成cDNA 進行qRT-PCR 反應,結果(圖2)表明,10 個候選內參基因的熔解曲線均呈現顯著的單一峰,沒有引物二聚體及非特異擴增的情況出現,可用于內參基因表達穩定性分析。同時,10 個候選基因的擴增效率介于91.74%~107.1%之間(表2),R2較高(均在0.980 0 以上),滿足qRT-PCR 對引物擴增效率的要求,可用于進一步分析。

表2 雪茄煙葉候選內參基因擴增效率比較Tab.2 Amplification efficiency of candidate reference genes of cigar tobacco

圖2 候選內參基因的熔解曲線Fig.2 Melting curves of candidate reference genes
2.3 候選內參基因表達豐度分析
內參基因的表達水平通常用CT值來表示[21]。對10 個候選基因在10 個樣品中的CT值分布情況進行了分析。結果(圖3)表明,10個候選內參基因的平均CT值介于21.39(RPL8)~29.93(PSAP)之間,表達豐度分布范圍較廣。在10 個候選內參基因中,UBC28、UBC35和AC101基因的表達水平在不同樣本中的波動較小,所有樣本的平均CT值分別是24.66、24.00和25.21;RPL8 基因的表達水平在不同樣本中最為分散,最大是27.51,最小是21.39,平均CT值是24.4。因此,從不同組織表達量的一致性來看,UBC28、UBC35和AC101基因適合作為分析不同組織間表達變化的內參基因。
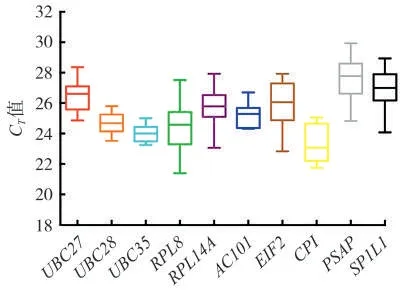
圖3 雪茄煙葉10個候選內參基因在不同組織器官中CT值的分布Fig.3 Distributions of CT values for 10 candidate reference genes in different tissues and organs
2.4 候選內參基因在雪茄煙不同組織表達的穩定性分析
由于不同樣本之間固有的差異,以及qRT-PCR反應的操作過程中多步實驗導致的誤差,直接比較原始的CT值無法準確評估候選內參基因的穩定性,因此采用3 種常見的內參基因測試軟件geNorm、NormFinder 和BestKeeper 進行比較分析,篩選出雪茄煙葉不同組織器官中適合的內參基因。
2.4.1 geNorm軟件分析
geNorm軟件用M值來判斷其表達穩定性[23]。具體算法為:先找到該基因在所有樣品中最小的CT值,再用其他樣品CT值減去最低CT值,得到ΔCT值后,計算2-ΔCT值,然后通過geNorm軟件計算M值。通常適合作為內參基因的M 值都小于等于1.5。geNorm 軟件分析結果(圖4)表明,10個候選內參基因的M值均小于1.5,其中最小0.37(RPL14A和SP1L1),最大1.09(PSAP),說明這些基因都可作為候選內參基因,按照M 值由低到高排序依次為RPL14A=RPS16<UBC27<UBC28<UBC35<EIF2<AC101<RPL8<CPI<PSAP。 即在這10個候選基因中,RPL14A和RPS16基因表達最為穩定,PSAP 基因表達最不穩定。此外,通過geNorm 軟件計算出配對變異值Vn/n+1,當Vn/n+1<0.150時,n 個基因即可滿足校正目的基因表達量的要求。從圖4 中可以看出,V4/5=0.143<0.150,表明適合候選內參基因數目最少為4。

圖4 geNorm分析候選內參基因表達穩定性(A)和最佳候選內參基因個數(B)Fig.4 Expression stabilities(A)and optimal numbers(B)of candidate reference genes analyzed by geNorm
2.4.2 NormFinder軟件分析
NormFinder軟件計算原理與geNorm類似,所得穩定值越小的越適合作為內參基因[23]。分析結果如圖5 所示,10 個候選內參基因的表達穩定值從低到高排列為:UBC27<RPL14A<UBC28<RPS16<UBC35<AC101<EIF2<RPL8<CPI<PSAP。其中UBC27 最低,為0.336 1;PSAP 最高,為0.779 2。表明最適合作為候選內參基因的是UBC27,其次是RPL14A 和UBC28。

圖5 NormFinder分析10個候選內參基因的表達穩定性Fig.5 Expression stabilities of 10 candidate reference genes analyzed by NormFinder
2.4.3 Bestkeeper軟件分析
Bestkeeper 軟件可以根據不同候選內參基因在樣品中的平均CT值計算兩兩基因之間產生配對的標準偏差(SD)、相關系數(r)和變異系數(CV),通過比較各個值的大小,最終選擇穩定性好的內參基因。相關系數越大,標準偏差和變異系數越小,內參基因的穩定性就越好。除了能夠分析內參基因的穩定性,該軟件還可分析目的基因的表達水平[21]。
從Bestkeeper的分析結果(表3)可以看出,在10個候選內參基因中有5 個(RPS16、CPI、PSAP、EIF2和RPL8)SD 大于1,剩余的5 個(RPL14A、UBC27、UBC28、AC101和UBC35)SD值均小于1,說明這5個基因適合作為內參基因。對這5個基因按照相關系數進行排序,從高到低依次為:RPL14A、UBC27、UBC28、UBC35 和AC101,其中RPL14A 和UBC27 也是geNorm 軟件和NormFinder 軟件篩選出的適合雪茄煙葉不同組織基因定量分析的內參基因。

表3 BestKeeper分析10個候選內參基因表達穩定性Tab.3 Expression stabilities of 10 candidate reference genes analyzed by BestKeeper
2.5 候選內參基因在鹽脅迫下表達的穩定性分析
對10個候選內參基因進行了鹽脅迫下表達穩定性分析,結果如表4所示。3種軟件的評價結果基本一致,最適合的鹽脅迫條件下的內參基因是UBC28,其次是UBC27和RPL14A等。
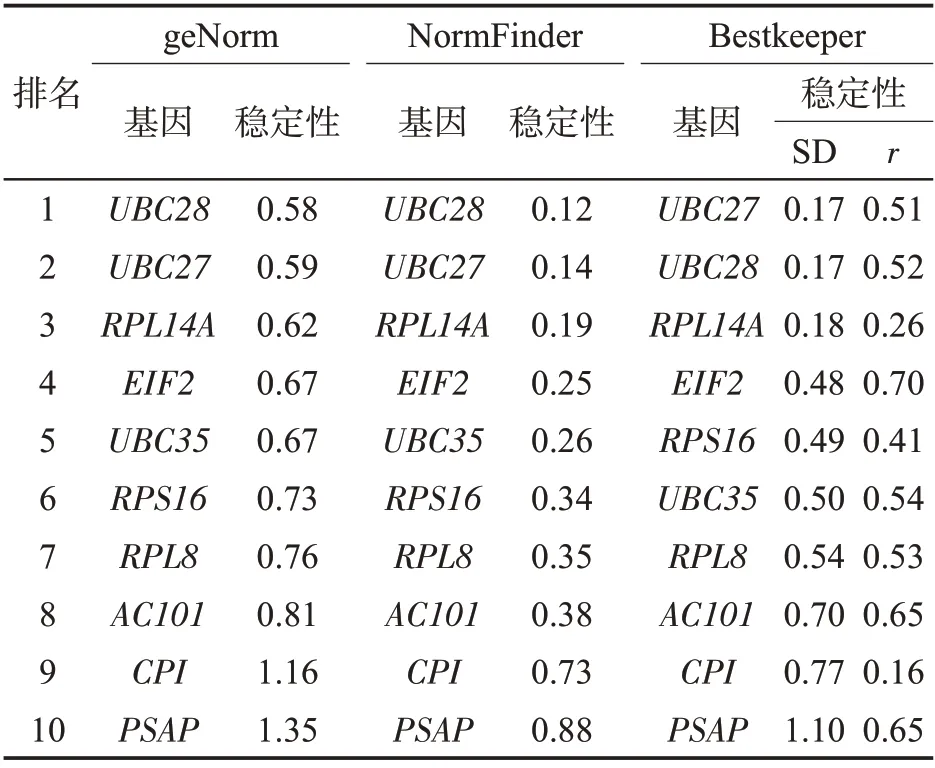
表4 鹽處理條件下雪茄煙葉候選內參基因的穩定性分析Tab.4 Stability analysis of candidate reference genes under salt stress
2.6 鹽脅迫下脯氨酸合成相關基因P5CS的時間表達模式分析
脯氨酸在植物抗逆中起著重要作用,其表達變化通常被用來衡量植物對逆境的響應情況[25-27]。分別使用RPL14A、UBC27和UBC28通過qRT-PCR對脯氨酸合成相關基因P5CS的相對表達量進行分析,結果如圖6 所示。分別以RPL14A、UBC27 和UBC28 作為內參基因時P5CS的相對表達量基本一致,尤其是在鹽脅迫3 h、1 d 和7 d 時,但在鹽脅迫3 d 時以RPL14A 為內參時的相對表達量更高;3 種內參基因分析得到的時間表達模式非常一致,P5CS的表達在鹽脅迫的前三天逐漸升高,第7天又略有下降,各取樣時間點的表達由高至低依次為:3 d>7 d>1 d>3 h>0 h(CK)。可見,RPL14A、UBC27和UBC28作為內參基因用于雪茄煙葉鹽脅迫時的基因表達定量分析都是適合的。

圖6 雪茄煙葉鹽處理后葉片中P5CS基因相對RPL14A、UBC27和UBC28的表達量Fig.6 Expression levels of P5CS gene relative to RPL14A,UBC27 or UBC28 in cigar tobacco leaves under salt stress
3 討論
本研究中利用geNorm、NormFinder和BestKeeper等軟件對候選內參基因的表達穩定性進行了分析,結果顯示3種軟件中候選內參基因的穩定性排序并不完全一致,這種情況在異色瓢蟲(Harmonia axyridis)[10]和火龍果(Hylocereus)等[12]物種內參基因的篩選研究中也得到相似結果。其原因可能是由于3種分析軟件處理數據的原理不同造成的。同時,本研究中選取的10個候選基因中有3個核糖體蛋白基因(RPL8、RPL14A 和RPS16)和3 個泛素結合酶基因(UBC27、UBC28 和UBC35)。從分析結果來看,3 個核糖體蛋白基因中RPL14A的穩定性明顯高于RPL8和RPS16,3個泛素結合酶基因中UBC27和UBC28的穩定性明顯高于UBC35,這說明功能相似的內參基因其表達穩定性不一定相同。這種情況在柑橘(Citrus)[28]和堿蓬(Suaeda glauca)[29]等植物中也有相關報道。此外,根據雪茄煙葉三代測序結合轉錄組測序的數據篩選出UBC27、RPL14A和UBC28等內參基因,但可能由于數據組裝及拼接問題未能獲得普通栽培煙草(烤煙)常用的L25等基因,因此如果想要更為全面地獲得并驗證雪茄煙葉的內參基因,可能需要對雪茄煙葉進行全基因組測序方面的研究。
4 結論
①篩選出10 個適合于溫室中雪茄煙葉(BESNO H382)基因相對定量分析的候選內參基因,分別是RPL8、RPL14A、RPS16、UBC27、UBC28、UBC35、EIF2、CPI、AC101和PSAP。②利用geNorm、NormFinder 和Bestkeeper 等3 個軟件分析了10 個候選內參基因在雪茄煙葉不同組織器官及鹽脅迫下葉片中的表達穩定性,表明RPL14A 和UBC27 最適合作為雪茄煙葉不同組織器官的內參基因;UBC28 最適合作為雪茄煙葉不同鹽脅迫條件下的內參基因。③應用UBC27、UBC28和RPL14A作為內參基因分析P5CS 基因在鹽脅迫下的表達情況,發現3 個內參基因的定量結果趨勢一致。

