兩種瑤藥酊劑微生物限度檢查方法適用性試驗及結果分析
劉康連 龐云娟 龍文洲 顏金蘭 龐蘭英 莫海濤


【摘 要】 目的:按照《中國藥典》2020年版對兩種瑤藥酊劑抗風濕骨痛酊和抗骨質增生酊的微生物限度檢查進行適用性試驗,為有較強抑菌作用沖洗量較大的酊劑提供適用性試驗的方法參考。方法:對有較強抑菌作用的抗風濕骨痛酊、抗骨質增生酊,按照《中國藥典》2020年版四部中相關的規定,采用稀釋法結合薄膜過濾法進行需氧菌總數、霉菌和酵母菌總數的計數方法適用性試驗。控制菌采用增菌液常規法、增菌液稀釋法和薄膜過濾法循序、科學、合理地進行適用性研究試驗。 結果:采用優選的方法進行微生物限度檢查驗證時,兩種酊劑的計數方法回收比值均在0.5~2.0范圍內,控制菌適用性試驗中試驗組均能檢出所加試驗菌相應的反應特征。結論:所采用的方法符合《中國藥典》2020年版四部通則的有關規定。
【關鍵詞】 酊劑;微生物限度檢查;適用性試驗;薄膜過濾法
【中圖分類號】R29 【文獻標志碼】 A【文章編號】1007-8517(2022)14-0026-05
Experimental Study on Applicability of Microbial Limit Test for 2 Kinds of Yao Medicine Tinctures and Result Analysis
LIU Kanglian1PANG Yunjuan1*LONG Wenzhou1YAN Jinlan2PANG Lanying1MO Haitao3
1.Yulin Center for Food And Drug Control, Yulin 537000,China;
2.Guilin Medical University, Guilin 541004,China;
3. Guangxi Zichi Pharmaceutical Technology Co., Ltd.? Nanning 530299,China
Abstract: Objective According to the Chinese Pharmacopoeia 2020 edition, the applicability of Microbial Limit Test for two kinds of Yao medicine tinctures was studied and the results were analyzed, it provides a reference for the establishment of the method of microbial limit test for Chinese Patent Medicine Capsules, reduces the Times of test and improves the efficiency of test. Methods? In accordance with the relevant provisions of the 2020 edition of the Chinese Pharmacopoeia in four volumes, the anti-rheumatic Gutong tincture and anti-bone Hyperplasia tincture, which have strong bacteriostatic effect, the count method of aerobic bacteria, mould and yeast was carried out by dilution method and membrane filtration method. In order to control bacteria, routine method, dilution method and membrane filtration method were used to study the applicability of the control bacteria. Results The recovery ratios of the two tinctures were all in the range of 0.5-2.0, in the control bacteria suitability test, the test group could detect the corresponding response characteristics of the tested bacteria.Conclusion The method adopted is in accordance with the relevant provisions of the four general principles of the 2020 edition of the Chinese Pharmacopoeia.
Key words:Tinctures;Microbial Limit Test ; Applicability Test;Membrane Filtration
抗風濕止痛酊和抗骨質增生酊均為玉林市中醫醫院院內制劑,為瑤方外用液體制劑,療效確切,可廣泛應用于臨床。目前中藥外用酊劑療效顯著,前景廣闊[1], 對其進行微生物限度的檢查是控制藥品質量的重要檢查項目之一,控制其質量是保證臨床安全用藥的前提[1-4]。本研究根據其給藥途徑和處方,按照《中華人民共和國藥典》(以下簡稱《中國藥典》)2020年版四部通則1107的有關規定[4],對其進行需氧菌總數、霉菌和酵母菌總數進行計數方法的適用性試驗以及控制菌——金黃色葡萄球菌、銅綠假單胞菌的檢查的適用性試驗,建立抗風濕止痛酊和抗骨質增生酊的微生物限度檢查法并加以驗證,保證微生物限度檢查方法的科學性、可靠性和準確性,為確保其微生物限度檢查指標符合要求,更好地控制其質量提供標準依據。
1 材料與儀器
1.1 實驗菌株 枯草芽孢桿菌[CMCC(B)63501],金黃色葡萄球菌[CMCC(B)26003],銅綠假單胞菌[CMCC(B)10104],白色念珠菌[CMCC(F)98001],黑曲霉[CMCC(F)98003],大腸埃希菌[CMCC(B)44102],從廣東環凱微生物科技有限公司購買西林瓶凍干粉菌種,實驗室進行復活傳代并制備成甘油凍存管保存。其中銅綠假單胞菌、大腸埃希菌、黑曲霉使用的是第二代,枯草芽孢桿菌、白色念珠菌使用的是第三代,金黃色葡萄球菌使用的是第四代。
1.2 培養基與試劑 胰酪大豆胨瓊脂培養基TSA、胰酪大豆胨液體培養基TSB、沙氏葡萄糖瓊脂培養基SDA,沙氏葡萄糖液體培養基SDB、pH 7.0無菌氯化鈉-蛋白胨緩沖液、甘露醇氯化鈉瓊脂培養基、溴化十六烷基三甲銨瓊脂培養基、(北京陸橋技術有限責任公司所產);0.9%無菌氯化鈉溶液(廣東光華科技股份有限公司)、吐溫80(天津市大茂化學試劑廠)。
1.3 儀器 霉菌培養箱(廣東省醫療器械廠,型號LRH-150-M),SPX-150F-Ⅱ型生化培養箱(上海龍躍儀器有限公司),生物安全柜(蘇州安春游空氣技術有限公司,型號BHC-1300HA2),立式壓力蒸汽滅菌器(雅馬拓科技貿易有限公司,型號SQ810C),真空泵兩頭套裝(密理博Milliflexplus)S25型圓周振蕩器(德國IKA),電動助吸器Eppendorf Easypet 3(德國Eppendorf)、艾本德移液器(100~1000 μL,德國Eppendorf)等。
1.4 試驗樣品 抗風濕骨痛酊(批號:200403、200410、200417),抗骨質增生酊(批號:200424、200508、200515),均由廣西玉林市中醫醫院提供。
2 方法
2.1 菌懸液的制備 按照《中國藥典》2020年版四部關于菌種的培養制備要求,并參考菌懸液制備方法進行制備,制備成每1mL含菌數不大于100cfu的菌懸液,備用。
2.2 實驗方法[5-6]2.2.1 方法1 1∶10供試液10mL(即原液1mL)/膜。取本品10mL加至90mL含1%聚山梨酯80的pH 7.0無菌氯化鈉蛋白胨緩沖液中,制成1∶10的供試液,1∶10供試液10mL薄膜過濾,沖洗量從100mL開始,以2倍遞增的沖洗量至800mL。
2.2.2 方法2 1∶10供試液10mL(即原液1mL)/膜。取1∶10供試液10mL加至90mL0.9%無菌氯化鈉溶液中,薄膜過濾,用0.9%氯化鈉溶液沖洗,每次沖洗100mL,以2倍遞增的沖洗量至800mL。
2.2.3 方法3 1∶10供試液1mL/膜。取1∶10供試液1mL加至100mL0.9%無菌氯化鈉溶液中,薄膜過濾,沖洗量從100mL開始。
2.3 回收率試驗[6-8]試驗組:取已滅菌的薄膜過濾器,每個濾器先加入約20mL稀釋液潤濕濾膜,再分別按“2.2”中方法操作加入供試液后,分別取不大于100 cfu的菌液1mL,并緩慢地把菌液分散打進薄膜過濾器中與稀釋液、供試液相混,抽濾。再分別按照上述沖洗量進行沖洗,濾干后,取膜貼種于提前準備好的瓊脂培養基平板。
菌液組:不含聚山梨酯80的稀釋液替代供試液,按試驗組操作,將相應菌液按照薄膜過濾法過濾,每一種培養基的菌液組平行制備2張膜,將膜貼種于相應培養基。
中和劑對照組:用稀釋液替代供試液,同試驗組操作,將相應菌液按照薄膜過濾法過濾,每一種培養基的菌液組平行制備2張膜,將膜貼種于相應培養基。
供試品對照組:除不加菌液外,其余操作同試驗組,按照一定的沖洗量沖洗,每一種培養基的供試品對照組平行制備2張膜,將膜貼種于相應培養基。
需氧菌總數計數相應的培養基為胰酪大豆胨瓊脂培養基,試驗菌預實驗選金黃色葡萄球菌作為敏感菌株,驗證試驗為金黃色葡萄球菌、枯草芽胞桿菌、銅綠假單胞菌、白色念珠菌、黑曲霉。霉菌和酵母菌總數計數傾注的計數培養基為沙氏葡萄糖瓊脂培養基,試驗菌株預實驗為白色念珠菌,驗證試驗為白色念珠菌、黑曲霉。待培養基凝固后,胰酪大豆胨瓊脂培養基平板于33 ℃培養,沙氏葡萄糖瓊脂培養基平板于23 ℃培養,其中試驗菌為枯草芽孢桿菌、金黃色葡萄球菌、銅綠假單胞菌的胰酪大豆胨瓊脂培養基平板培養不超過3 d,試驗菌為白色念珠菌和黑曲霉的培養基平板培養不超過5 d。
結果判斷:中和劑對照組和試驗組的加菌回收比值均在0.5~2范圍內則照該供試液制備方法和計數法測定供試品的需氧菌總數、霉菌和酵母菌總數的回收比值,若任一次試驗中比值低于0.5,應采用適宜的方法重新進行方法驗證。
中和劑對照組加菌回收比值=中和劑對照組的菌落數-菌液對照組的菌落數/菌液對照組菌落數。試驗組加菌回收比值=試驗組菌落數-供試品組菌落數)/菌液對照組菌落數。
3 微生物計數法適用性試驗結果[7-10]3.1 需氧菌總數計數方法預試驗結果 取每個品種的1個批號按“2.1”至“2.3”的順序進行加菌預試驗,預試驗結果見表1。
根據預試驗金黃色葡萄球菌回收比值結果,1∶10供試液10mL 直接薄膜過濾和1∶10供試液10mL加至90mL稀釋液中薄膜過膜,沖洗量800mL/膜時,抗風濕骨痛酊和抗骨質增生酊的金黃色葡萄球菌回收比值均小于0.5,說明抗風骨痛酊和抗骨質增生酊對金黃色葡萄球菌有較強的抑菌作用,此兩法仍未能消除供試品溶液對金黃色葡萄球菌的抑菌作用。而采用 1∶10供試液1mL加至100mL稀釋液中,過膜、沖洗量100mL/膜的方法,抗風濕止痛酊和抗骨質增生酊試驗組中金黃色葡萄球菌回收比值分別為0.86和0.77,而且中和劑對照組的菌落數與菌液對照組的菌落數比值為0.98,在0.5~2范圍內,表明兩種瑤藥酊劑采用該方法進行需氧菌總數計數應該可行。
3.2 霉菌和酵母菌總數計數方法預試驗結果 選白色念珠菌作為霉菌和酵母總數計數方法的預試驗菌,取每個品種的1個批號按照“2.2.1”進行預試驗。預試驗結果見表2。
根據預試驗白色念珠菌回收比值結果,抗風濕骨痛酊1∶10供試液10mL,薄膜過濾,沖洗量100mL/膜的試驗組白色念珠菌回收比值為0.91,在0.5~2范圍內,采用該方法進行霉菌和酵母菌總數計數應該可行。抗骨質增生酊1∶10供試液10mL,薄膜過濾,沖洗量200mL/膜的試驗組白色念珠菌回收比值為0.58,而且中和劑對照組的菌落數與菌液對照組的菌落數比值為1.02,在0.5~2范圍內,采用該方法進行霉菌和酵母菌總數計數應該可行。
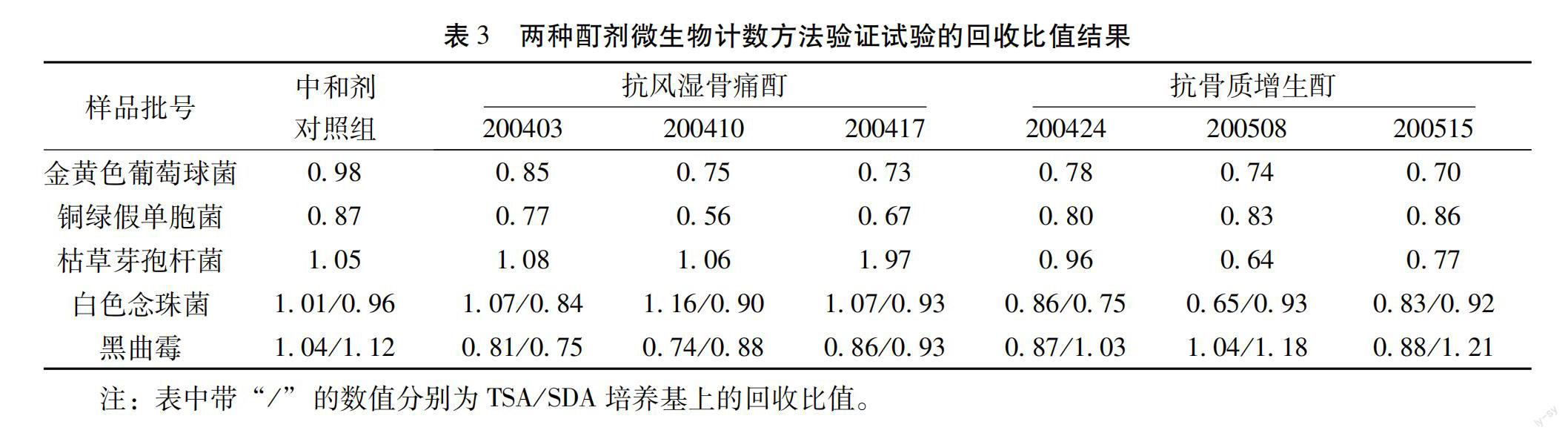
3.3 微生物計數法驗證試驗結果 根據預試驗的結果,需氧菌總數計數:抗風濕骨痛酊和抗骨質增生酊按照薄膜過濾法(1∶10供試液1mL加至100mL稀釋液中,沖洗量100mL/膜)進行3個批號5種試驗菌的加菌回收試驗;霉菌和酵母菌總數計數:抗風濕骨痛酊按照薄膜過濾法(1∶10供試液10mL,沖洗量100mL/膜)、抗骨質增生酊按照薄膜過濾法(1∶10供試液10mL,沖洗量200mL/膜)進行3個批號2種試驗菌的加菌回收試驗。結果見表3。
驗證試驗結果表明,采用薄膜過濾法(1∶10供試液1mL加至100mL稀釋液中,沖洗量100mL/膜)對抗風濕骨痛酊和抗骨質增生酊需氧菌總數的測定進行加菌回收,胰酪大豆胨瓊脂培養基(TSA)規定的5種試驗菌回收比值均在0.5~2范圍內;抗風濕骨痛酊采用采用薄膜過濾法(1∶10供試液10mL,沖洗量100mL/膜)進行霉菌和酵母菌總數的測定進行加菌回收,抗骨質增生酊采用薄膜過濾法(1∶10供試液10mL,沖洗量200mL/膜)進行霉菌和酵母菌總數的測定進行加菌回收,沙氏葡萄糖瓊脂培養基(SDA)規定的兩種試驗菌的回收比值均在0.5~2范圍內。符合《中國藥典》2020年版四部通則1105(非無菌產品微生物:微生物計數法)的有關規定,方法可行。
3.4 樣品需氧菌總數、霉菌和酵母菌總數檢查結果 分別取抗風濕止痛酊和抗骨質增生酊各3批,按上述確定的方法進行需氧菌總數、霉菌和酵母菌總數的檢查,結果樣品中需氧菌總數菌均小于10 cfu/mL,霉菌和酵母菌總數均小于1 cfu/mL,符合相關規定。
4 控制菌檢查方法適用性試驗及結果
4.1 金黃色葡萄球菌
4.1.1 直接接種法[9-12]試驗組:分別取1∶10供試液10mL接種至100mL、200mL、300mL、400mL、500mL胰酪大豆胨液體培養基(TSB)中,同時加入金黃色葡萄球菌不大于100 cfu,30~35 ℃培養18~24 h。取培養物劃線接種于甘露醇氯化鈉瓊脂培養基平板,30~35 ℃培養18~72 h,觀察其菌落形態。陰性菌對照組:取大腸埃希菌作為陰性對照試驗菌,方法同試驗組。
4.1.2 薄膜過濾法[13-15]試驗組:分別取1∶10供試液10mL過膜,分別沖洗100mL/膜、200mL/膜、300mL/膜,在最后一次沖洗液中加入不大于100 cfu金黃色葡萄球菌,濾膜接種至100mL胰酪大豆胨液體培養基(TSB)中, 余下操作同直接接種法。
4.2 銅綠假單胞菌 試驗組:分別取1∶10供試液10mL接種至100mL、200mL胰酪大豆胨液體培養基(TSB)中,同時加入金黃色葡萄球菌不大于100 cfu,30~35 ℃培養18~24 h,按藥典規定檢查。陰性菌對照組:取大腸埃希菌作為陰性對照試驗菌,方法同試驗組。
4.3 控制菌適用性試驗結果 兩種酊劑分別先取其中1個批號按上述方法進行預試驗,試驗結果為陰性對照組菌無菌落生長。兩種酊劑試驗組結果見表4。再根據預實驗結果各取3個批號的樣品,進行加菌驗證試驗。結果見表5。
3批樣品的控制菌適用性試驗結果表明,采用薄膜過濾法(1∶10供試液10mL過膜,沖洗量300mL/膜,濾膜接種至100mLTSB)對抗風濕骨痛酊、抗骨質增生酊的金黃色葡萄球菌的測定進行加菌驗證試驗,采用直接接種法(1∶10供試液10mL接種至200mLTSB)對抗風濕骨痛酊、抗骨質增生酊的銅綠假單胞菌的測定進行加菌驗證試驗,符合《中國藥典》2020年版四部通則1106(非無菌產品微生物限度檢查:控制菌檢查法)的有關規定,方法可行。
4.4 樣品控制菌檢查結果 分別取抗風濕止痛酊和抗骨質增生酊各3批,按上述確定的方法進行控制菌金黃色葡萄球菌、銅綠假單胞菌的檢查,結果樣品中均未檢出金黃色葡萄球菌和銅綠假單胞菌(1mL)。
5 結果分析和討論[16-17]5.1 計數方法適用性試驗方法的選擇 抗風濕止痛酊和抗骨質增生酊均為液體外用制劑,其微生物限度標準如下:需氧菌總數不超過102cfu/mL;霉菌和酵母菌總數不超過101cfu/mL;不得檢出金黃色葡萄球菌、銅綠假單胞菌(1mL)。兩種酊劑的溶劑均為55%乙醇,有一定的抑菌作用,用1%聚山梨酯80的pH7.0無菌氯化鈉蛋白胨緩沖液作為稀釋液樣品容易過濾,所以在確定需氧菌總數計數、霉菌和酵母菌總數計數的測定方法時,在供試液容易過膜的情況下,優先采用薄膜過濾法。
5.2 稀釋劑的選擇 抗風濕骨痛酊、抗骨質增生酊處方及工藝中并未加入油性物質,但是用pH 7.0無菌氯化鈉蛋白胨緩沖液作為稀釋液時,所制備供試液難以過膜,且后續沖洗液也是很難過濾沖洗,而用1%吐溫80的pH 7.0無菌氯化鈉蛋白胨緩沖液作為稀釋液時,則供試液很容易過膜且后續沖洗液過濾是順暢快速的。筆者查閱了按照2015年《中國藥典》進行研究的相關文獻以及工作中收到藥品生產企業的微生物限度方法學研究資料結合筆者在酊劑微生物限度檢查適用性試驗中發現,采用薄膜過濾法對酊劑進行微生物限度檢查時,用含1%吐溫80的pH 7.0無菌氯化鈉蛋白胨緩沖液作為稀釋液時,可解決酊劑供試液堵膜、過濾不暢這一難題。
5.3 沖洗量的選擇以及加菌環節的選擇 抗風濕骨痛酊、抗骨質增生酊計數方法預實驗結果顯示:方法1、方法2沖洗量至800mL時,回收比值均小于0.5,表明兩種酊劑均對金黃色葡萄球菌有較強的抑制作用,而方法3沖洗量為100mL時,回收比值均能到達要求。所以對于抑菌作用較強的酊劑驗證方案可采用1∶10供試液10mL直接過濾、1∶10供試液10mL加至90mL稀釋液中混勻過濾、1∶10供試液1mL加至100mL稀釋液中混勻過濾的順序進行。采用薄膜過濾法進行藥品微生物限度檢查適用性試驗時,沖洗量可以選擇每次100mL,最大沖洗量為500mL為宜。這樣可以更快速試驗出酊劑科學、快捷、有效的微生物限度檢查計數方法。
目前藥典并未明確薄膜過濾法在計數方法適用性試驗的加菌環節,抗風濕骨痛酊、抗骨質增生酊兩種瑤藥酊劑的計數方法適用性試驗均采用前加菌,即在供試液或稀釋后的供試液中加菌后過濾,再進行沖洗。前加菌更能反映藥品本身抑菌作用的強弱,在樣品的特性允許以及沖洗量不大于500mL的情況下可盡量選擇前加菌試驗。
參考文獻
[1]馬林納,白明,苗明三. 中藥酊劑臨床外用現狀與分析[J]. 中華中醫藥雜志,2021,36(1):532-535.
[2]龐云娟, 樊文研, 劉康連, 等. 藥品微生物限度檢查方法學驗證的研究進展[J]. 中成藥, 2017, 39(10):2137-2140.
[3]胡昌勤.藥品微生物控制現狀與展望[J]. 中國藥學雜志, 2015, 50(20):1747.
[4]國家藥典委員會. 中華人民共和國藥典(2020年版四部)[M]. 北京:中國醫藥科技出版社, 2020:160-171.
[5]趙雪衛,王紅然,張西果. 滴眼用利福平微生物限度檢查方法的建立[J]. 化工管理,2013(12):130.
[6]龐云娟, 劉康連, 周曉婷. 4種口服液微生物限度檢查法驗證[J]. 醫藥導報, 2017, 36(8)增刊: 82-85.
[7]徐暉. 止得咳顆粒劑制備工藝及質量標準的研究[D]. 南寧:廣西中醫藥大學,2019.
[8]王玲,郭志廷,楊峰,等. 薄膜過濾法在中藥常山散微生物限度檢查中的應用研究[J]. 中國獸醫雜志,2019,55(5):99-103.
[9]劉康連, 龐云娟, 周曉婷.5種同名異型中藥制劑微生物限度檢查法的建立與結果分析[J]. 中成藥, 2017, 39(70): 1515-1518.
[10]夏天,崔迎,任文鑫,等. 清火片(膠囊)微生物限度檢查方法適用性試驗[J]. 安徽醫藥,2021,25(6):1114-1117.
[11]遲雪潔, 劉欣. 活血通絡搽劑微生物限度檢查方法的建立[J]. 山東中醫藥大學學報, 2018, 42(1): 83-85.
[12]滕鈺, 徐洪, 鄒莉, 等. 重樓解毒酊微生物限度檢查方法適用性探討[J]. 中成藥, 2019, 41(4): 951-953.
[13]汪琦, 李雄英, 吳智娟, 等. 膚寧洗劑微生物限度檢查方法的建立及驗證[J]. 浙江中西醫結合雜志, 2017, 27(8): 713-716.
[14]關迪, 曹曉云. 風油精微生物限度檢查方法適用性的建立[J]. 中國藥品標準, 2020, 21(3): 239-243.
[15]王俊. 傷痛克酊微生物限度檢查方法建立[J]. 中國民族民間醫藥, 2017, 26(23): 34-38.
[16]楊群, 肖文濤. 兩種中藥酊劑微生物限度檢查方法適用性研究[J]. 藥品評價, 2020, 17(17): 30-32.
[17]張秀花,劉艷平,任仲麗. 10組同名異型中藥制劑微生物限度檢查方法的建立[J]. 中國藥物經濟學,2021,16(5):118-124
(收稿日期:2021-11-28 編輯:劉 斌)

