核心素養導向的離子平衡圖像試題特征及教學建議
石秀梅 黃都
【摘要】本文闡述離子平衡圖像試題的考查目標與測評價值,匯編2017—2021年高考化學全國卷離子平衡圖像試題并分析試題考查的知識規律,提出有針對性的教學建議與試題命制建議。
【關鍵詞】化學學科核心素養 離子平衡圖像 試題命制 教學建議
【中圖分類號】G63 【文獻標識碼】A
【文章編號】0450-9889(2022)20-0066-06
大規模考試的試題對教學具有指導作用。本文筆者以2017—2021年高考化學全國卷離子平衡圖像試題為研究對象,歸納總結該類試題考查的知識點特征發現,這些知識點均來源于教材,但能力要求幾乎都高于教材;這些知識點在教材中的呈現方式比較單一,但在試題中的呈現方式多樣又抽象,且情境與設問每年都有創新。也就是說,高考試題可以作為教材內容的補充,促進學生學科核心素養的養成。
一、離子平衡圖像試題的考查目標及測評價值
《普通高中化學課程標準(2017年版2020年修訂)》(以下簡稱《新課標》)中關于“主題3:水溶液中的離子反應與平衡”的教學提示及策略為:關注水溶液體系的特點,結合實驗現象、數據等證據素材,引導學生形成認識水溶液中離子反應與平衡的基本思路;通過讓學生畫微觀圖示、解釋宏觀現象等具體任務探察學生對水溶液體系認識的障礙點,以進一步明確教學重點和難點;發展學生“宏觀辨識與微觀探析”“變化觀念與平衡思想”以及“證據推理與模型認知”等化學學科核心素養,培養思維能力。修訂前后的課程標準在核心知識點方面的要求基本相同,但《新課標》更強調學生對核心知識模型建立過程的理解,更注重知識學習的逐階建構和系統掌握過程。
從近五年離子平衡圖像試題來看,命題者似乎試圖從以下幾個方面考量以達到測評目標。
(一)化學觀的構建:通過分析電離平衡、水解平衡、沉淀溶解平衡等的存在及平衡移動,形成并發展學生的微粒觀、平衡觀、守恒觀和變化觀。
(二)模型的建構:水溶液中平衡常數的計算模型、pH的計算模型、水溶液中的平衡移動模型等。
(三)化學用語的熟練使用:電離方程式、水解方程式、平衡常數表達式。
(四)化學平衡中定量思想:提高定量分析問題的能力,掌握守恒法、各種平衡常數計算。
(五)信息的加工:提高用圖表獲取信息和加工信息的能力,能夠根據各種圖表分析物質的變化過程和反應原理。
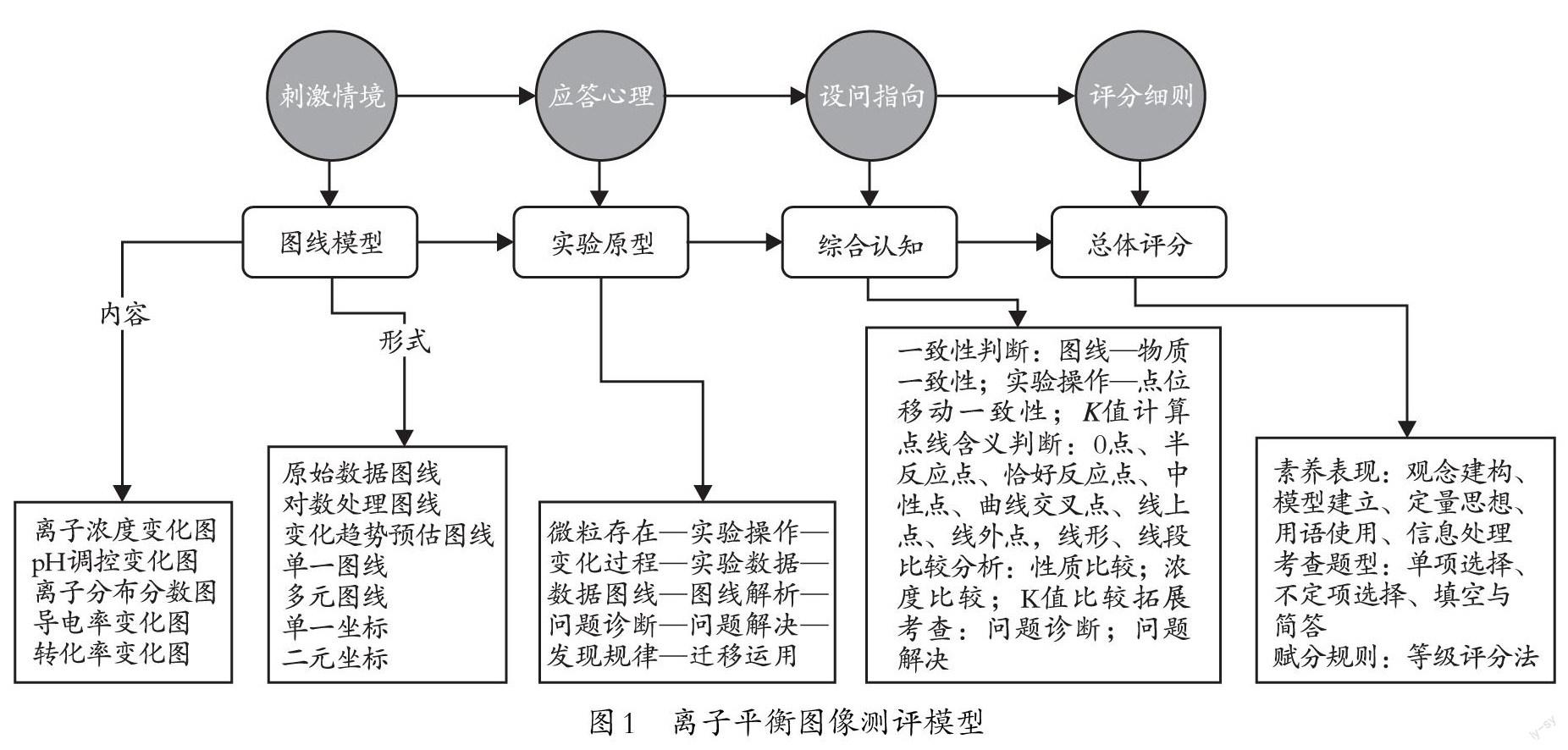
筆者認為,離子平衡圖像試題主要考查的素養目標是“模型認知”,輔助考查的素養目標是“宏微結合”和“變平思想”。其測評模型如下頁圖1所示。
測評模型指向的關鍵能力主要有兩個方面:一是能說出模型與原型的關系;二是建立“微粒存在—實驗操作—變化過程—實驗數據—數據圖線—圖線解析—問題診斷—問題解決”的模型認知能力。具備此類素養的考生,可以通過圖線來認知化學實驗過程的微觀變化以及化學實驗創新的實際效果,為未來投身化學基礎研究、化學實踐應用等工作奠定能力基礎。
二、離子平衡圖像試題結構分析
(一)2017—2021年全國卷離子平衡圖像試題匯編
1.滴定曲線
(1)與pH、分布系數及體積相關的滴定曲線
“二縱一橫”坐標體系,橫坐標為滴加已知濃度的NaOH溶液的體積;左縱曲線①②為體系中酸分子或酸根離子的分布系數[]如δ(A2-)=[cA2-1cH2A+cHA-+cA2-1]變化趨勢圖,右縱曲線③為溶液pH變化趨勢圖。此類圖線以橫坐標V為自變量,因變量是δ和pH。δ和pH并不存在一一對應關系,例如,當δ(HA-)=δ(A2-)時,對應的pH=2,而不是pH=4.8。
(2)與pH、對數相關的滴定曲線
以離子對的比值的對數值和溶液pH作為協變量,可以有效觀察滴定時pH變化過程中,各類粒子濃度的大小關系及變化趨勢。例如,圖3中溶液pH由4.4線性增大至5.4過程中,體系中c(H2X)逐漸減小,c(HX-)、c(X2-)逐漸增大;pH=4.4時,c(H2X)=c(HX-),pH=5.4時,c(HX-)=c(X2-)。導致pH、對數值變化的因素是溶液中c(H+)的不斷減少。各變量之間存在良好的線性關系,緣于特定溫度下Kw、Ka[1]、Ka[2]的恒定不變性。
(3)與導電能力相關的滴定曲線
相對導電能力由電導率、離子濃度換算而成,溶液中自由移動離子濃度越大,導電能力越強。圖4中,由a點到b點,是Na+和相應的陰離子濃度協同增大且同時生成水的過程;由b點到c點,是反應達到終點之后,繼續滴加NaOH,導致Na+和OH-同時增大且不生成水的過程。因此,ab段的導電能力增長率小于bc段。
(4)與沉淀相關的滴定曲線
下頁圖5為工業上利用Cu和Cu2+在一定條件下發生歸中反應除去廢水中Cl-的反應進程曲線。在體系中Cu足量的情況下,c(Cu+)隨著c(Cu2+)增大而增大,當c(Cu+)達到10-2mol/L時,溶液中的Cl-的基本除凈。
下頁圖6為 AgNO3滴定的Cl-的反應進程曲線。曲線上各點的溶液滿足關系式c(Ag+)·c(Cl-)=Ksp(AgCl),當反應進程達到化學計量點(恰好完全反應)時,由于存在沉淀—溶解平衡,此時的c(Ag+)=
c(Cl-)=K[1/2sp](AgCl)。所生成沉淀的溶解度越小,曲線的“拐點”越上移。
2.沉淀—溶解平衡曲線
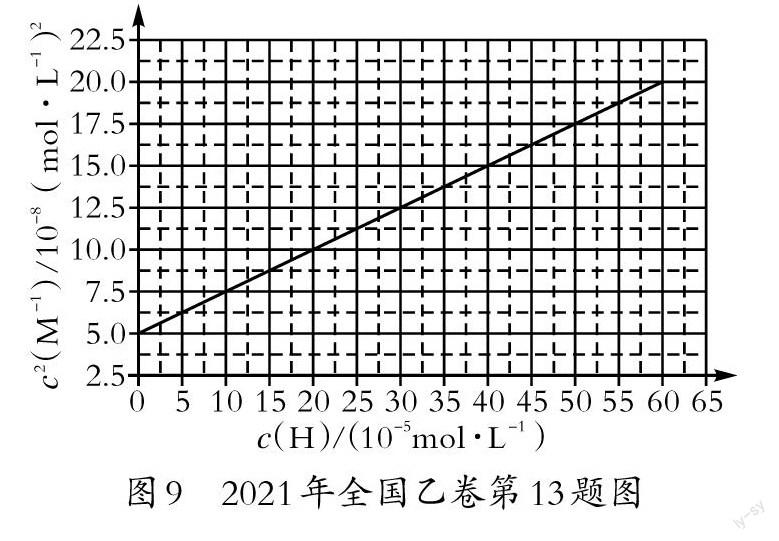
圖7是沉淀—溶解平衡等溫線,圖8為同型難溶電解質Ksp線,圖9為弱酸強堿難溶鹽的酸溶曲線。這些試題均考查了不同情形中的Ksp、Ka計算及其應用。
3.分布系數曲線
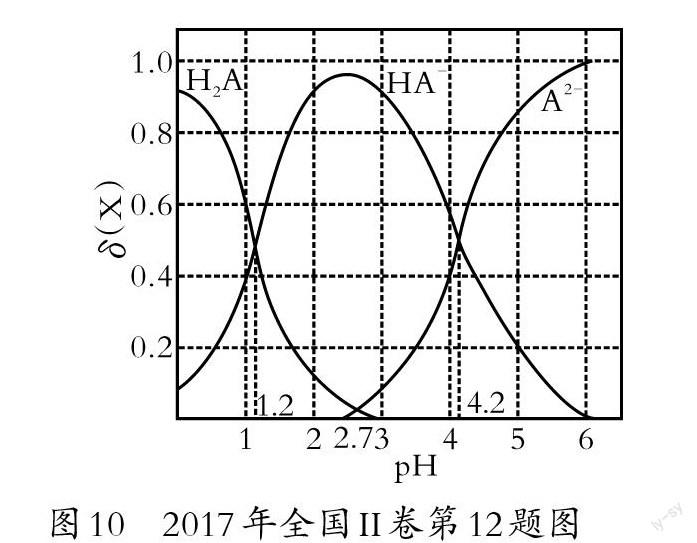
分布系數描述了不同pH環境中的弱酸物料分布及其變化情況,建立了基于數據模型的離子濃度大小比較方法,為判斷特定體系狀態中的離子反應方程式,計算弱酸平衡常數,判定反應終點,判斷物料守恒、電荷守恒等提供支持性信息。
(二)學業水平要求及體現的化學學科核心素養
離子平衡圖像的原型是人為操作下的微觀粒子數量關系及其變化情況,我們通過運用離子濃度、對數值、pH、分布系數、K等化學計量符號,對實驗數據或假定數據進行恰當處理,發現數列之間的線性關系,進而繪制成平衡圖像中的曲線模型。曲線模型的背后是數學模型、操作模型和微粒及其變化的相像模型,解答離子平衡圖像試題要求學生具備較強的數學能力、化學實驗能力和化學想象力。試題體現了測評的基礎性、綜合性和復雜性,難度較大,通常被設為壓軸題。
現以2021年全國甲卷第12題為例。
例1(2021年全國甲卷)12.已知相同溫度下,Ksp(BaSO4) A.曲線①代表BaCO3的沉淀溶解曲線 B.該溫度下BaSO4的Ksp(BaSO4)值為1.0×10-10 C.加適量BaCl2固體可使溶液由a點變到b點 D. c(Ba2+)=10-5.1時兩溶液中[cSO2-4cCO2-3]=10y2-y1 從《新課標》的內容要求、模塊主題學業要求、素養水平要求和學業質量水平要求等四個視角,可以系統地解構出該試題的知識傳授、能力訓練和素養培育功能(如表1所示)。 A、B選項設問比較直接,均是基于Ksp模型的分析和推理。C選項,運用平衡移動模型,通過定性分析和定量計算來推導結論。定性分析部分:向溶液中加入Ba2+,導致Ba2+濃度增大、陰離子濃度減小,曲線由b向a變動。定量分析部分:體系維持K值不變。D選項,c(Ba2+)相同,根據兩者的Ksp大小比較,c(SO[2-4])必然小于c(CO[2-3]),即兩者比值必然大于1,間接利用Ksp模型。 (三)考查的知識及調用知識的規律 1.考查的核心知識 Ka、Ksp的計算,離子濃度關系(大小關系、三大守恒關系),離子濃度變化規律。 2.調用知識的規律 有關離子濃度關系的內容因為平時訓練較多,加之形式比較單一,多數學生可以較好地掌握,但面對Ka、Ksp的計算或與常數表達式變式有關的內容,學生經常覺得無從下手。教師通過分析可以總結出一定的解題模型與規律,如在溫度一定的前提下,只要出現兩種離子濃度比,幾乎均與K的表達式有關,將0點數據或曲線交叉點數據與常數的表達式相關聯,即可突破。 如解答2017年全國I卷第13題(圖像如圖3所示),如何確定lg[cX2-cHX-]、lg[cHX-cH2X-]與曲線的關系?此處出現兩種微粒的濃度比,若在該濃度比的基礎上均乘以c(H+),就得到H2X二級、一級電離平衡常數的對數,因K只與溫度有關,可隨意選擇橫坐標的0點(對應離子的濃度相等,可約掉)。經觀察,兩曲線對應的pH大小不一,pH小的點應為一級電離對應的點,即可知右下方直線為lg[cHX-cH2X-]。 常見試題的設問形式不盡相同,但考查的都是K表達式及其變式、K只與溫度有關等知識。筆者經概括總結發現,0點、半反應點、恰好反應點、中性點、曲線交叉點,均有可能成為解答該類題型的突破口。 三、結論與建議 (一)基本結論 試題每年都在創新,情境和坐標不斷變化。但無論題目怎么變,不管圖像是以直線、曲線,還是以單線、雙線,或是以平行線、交叉線等方式呈現,設問均緊緊圍繞核心知識展開。核心知識需要在不同情境中調用,變式運用才有可能轉化為關鍵能力,基于學習反思、知識整合的關鍵能力訓練,才有可能實現此類試題的化學學科核心素養培育作用。 (二)教學建議 單旭峰認為,化學學科考試必須堅持引導教學;通過提供新反應、新裝置、新成果、新技術,考查學生提取、加工和整合信息的能力,使其形成自主學習、終身學習的意識和能力。此類圖像試題考查的就是學生提取、加工和整合信息的能力。教師在教學過程中,可以布置學生繪制數據曲線、微觀圖示,并用于解釋宏觀現象和反應規律,以外顯學生的已有認識、認識障礙,啟發學生的思維,完成由感性認識向理性認識的飛躍。 為了引導學生開展證據與推理、模型與解釋、符號與表征等學習活動,教師在布置任務的過程中,需要注重問題設計的梯度、知識的循序漸進。 以2019年全國Ⅱ卷的第12題為例(試題圖像如圖6所示),筆者改編設問如下。 溫度T1時,以CdS(s)[]Cd2+(aq)+S2-(aq) ΔH>0為例,回答下列問題: ①溫度T1時,在圖13所示坐標系中,畫出難溶物CdS溶解達平衡后,溶液中c(Cd2+)與c(S2-)的變化曲線(提示:K=xy為反比例函數)。 ②若上述溶液的溶質只有CdS、c(Cd2+)與c(S2-)應處于圖14曲線中的? ?點(填“a”“b”或“c”)。 ③往上述溶液中加入少量Na2S固體后,c(Cd2+)、c(S2-)如何變化?兩者所處的位置由a移向何處? ④能否通過圖15中A、B、C所在的位置來判斷CdS在該條件下是否析出沉淀?理由是什么? ⑤在圖15的基礎上,畫出溫度升高到T2時,溶液中c(Cd2+)與c(S2-)的變化曲線。 ⑥(2019年全國Ⅱ卷)絢麗多彩的無機顏料的應用曾創造了古代繪畫和彩陶的輝煌。硫化鎘(CdS)是一種難溶于水的黃色顏料,其在水中的沉淀溶解平衡曲線如圖7所示。下列說法錯誤的是 A.圖中a和b分別為T1、T2溫度下CdS在水中的溶解度 B.圖中各點對應的Ksp的關系為:Ksp(m)=Ksp(n) C.向m點溶液中加入少量Na2S固體,溶液組成由m沿mpn線向p方向移動 D.溫度降低時,q點的飽和溶液的組成由q沿qp線向p方向移動 解決問題①至問題⑤的過程,既能體現學生的認識發展,又能讓學生將抽象的知識直觀化,還能發展學生的演繹推理、系統假設等思維能力。學生一旦建構好了模型,遇到此類問題就能舉一反三,在不進行機械刷題的前提下提升解決問題的能力,輕而易舉突破難點。 接下來,教師還可以改變坐標,將曲線轉換成直線,將反比例函數轉變為線性函數,圖像表達形式多樣化,學生的思維也多樣化了。 在復習過程中,教師必須開展專項訓練,讓學生掌握解決這類題的必備知識,如電離平衡、溶解平衡、電荷守恒、物料守恒、離子濃度大小關系、簡單計算等,從而掌握解讀圖像信息的方法、分析推理方法、解題步驟和方法等關鍵能力。 (三)命題建議 從近幾年已進入新高考的省(區、市)的學業水平試題來看,當選擇題有2分和4分的兩種類型時,2分的試題為基礎題,4分的試題綜合性較強,這符合新高考基礎性、綜合性的要求,也有利于了解學生的基礎水平和綜合水平。當前全國卷有關“離子平衡圖像”的試題綜合性較強,適合作為4分試題壓軸。若將各選項的考查點分解成幾道小題,形成單點結構的試題,也可作為2分試題。這樣不但能使試題呈現出一定的梯度,還能讓教師觀察到學生的思維過程,充分體現了試題的評價價值。 例如2020年全國I卷第13題(試題圖像如圖10所示),教師可將該圖像分解為兩個圖像(如圖16所示)進行試題的命制。 試題命制的創新性,還可以通過坐標系的變化來體現。 例如2021年全國乙卷第13題(試題圖像如圖8所示),該試題所調用的知識并沒有改變,還是考查離子平衡的核心知識,但是試題圖示用一個與原平衡體系無直接關聯的c(H+)作橫坐標,增加了試題情境的新穎性。 教師掌握識圖技能,是勝任化學科研、生產實踐的重要素養,能夠為學生在科研、生產、實驗情境中進一步探察問題、解決問題奠定技能基礎。因此,教師有必要增強自身能力,以求更好地培育學生,發展學生的化學學科核心素養。 參考文獻 [1]單旭峰.基于高考評價體系的化學科考試內容改革實施路徑[J].中國考試,2019(12). [2]房喻,徐端鈞.普通高中化學課程標準(2017年版)解讀[M].北京:高等教育出版社,2018(11). 注:本文系廣西教育科學“十三五”規劃2019年度廣西考試招生研究專項課題“基于樣卷研發的等級性學考科目命題團隊建設實踐研究”(2019ZJY032)、廣西教育科學“十三五”規劃2020年度廣西考試招生研究專項課題“普通高中學業水平選擇性考試命題素材管理系統優化研究”(2020ZJY190)、廣西教育科學“十三五”規劃2020年度考試招生研究專項課題“普通高中學業水平考試的審題程序、規范和技術研究”(2020ZJY221)的研究成果。 作者簡介:石秀梅(1977— ),廣西靈川人,高級教師,主要研究方向為中學化學教育教學;黃都(1973— ),通訊作者,廣西都安人,博士,教授,主要研究方向為教學評整體設計。 (責編 劉小瑗)

