溶解度曲線圖的深度解讀與教學思考
卓高峰


摘要: 從溶解度曲線圖的類型、溶解度隨溫度變化的原理、析出晶體思維模型等多角度解讀溶解度曲線圖,重新構建對溶解度曲線圖的深度理解,發展學生模型認知的學科核心素養與物質制備的核心思想,充分發揮圖像的潛在教學功能。
關鍵詞: 溶解度曲線解讀; 教學思考; 中學化學教學
文章編號: 10056629(2022)07008105
中圖分類號: G633.8
文獻標識碼: B
利用物質的溶解性,從溶液中析出固體是物質分離提純的重要方法。溶解度曲線是物質溶解性顯性化與定量化的呈現形式,因此,深度認識溶解度曲線圖顯得尤為重要。溶解度曲線是根據同種物質在不同溫度下的溶解度繪制出來的曲線。線上任一點都是對應溫度下的飽和溶液,線段下部為不同溫度下的不飽和溶液,線段上部是過飽和溶液,處于介穩狀態。本文嘗試分析溶解度曲線的類型,解釋溶解度隨溫度變化的原理,提煉析出晶體的思維模型,應用思維模型解決物質分離提純問題,重新構建對溶解度曲線圖的深度認識,發展學生模型認知的學科核心素養與物質制備的核心思想,充分發揮圖像的潛在教學功能。
1 溶解度曲線的類型
蘇教版教材兩次呈現溶解度曲線圖,《化學1》第18頁如圖1和《實驗化學》第13頁如圖2。其中氯化鉀、硝酸鉀溶解度曲線圖最具代表性,氯化鉀的溶解度隨溫度變化小,屬于“緩增型”;硝酸鉀的溶解度隨溫度變化大,屬于“陡增型”。大部分固體的溶解度是隨溫度的升高而增大,但有個別物質如Ca(OH)2的溶解度卻是隨溫度的升高而降低,屬于“下降型”(見圖3);還有少數物質如Na2SO4、 ZnSO4等帶結晶水的鹽,溶解度往往會隨溫度升高先增加后下降,稱為“升降型”(見圖4)。此類物質溶解性變化的主要原因是固體結晶水合物的存在。因為結晶水合物的存在,水合離子脫離晶體變得更加容易,免去了再生成水合離子的過程,這樣的過程一般都是吸熱的[1]。
從熱力學角度如何解釋物質的溶解度隨溫度的變化關系?能否依據溶解焓用勒夏特列原理來解釋呢?例如,圖示中KCl、 KNO3、 Ca(OH)2和Na2SO4四種物質溶于水,達到飽和時存在溶解平衡:
KCl(s)K+(aq)+Cl-(aq)ΔHθ=17.28kJ·mol-1
KNO3(s)K+(aq)+NO-3(aq)ΔHθ=35.61kJ·mol-1
Ca(OH)2(s)Ca2+(aq)+2OH-(aq)ΔHθ=-17.83kJ·mol-1
Na2SO4·10H2O(s)2Na+(aq)+SO2-4(aq)+10H2O(l)ΔHθ=78.5kJ·mol-1
Na2SO4(s)2Na+(aq)+SO2-4(aq)ΔHθ=1.9kJ·mol-1
分析溶解焓,Na2SO4的溶解度并不符合用勒夏特列原理來解釋。以KOH為例來說明這個問題[2]。KOH的溶解度很大,常溫下約為110g/100g水。將幾粒固體KOH放入100g水中,可以溶解,且過程明顯放熱。又有實驗事實表明,KOH的溶解度隨溫度升高而增大。從勒夏特列原理角度考慮,以上兩種實驗現象似乎是矛盾的。實則不然,勒夏特列原理適用的對象是平衡體系(至少是接近平衡的體系)。在KOH飽和溶液中加入少許固體KOH,加熱時這些KOH溶解,說明溶解度隨溫度的升高而增大,由此可以判斷平衡狀態的KOH溶解是吸熱反應。KOH的溶解度很大,將幾粒固體KOH放入100g水中這個溶解過程遠遠偏離平衡可以放熱,但不說明在接近平衡狀態時整個溶解過程是放熱的。
基于此,對于溶解度大的物質,不能用溶解焓判斷溶解度與溫度的關系。溶解度的溫度系數,可由溶解過程Gibbs能變ΔGθ=ΔHθ-T·ΔSθ判斷[3]: 溫度升高,ΔGθ減小,表明溶解傾向增強,即溫度系數為正;反之,溫度系數為負。運用ΔGθ=ΔHθ-T·ΔSθ計算KOH、 Ca(OH)2、 KCl和KNO3四種物質不同溫度下的ΔGθ,解釋溶解度隨溫度變化的原因。
分析表1數據,KOH、 KCl和KNO3的ΔGθ隨溫度的升高而減小,越來越容易溶解,所以它們的溶解度隨溫度的升高而增大,并且KNO3在同一溫度段中,吉布斯能減小得更多,溶解度隨溫度的升高增大得也更多。Ca(OH)2的ΔGθ隨溫度的升高而增大,越來越難溶,所以它的溶解度隨溫度的升高而降低。
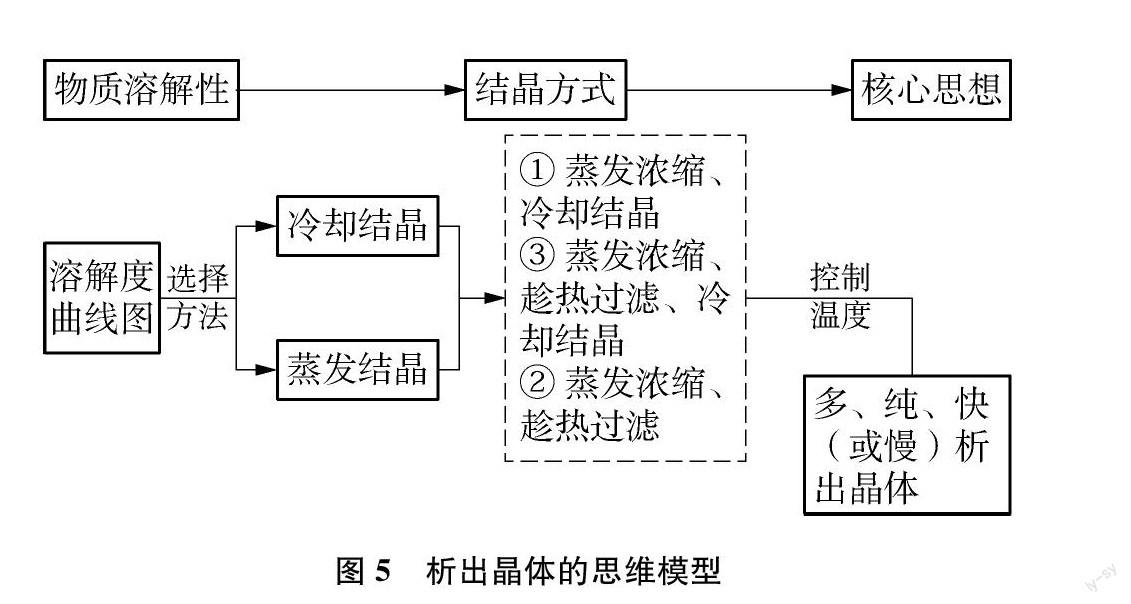
2 溶解度曲線的變化與析出晶體思維模型
例1 請參照圖2的溶解度曲線,設計實驗方案提純或制備下列物質。
①現有混有少量氯化鈉的硝酸鉀粉末,設計實驗方案提純硝酸鉀;
②現有混有少量硝酸鉀的氯化鈉粉末,設計實驗方案提純氯化鈉;
③現有1mol硝酸鉀和1mol氯化鈉的混合粉末,設計實驗方案提純硝酸鉀;
④現有1mol硝酸鈉和1mol氯化鉀的混合粉末,設計實驗方案制備硝酸鉀。
根據圖2及表2提供的數據[表2是四種鹽在不同溫度下的溶解度(g/100g水)],分析下列過程。
(計算時假定: 鹽類共存時不影響各自的溶解度;過濾晶體時,溶劑損耗忽略不計)
(1) 取23.4g NaCl和40.4g KNO3,加70.0g H2O,加熱溶解,在100℃時蒸發掉50.0g H2O,維持該溫度,過濾析出晶體。計算所得晶體的質量(m高溫);將濾液冷卻到10℃,待充分結晶后、過濾,計算所得晶體的質量(m低溫)。
(2) 另取34.0g NaNO3和29.8g KCl,同樣進行如上實驗,在100℃和10℃得到的晶體質量(m′高溫和m′低溫)分別是多少?
根據溶解度曲線圖,可讀出溶解度隨溫度的變化關系,選擇合適的結晶方式,析出晶體。NaCl溶解度隨溫度變化小,可采用蒸發結晶從水溶液中析出晶體;KNO3溶解度隨溫度變化大,可采用冷卻結晶從水溶液中析出晶體。若從KNO3、 NaCl的混合物中分離晶體,要根據兩種固體量的相對多少確定結晶方式。(1)KNO3的量多,要根據KNO3的溶解性設計方案,采用冷卻結晶。具體操作: 溶解、蒸發濃縮、冷卻結晶、過濾。結晶方式歸納為: ①蒸發濃縮、冷卻結晶。(2)NaCl的量多,要根據NaCl的溶解性設計方案,采用蒸發結晶。具體操作: 溶解、蒸發濃縮、趁熱過濾。結晶方式歸納為: ②蒸發濃縮、趁熱過濾。(3)KNO3與NaCl的量相當,要提純KNO3,要根據NaCl的溶解性除去NaCl,采用蒸發結晶;再根據KNO3的溶解性析出KNO3晶體,選擇冷卻結晶。具體操作: 溶解、蒸發濃縮、趁熱過濾、冷卻結晶、過濾。結晶方式歸納為: ③蒸發濃縮、趁熱過濾、冷卻結晶。(4)《實驗化學》中硝酸鉀晶體的制備,以硝酸鈉和氯化鉀為原料,利用復分解反應NaNO3+KCl
KNO3+NaCl制備KNO3晶體,其分離KNO3晶體的方法與(3)完全相同。(5)制備KNO3晶體的過程,出現兩次晶體析出: 第一次趁熱過濾,分離出NaCl晶體,會有少量KNO3晶體析出。第二次冷卻結晶,KNO3晶體析出,同時會有少量的NaCl析出。學生對兩次晶體的析出,還只停留在定性理解上,提供表2數據,對問題進行定量設計,使學生對晶體的分離提純有更加深刻的認識。
上述三種結晶方式①、 ②、 ③,實質是蒸發結晶與冷卻結晶的變化形式。因此,根據溶解度曲線圖,學會從蒸發結晶、冷卻結晶以及變式的角度思考析出晶體的方式,結合后續的實例,理解“多、純、快(或慢)”物質制備的核心思想,提煉變溫條件下從溶液中析出晶體的思維模型,如圖5所示。
3 析出晶體思維模型的應用與完善
以“物質制備、分離與提純”為情境,運用化學知識,解決實際問題是高考化學實驗考查的經典模式。其中,從溶液中獲得晶體,通常涉及到蒸發結晶與冷卻結晶,要充分利用析出晶體的思維模型,選擇合適的結晶方式,控制溫度,分離提純晶體。
例2 (2021.1浙江選考)根據相關物質的溶解度隨溫度變化如圖6所示。重結晶前,為了從Na2Cr2O7溶液中得到雜質較少的K2Cr2O7粗產品,從下列選項中選出合理的操作(操作不能重復使用)并排序: 溶解KCl→()→()→()→()→重結晶。
根據相關物質的溶解度曲線(圖6)可知,Na2Cr2O7溶液中加入KCl發生反應Na2Cr2O7+2KCl
K2Cr2O7+2NaCl, K2Cr2O7的溶解度隨溫度變化大,NaCl溶解度隨溫度變化小,所以選擇冷卻結晶的方式析出K2Cr2O7。能否類比制備硝酸鉀晶體的方法來制備較純的K2Cr2O7?即100℃蒸發溶劑,趁熱過濾除去NaCl,冷卻結晶析出K2Cr2O7。但分析溶解度曲線圖得出: 100℃K2Cr2O7的溶解度大約是NaCl的2倍多,根據反應的化學方程式,理論上可生成的K2Cr2O7的質量也是NaCl的2倍多,趁熱過濾可除去少量NaCl,但冷卻結晶析出K2Cr2O7晶體的同時也會有較多的NaCl晶體析出,得到的K2Cr2O7純度不高。50℃時兩者溶解度相等,生成的K2Cr2O7的質量是NaCl的2倍多,選擇50℃蒸發溶劑,蒸發至溶液出現晶膜,冷卻結晶,可得到雜質較少的K2Cr2O7粗產品。故答案為: aedc。此過程中K2Cr2O7晶體的析出方式屬第①種類型,關鍵在于蒸發濃縮的溫度控制,以得到更純的晶體。
例3 (2018.11浙江選考)從ZnSO4溶液中獲取制備ZnSO4·7H2O,需要用到下列所有操作: a.蒸發至溶液出現晶膜;b.在60℃蒸發溶劑;c.冷卻至室溫;d.在100℃蒸發溶劑;e.過濾。請給出上述操作的正確順序(操作可重復使用)。
已知: ZnSO4的溶解度(物質在100g水中溶解的質量)隨溫度變化曲線如圖7。
根據ZnSO4的溶解度曲線圖,采用冷卻結晶的方式析出晶體,即60℃蒸發溶劑再冷卻結晶,析出ZnSO4·7H2O晶體最多。考慮到60℃蒸發速度慢,可采用兩次蒸發: 蒸發濃縮→冷卻溶液→二次蒸發濃縮→冷卻結晶。故答案是dabace。而本例中,ZnSO4的溶解度曲線圖出現一個拐點,其原因是析出的晶體不一樣。低于60℃析出的是ZnSO4·7H2O晶體,而溫度較高時析出的是ZnSO4。因此,實驗操作“100℃蒸發溶劑”后,不能省略“在60℃蒸發溶劑”操作,否則析出的晶體中帶有較多的ZnSO4。從ZnSO4溶液中獲取制備ZnSO4·7H2O,通過選擇合適的結晶方式,調控溫度,體現了“多、純、快(或慢)”的物質制備核心思想。
例4 (2018江蘇卷)根據Na2SO3、 Na2SO3·7H2O溶解度曲線圖與溫度的關系(見圖8),如何從Na2SO3溶液中獲得無水Na2SO3?
本題中的Na2SO3的溶解度曲線圖,類似于例3中的ZnSO4溶解度曲線圖,都存在一個拐點。在設計實驗方案前,先探討溶解度曲線圖中34℃的含義[4],溶解度曲線圖上的任何一點可理解為固相晶體與飽和溶液中對應水合離子的溶解平衡點。設法使34℃的兩種飽和溶液相通,在固相Na2SO3·7H2O的容器中,原先只和Na2SO3·7H2O(s)成溶解平衡的Na+(aq)、 SO2-3(aq),可能“部分”轉而與Na2SO3(s)成溶解平衡;反之,原先只與Na2SO3(s)成溶解平衡的Na+(aq)、 SO2-3(aq),也可能轉而與Na2SO3·7H2O(s)成溶解平衡。34℃就是Na2SO3·7H2O和Na2SO3的轉化溫度,高于34℃,Na2SO3·7H2O轉化為Na2SO3,低于34℃,Na2SO3不穩定,將轉化為Na2SO3·7H2O。即: Na2SO3·7H2O34℃Na2SO3+7H2O。明白了34℃的含義,要從溶液中析出無水Na2SO3,需加熱濃縮溶液至有大量晶體析出,在高于34℃條件下趁熱過濾,此過程中Na2SO3晶體的析出方式屬第②種類型。
例5 (2016北京卷)PbO溶解在NaOH溶液中,存在平衡: PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲線如圖9所示。過程Ⅲ(PbO粗品→高純PbO)的目的是提純。結合上述溶解度曲線,簡述過程Ⅲ的操作: 。
根據PbO的溶解度曲線圖可知,在35% NaOH溶液中的溶解度受溫度影響較大,采用冷卻結晶。因此,由粗品PbO得到高純PbO的操作為: 將粗PbO溶解在一定量35% NaOH溶液中,加熱至110℃,充分溶解后,趁熱過濾(除去不溶物),冷卻結晶,過濾、洗滌并干燥得到高純PbO固體。此過程中PbO固體的析出方式屬第③種類型,在蒸發結晶或冷卻結晶時,可結合趁熱過濾操作,分離不溶物或溫度較高時溶解度較小的物質。
溶解度曲線圖多為多線集合型,其教學價值為判斷不同物質的溶解度隨溫度的變化規律,利用不同物質的溶解性差異,選擇合適的結晶方式,來分離或提純某種物質。在教學中,要培養溶解度曲線圖的綜合性認識,創設不同的情境,內化與完善析出晶體的思維模型,促進學生問題解決能力的提升。
參考文獻:
[1]吳星. 中學化學學科理解疑難問題解析[M]. 上海: 上海教育出版社, 2020: 21~22.
[2]張麗榮等. 無機化學習題解答[M]. 北京: 高等教育出版社, 2018: 69.
[3][4]嚴宣申. 化學原理選講[M]. 北京: 北京大學出版社, 2012: 7, 63.

