高中化學電子式教學困境及他山之石
付勇 許志勤 黃波

摘要: 高中化學電子式教學面臨缺乏規(guī)范和耗時低效的困境,引入點叉圖是解決電子式教學困境的途徑之一。經(jīng)實踐研究發(fā)現(xiàn),點叉圖和電子式在學習結構式中的功能相同。點叉圖相對于電子式更容易被化學學習水平較低的學生掌握,建議在化學必修階段的學習中引入,有助于解決目前電子式教學的困境。
關鍵詞: 電子式; 教學困境; 點叉圖
文章編號: 10056629(2022)07008905
中圖分類號: G633.8
文獻標識碼: B
電子式是我國高中化學課程中一直存在的教學內容,目前主要版本的高中化學教材中都有呈現(xiàn)電子式。但值得注意的是,《普通髙中化學課程標準(實驗)》和《普通高中化學課程標準(2017年版)》中卻沒有直接提及電子式,更無明確的教學要求,課程中似乎“無名無分”,教學中卻又必須要面對。這種情況給電子式的教學帶來困惑: 電子式在高中化學課程中是否還有其他選擇?怎樣解決電子式教學的困境?
1 電子式在高中化學中的功能簡析
首先,電子式作為一種符號模型,是認識化學鍵的思維工具。電子式最初是由路易斯提出電子對概念時,用兩點放在兩個原子之間,表示共用電子對,一個共用電子對即一個共價鍵,依據(jù)的原理是經(jīng)典八偶體電子理論。這種表示方法后來逐漸演變?yōu)榻裉旎瘜W學習和研究中的電子式[1]。電子式一方面融入了形象思維,把抽象的化學鍵以直觀和簡潔的形式表征出來,是學生學習化學知識的思維工具。另一方面,電子式在原子結構示意圖的基礎上進行了抽象和簡化,使用起來更加方便。教學實踐表明,運用電子式能夠幫助學生辨識原子在形成化合物的過程中電子的轉移方式和變化規(guī)律,促進對化學鍵的認識。因此,目前三個版本的高中化學教材在講授化學鍵時,都引入了電子式[2~4]。
其次,電子式是學習結構式的基礎,能夠促進其他符號模型的學習。在學生學會電子式的基礎上,把共用電子對用短線代替,其他省略掉,即形成結構式。我們知道,結構式能夠很清楚地表達原子之間的連接方式,是學生學習有機化合物性質與分子空間構型的基礎。所以從某種程度上來說,電子式是學習有機化學的基礎之基礎。由電子式過渡到結構式非常自然,學生很容易學習結構式,電子式對有機化學與結構化學學習來說相當于加涅教學設計理論中的支持性知識[5]。
2 電子式在教學中的困境
2.1 電子式規(guī)范缺失的困境
電子式作為一種科學符號,它應該具有科學符號所應具有的規(guī)范性、國際通用性特征,在教學上應該讓學生學習規(guī)范的化學符號。但高中化學中電子式恰恰缺少規(guī)范,不僅課程標準沒有提及,而且在化學教材中也是語焉不詳。在目前幾個主要版本的高中化學教材中,電子式的定義大致相同,采用的都是描述性定義,如蘇教版教材把電子式定義為“為了方便表示離子或原子的最外層電子,我們可以在元素符號周圍用小黑點或者“×”來表示離子或原子的最外層電子,這種式子稱為電子式”[6]。這樣的描述沒有對電子式書寫的具體規(guī)范做任何說明,雖然教材也列舉了一些電子式的例子,但很難涵蓋電子式書寫的規(guī)則。電子式缺乏規(guī)范給化學教學帶來了困境——電子式的規(guī)范需要化學教師的解釋,教師的不同理解可能產生不同的書寫規(guī)則,并且教師的理解通常也是根據(jù)自己的教學經(jīng)驗,一方面很難保證規(guī)范性,另一方面讓電子式承擔了過多的功能。
2.2 電子式教學耗時低效的困境
電子式是在原子結構示意圖的基礎上,簡化了內層電子,用點或“×”代替最外層電子。經(jīng)過簡化,電子式失去了原子結構示意圖的形象成分,抽象程度大為提高,造成學生在掌握和應用電子式時產生了困難,尤其是對于剛從初中升入高中學習的學生而言更是如此。電子式教學通常是教師給出相應的規(guī)則,然后學生按照規(guī)則書寫原子、離子、化合物的電子式,這是一種基于規(guī)則的技能學習,屬于淺層次的學習[7]。由于電子式承擔了其他的結構知識,如成鍵之后的電子成對,在選擇性必修模塊中才涉及,故必修模塊的學生很難深層次地理解電子式書寫的規(guī)則。從高中化學知識體系來看,電子式除了在認識化學鍵和進一步學習結構式之外,必修模塊的學習幾乎用不到,也導致電子式學習之后遺忘現(xiàn)象比較普遍。但是在教學實踐中,電子式又是教學評價中的重要內容,化學教師需要花費大量的時間進行電子式教學,過于強調電子式的書寫,反而忽視了電子式認知工具的功能。這種情況對于大部分不選化學學科繼續(xù)學習的學生而言,花費大量的時間學習抽象的電子式并不是必要的。
3 解決電子式困境的他山之石——點叉圖
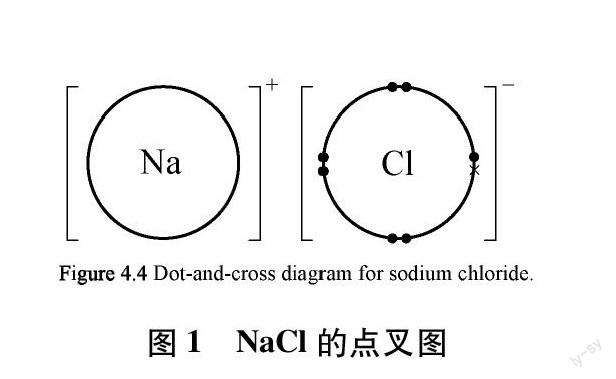
解決目前電子式教學困境的主要途徑有兩種: 一是對電子式進行規(guī)范,形成統(tǒng)一的電子式書寫規(guī)范。這種方式的困難在于電子式書寫規(guī)范目前很難得到統(tǒng)一,也無法解決電子式抽象程度較高的問題;二是采取其他形式的化學符號代替。劍橋大學出版社出版的英國比較流行的高中化學教材采用了一種點叉圖(dot-and-cross diagrams),類似于我國高中化學教材中的電子式,但又有不同于電子式的特點,可以給我們提供有益的參考。該教材是配合英國劍橋考試(Cambridge International Exam)的專用教材,在我國開設A-level課程的國際學校也在廣泛使用。這套教材分為IGCSE和AS&A2兩種水平,前者相當于我國的必修教材,后者相當于選擇性必修教材。兩種水平都在學習化學鍵知識中引入了點叉圖,以離子鍵和共價鍵分類,分別給出了點叉圖的書寫規(guī)則,并配以豐富的例子[8]。
3.1 離子型點叉圖
與電子式相似,離子型化合物中的離子點叉圖只畫出最外的電子層,所不同的是陽離子最外層電子失去之后,不保留電子層,用方括號的形式,離子的電荷寫在右上角。陰離子最外層電子同樣是成對出現(xiàn),占據(jù)上下左右四個方位。離子化合物及其形成的點叉圖以二維方式排列,具有“圖畫”的特征,如圖1、圖2為NaCl、 CaCl2離子化合物形成的點叉圖。
3.2 共價型點叉圖
共價型點叉圖用點表示其中一個原子的最外層電子,用叉表示另一個原子的最外層電子,如果超過兩種元素的原子則用小圓圈或者小三角形。在兩個原子之間電子層交叉部分,畫出共用的電子,如圖3所示。剩余未共用的電子也以成對的形式出現(xiàn),但不必在上下左右的方位分布,如圖4中CO2中的氧原子。點叉圖用圓圈表示原子,一般來說,原子半徑較大,圓圈也較大。需要指出的是點叉圖在特殊情況下不局限于8電子穩(wěn)定結構,多原子分子也以二維方式排列,如圖5所示。
4 高中化學必修課程引入點叉圖的可行性研究
4.1 研究目的
分別通過電子式和點叉圖的教學,比較不同化學學習水平的學生學習電子式和點叉圖效果的差異,分析在高中化學必修階段教學引入點叉圖的可行性。
4.2 研究設計與實施
研究對象選擇研究者所帶的江蘇省泰州市某中學的兩個班作為實驗班,其他14個班作為對照班。所有班級的學生均按中考入校成績隨機分班,構成情況如表1所示。
如表2對實驗班和對照班期中考試成績描述性統(tǒng)計所示,兩種班級平均值分別為68.83和68.52;兩者均值比較,沒有顯著性差異(如表3所示,P=0.979>0.05)。
實驗班按一般電子式教學的模式進行點叉圖的教學,主要教學環(huán)節(jié)包括復習原子結構示意圖、引入點叉圖、介紹點叉圖的書寫規(guī)范、練習點叉圖,教學時長1個課時40分鐘。教學以NaCl的點叉圖書寫為例展開,教師先引導學生復習鈉原子和氯原子結構示意圖。然后給學生示范,把兩種示意圖的數(shù)字改成點或者“×”表示電子數(shù)目,把電子層改成圓形。經(jīng)過電子轉移之后,最外層電子數(shù)量都發(fā)生改變,形成鈉離子和氯離子,但都保留最外層。陰陽離子外面用方括號,右上角注明電荷數(shù)目,同時省去內層電子之后得到陰陽離子的點叉圖,再將陰陽離子排列在一起,即形成化合物的電子式。介紹NaCl的點叉圖之后,總結點叉圖須注意的規(guī)范問題,學生按規(guī)范寫出KI、 MgO、 CaCl2的點叉圖。由鈉原子和氯原子結構示意圖轉化為離子化合物的點叉圖的基本過程如圖6所示。
共價型點叉圖的教學以Cl2為例,展示Cl2的點叉圖,介紹共價型點叉圖;然后以H2O的點叉圖書寫為例,總結共價型點叉圖的書寫規(guī)范;學生再按書寫規(guī)范練習HCl和NH3的點叉圖書寫。在學習離子型和共價型物質的點叉圖之后,給學生介紹既有離子鍵又有共價鍵的物質如NaOH的寫法。
對照班實施與點叉圖相似的教學流程進行電子式教學,教學時間同為40分鐘。實驗班由研究者實施教學,其他班級由另外6位化學教師實施教學。由鈉原子和氯原子結構示意圖轉化為離子化合物的電子式基本過程如圖7所示。
教學之后,通過測試卷測查學生對兩種符號模型的教學功能和可接受性并進行比較: 教學功能通過結構式的得分來判斷;可接受性由電子式或點叉圖的得分來判斷。實驗班和對照班測試卷由10道題目組成,每道題目均為直接寫出常見的10種物質的點叉圖或電子式,其中離子型和共價型各5個,離子化合物包括Na2S、 CaCl2、 MgO、 Na3N、 Na2O2,共價型包括N2、 H2S、 H2O2、 CO2、 PCl3。實驗班完成點叉圖,對照班完成電子式,兩類班級完成之后,根據(jù)點叉圖或者電子式分別寫出物質結構式。
測試卷采用記名的方式,要求學生填寫班級、姓名和學號等基本信息。每一道題目完全正確記1分,錯誤不計分,完成時間均為10分鐘。對照班學生按本學期期中考試化學成績?yōu)闃藴剩啊⒅小⒑蟾?57名學生分別作為A(優(yōu)秀)組、B(中間)組和C(后進)組。實驗班學生同樣以期中考試為標準,把前、中、后各37名學生分為三組。
測試時間選擇在課后,所有班級均在同一時間內完成和回收。教學實驗和測試得到了學校的同意和配合,提前告知學生測試的目的,實驗班的電子式教學內容在隨后的課堂中補上。實驗班和對照班的測試卷回收之后由研究者統(tǒng)一批改,每一種物質的電子式或者點叉圖書寫完全正確記錄為1分。所有數(shù)據(jù)均由SPSS25.0統(tǒng)計分析。本研究統(tǒng)計不同化學學習水平的學生在測試卷上的得分差異、教師因素、班級因素等通過統(tǒng)計概率可以得到比較有效的控制。
4.3 實驗結果統(tǒng)計與分析
4.3.1 實驗班和對照班結構式得分比較
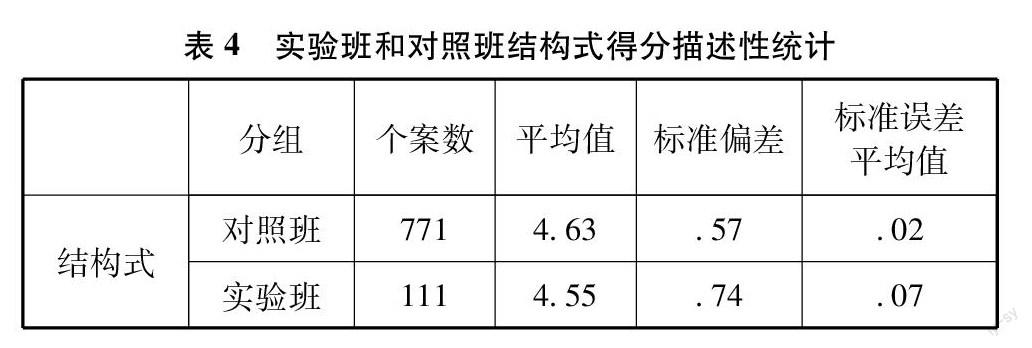
對實驗班和對照班結構式得分進行均值比較發(fā)現(xiàn),兩組學生結構式均分都在較高水平,如表4平均值,分別為4.55和4.63,即學生能夠根據(jù)點叉圖或電子式正確書寫結構式,平均為4.55和4.63個。如表5所示,P=0.081>0.05,兩組學生結構式正確數(shù)目之間沒有顯著性差異。分析結果表明,學生能夠順利利用點叉圖或電子式書寫結構式,兩種符號模型在學生結構式學習中發(fā)揮了幾乎相同的作用。
4.3.2 實驗班和對照班電子式和點叉圖得分比較
分別對實驗班與對照班的點叉圖和電子式得分進行總體和不同組別之間比較,如表6所示。總體平均值以及不同組別的學生的點叉圖正確數(shù)都略高于電子式,總體離散程度小于電子式,總體標準差1.20<1.43。對不同學習水平的學生在電子式和點叉圖的正確數(shù)目進行比較發(fā)現(xiàn),如表7所示。優(yōu)等生組間和中等生組間無顯著性差異(P=0.21>0.05、 P=0.19>0.05),而后進生組間有顯著性差異(P=0.01<0.05),說明點叉圖相對電子式對化學學習水平較高的學生無顯著影響,而對化學學習水平較低的學生有顯著性影響。
兩種符號模型教學對比,從原子結構示意圖到點叉圖的轉化,保留了形象的成分,更容易被后進生接受。而電子式舍去了相應的形象成分,直接轉換為抽象的化學符號,如圖7所示。從學生練習的正確率來看,學習能力較強的優(yōu)等生和中等生在理解原子結構示意圖到點叉圖或者電子式的差異不明顯,但學習能力較弱的后進生更容易接受點叉圖。例如,經(jīng)過測試之后對學生的訪談,研究者進一步探索產生差異的原因。以CO2為例,后進生書寫電子式的時候,往往先寫出碳和氧的元素符號,在C原子和O原子之間錯誤地寫成一對共用電子對,其他電子補在原子周圍形成8電子結構。但書寫點叉圖時,由于C原子和O原子最外層電子歸屬非常清晰,學生能夠由C原子和O原子之間的共用電子數(shù)目判斷每一種原子是否各自達到穩(wěn)定狀態(tài),從而提高書寫的正確率。類似的差異多發(fā)生在兩個原子間大于1對共用電子對的情況,例如測試卷中的N2,后進生點叉圖正確率高于電子式。研究還發(fā)現(xiàn),后進生在書寫多個孤電子對時,遺忘率高于點叉圖,例如PCl3中Cl原子的孤電子對,可能的原因是點叉圖的圓圈提示了學生檢查原子的最外層電子的數(shù)目。
5 研究結論與教學建議
由以上研究可以看出,點叉圖相對于電子式,在學習結構式中的功能相同,但更易于化學學習水平較低的學生掌握。點叉圖直接以原子結構示意圖為起點,形象直觀,與初中化學階段的基礎銜接比較緊密,更利于高中化學必修階段學生接受。在必修階段的化學學習中,點叉圖可以代替電子式的教學功能。借他山之石,可以攻玉,建議我國高中必修階段引入點叉圖教學。在經(jīng)過必修階段的化學學習之后,學生的化學學習達到相對較高的水平,在化學選擇性必修模塊再學習電子式,這樣的處理不失為克服目前電子式教學困境的簡單可行的途徑和方法。
參考文獻:
[1]張嘉桐. 化學基本概念的演變[M]. 太原: 山西教育出版社, 1998: 123.
[2]人民教育出版社課程教材研究所. 普通高中教科書·化學必修第一冊[M]. 北京: 人民教育出版社, 2019: 107~109.
[3]
[6]王祖浩主編. 普通高中課程標準實驗教科書·化學1[M]. 南京: 江蘇教育出版社, 2019: 128~129.
[4]北京師范大學基礎教育化學教材編寫委員會. 普通高中教科書·化學必修第二冊[M]. 濟南: 山東科技出版社, 2019: 48~49.
[5]加涅著. 王小明等譯. 教學設計原理[M]. 上海: 華東師范大學出版社, 2018: 167.
[7]黃文軍. 培養(yǎng)想象思維的教學思考與實踐——以電子式書寫教學為例[J]. 中學化學教學參考, 2017, (4): 16~18.
[8]Lawrie Ryan, Roger Norris, Brian D. High. Chemistry [M]. London: Cambridge University Press, 2015: 49~58.

