欖香烯注射液的研究概況
鄭國群 于佳 吳明偉
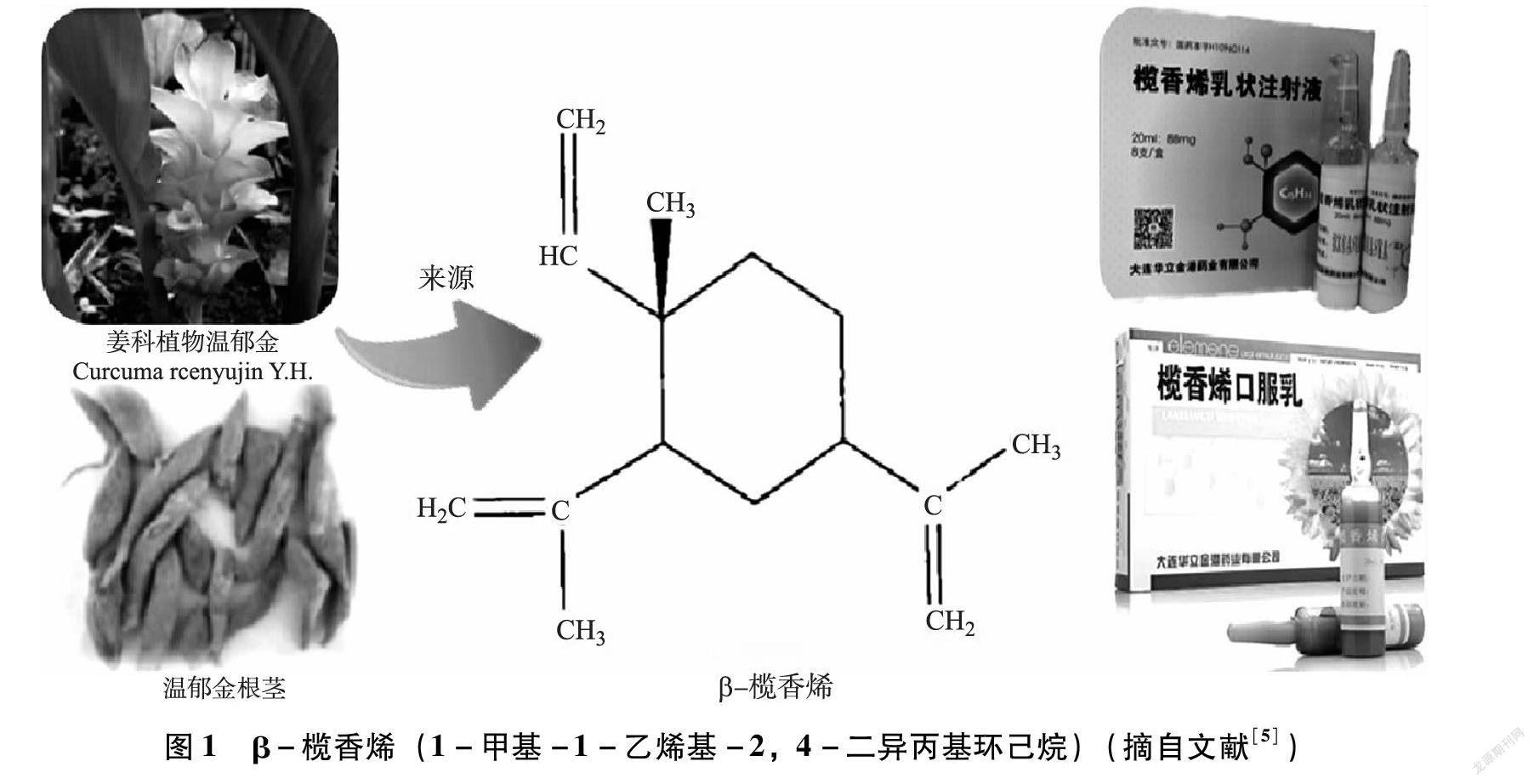
【摘 要】 欖香烯是從姜科植物溫郁金和溫莪術中提取的、具有抗腫瘤活性的一類倍半萜烯類化合物,主要以β-欖香烯、γ-欖香烯和δ-欖香烯的油狀混合物形式存在,其中β-欖香烯是其發揮抗腫瘤作用的主要成分。欖香烯注射液是我國自主研發的二類非細胞毒性抗腫瘤藥,具有抗腫瘤療效顯著、副作用輕微等特點。欖香烯注射液可通過誘導細胞凋亡、抑制腫瘤血管生成等實現對腫瘤細胞的抑制乃至破壞,促進機體對腫瘤的免疫反應和增強機體自身的免疫功能等。欖香烯注射液還可直接干預或輔助治療惡性腫瘤,能顯著提升治療效果和改善患者生活質量。文章對欖香烯注射液的來源、誘導細胞凋亡和聯合化療協同增效等作用機制進行了綜述,指出了欖香烯對腫瘤治療的重要作用,以及欖香烯研究的不足,例如蛋白水平及線粒體等方向上的作用靶點和相關基因研究較少,作用機制不明;缺乏欖香烯與放化療藥物間的最佳配伍方案研究。文章對莪術、郁金等中藥在現代醫學中的研究有著重要意義。
【關鍵詞】
欖香烯注射液;姜科植物;作用機制;線粒體;靶點
【中圖分類號】R285.6 【文獻標志碼】 A【文章編號】1007-8517(2022)08-0062-09
Research progress of Elemene injections
ZHENG Guoqun1 YU Jia2* WU Mingwei1*
1.Liping County Hospital of Traditional Chinese Medicine, Guizhou, Liping 557300,China;
2.The First Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang 550000,China
Abstract:
Elemene is a class of sesquiterpene compounds with antitumor activity extracted from Curcuma wenyujin and Curcuma wenyushu. It mainly exists in the form of oil mixture ofβ-elemene,γ-elemene andδ-elemene whereβ-elemene is the main component of its antitumor effect.Elemene injection is a type II non-cytotoxic antitumor drug independently developed in China, with significant antitumor efficacy and mild side effects.Elemene injection can inhibit or even destroy tumor cells by inducing apoptosis and inhibiting tumor angiogenesis, promote the immune response of the body to tumors and enhance the immune function of the body itself. Elemene injection can also directly intervene or assist in the treatment of malignant tumors, which can significantly improve the therapeutic effect and improve the quality of life of patients.In this paper, the source of elemene injection, the mechanism of inducing apoptosis and the synergistic effect of combined chemotherapy were reviewed, and the important role of elemene in tumor treatment was pointed out, as well as the deficiency of elemene research, such as scarcity of studies on the target and related genes and unclarity of its mechanism in the direction of protein level and mitochondria, lack of the study on the optimal compatibility of elemene injection with radiotherapy and chemotherapy drugs. This paper is of great significance to the study of traditional Chinese medicine such as Curcuma wenyujin and Curcuma wenyushu in modern medicine.
Key words:Elemene Injection; Zingiberaceae; Mechanism of Action; Mitochondria; Targets
欖香烯注射液(Elemene injection)是我國自主研制的一種二類非細胞毒性抗腫瘤藥物,其主要抗腫瘤活性物質欖香烯[1-2](Elemene)是從姜科植物溫郁金(Curcuma wenyujin Y. H. Chen et C. Ling)、溫莪術(Curcuma aromatica Salisb.)中提取的一種具有抗腫瘤活性的倍半萜烯類化合物,主要以β-欖香烯、γ-欖香烯和δ-欖香烯的油狀混合物形式存在。欖香烯注射液的原藥材溫莪術是姜科植物蓬莪術Curcuma phaeocaulis Val. 、廣西莪術Curcuma kwangsiensis S. G. Lee et C. F. Liang或溫郁金Curcuma wenyujin Y. H. Chen et C. Ling的干燥根莖,味辛、苦,性溫,既可入血分,又能入氣分,具有破血行氣、消積止痛之功效,為破血消癥之要藥,用于瘀血經閉、食積腹脹、癥瘕痞塊等,其中醫、中藥學應用首載于《藥性論》:“治女子血氣心痛,破痃癖冷氣,以酒醋摩服。”溫郁金是姜科植物蓬莪術Curcuma phaeocaulis Val. 、廣西莪術Curcuma kwangsiensis S. G. Lee et C. F. Liang、姜黃Curcuma longa L.或溫郁金Curcuma wenyujin Y. H. Chen et C. Ling的干燥根莖的干燥塊根,味辛、苦,性寒,具有活血行氣、開郁止痛、涼血清心和利膽退黃之功效,可用于血瘀氣滯之胸肋腹痛、熱病神昏、癲癇等證,肝膽濕熱證和肝郁化火、氣火上逆,迫血旺行之吐血、衄血及婦女倒經等。《本草備要》中記載,郁金可行氣、解郁、泄血、破淤,涼心熱、散肝郁,治婦人經脈逆行。現代藥理學研究表明,莪術和溫郁金均具有較好的抗腫瘤、抗炎鎮痛、抗病毒、抗早孕、抗菌、保肝、抗纖維組織增生、保護心血管系統、細胞毒等作用,為臨床常用的活血化瘀類藥物。使用溫莪術和溫郁金制備的欖香烯注射液主要成分為β-、γ-和δ-欖香烯是欖香烯的3種同分異構體,其中β-欖香烯分子式為C15H24[3-4](化學名為1-甲基-1-乙烯基-2,4-二異丙基環己烷,結構見圖1),是抗腫瘤作用的主要活性物質。該藥對許多腫瘤細胞都具有明顯的抑殺作用,如肺癌細胞、肺腺癌細胞及直腸癌細胞等,亦可用于介入、腔內化療及癌性胸腹水的治療。自1994年投入市場之后,欖香烯注射液在多種腫瘤和癌癥的臨床治療上獲得了大量應用。AEBF9029-B1FF-42BF-B20C-2CD454E35734
1 欖香烯注射液作用機制研究進展
1.1 抑制腫瘤細胞增殖 腫瘤主要由腫瘤細胞組成,增長速度很快,生長旺盛,與整個機體不協調,能無限制地分裂和增殖,腫瘤細胞增殖周期包括增殖、非增殖和無增殖能力三個細胞群。增殖細胞群是指處于不斷按指數分裂增殖的細胞,它們對腫瘤的生長、復制、播散和轉移起決定性作用。因此,抑制腫瘤細胞的增殖可有效地控制腫瘤的發生發展,同時亦是治療惡性腫瘤的重要手段或途徑之一。曹陽等[6]研究發現欖香烯對肺癌細胞生長具有抑制作用,同時亦降低了bcl-2蛋白的表達和bcl-2mRNA水平以及上調p53蛋白的表達。表明欖香烯作用機制可能與上調抑癌基因p53與下調了癌基因bcl-2的表達有關,進而誘使肺癌細胞凋亡。龔敏等[7]研究發現欖香烯對HepG-2細胞增殖的抑制作用主要與其影響DNA拓撲異構酶(topoisomerase I, TOPO)的表達與活性有關,且呈現明顯的時間和劑量依賴性。徐希等[8]研究證實了欖香烯對腫瘤細胞生長的抑制作用具有時效和量效關系,誘導Raji細胞的凋亡作用具有一定的濃度依賴性;同時亦發現了細胞周期中的G0/G1期細胞相對增多,而S期和G2/M期細胞均相對地減少,表明欖香烯可抑制腫瘤細胞的增殖,其作用機制是阻滯腫瘤細胞向S期和G2/M期進展,將其停滯在細胞周期中的G0/G1期。
朱廷準等[9]報道欖香烯對人膠質瘤細胞的增殖具有明顯的抑制作用,證實了欖香烯抑制腫瘤細胞增殖的作用與阻滯腫瘤細胞的細胞周期有關,且其阻滯作用又與欖香烯上調細胞中 MKK3和 MKK6的磷酸化水平有關。再次證實了欖香烯對腫瘤細胞增殖具有明顯的抑制作用。對MKK3/6信號通路的磷酸化激活,在抑制腫瘤細胞增殖過程中起著至關重要的作用,而抑制MKK3和MKK6的活性則可明顯消除欖香烯的抗腫瘤作用。
1.2 誘導腫瘤細胞凋亡 細胞的凋亡異常是惡性腫瘤發生發展的主要機制之一,且易受一些基因和蛋白的表達影響。如:Survivin與Caspase-3特異性結合,一方面阻斷細胞凋亡效應;另一方面可與細胞核內的細胞周期依賴性蛋白激酶4相結合,抑制p21基因活性,進而抑制細胞凋亡。鄒麗娟等[10]研究發現β-欖香烯是通過對K562細胞的殺傷作用,從而導致其細胞凋亡,且其對腫瘤細胞的誘導凋亡作用呈現一定的時效和量效依賴性。李傳剛等[11]研究發現欖香烯能夠升高人膀胱癌BIU-18細胞內游離Ca2+濃度,并與藥物濃度具有一定的依賴性關系。方寧等[12]研究發現β-欖香烯作用于HcaF細胞后可使鈣庫釋放Ca2+,致細胞內游離Ca2+濃度升高;且在細胞凋亡初期,可使細胞質膜的生物學特性發生改變,如:細胞膜中的磷脂酰絲氨酸由內側翻向外側,使Ca2+迅速由細胞內向胞外轉運,從而導致胞內Ca2+濃度降低。證實了β-欖香烯對HcaF細胞的誘導凋亡作用可能與Ca2+的濃度變化有關,在細胞凋亡早期質膜內Ca2+濃度出現先升高再降低的現象。黃富春等[13]報道β-欖香烯可明顯誘導結腸癌LoVo細胞株凋亡,而且在細胞凋亡過程中細胞質內游離Ca2+濃度明顯的升高,以細胞凋亡早期尤為明顯。由此可見,β-欖香烯可通過影響細胞中Ca2+濃度而發揮其誘導細胞凋亡作用。
吉慶明[14]研究發現欖香烯對腫瘤細胞的誘導凋亡作用,主要與上調白血病K562細胞中PDCD5蛋白表達有關。丁華等[15]發現欖香烯對SHG-44細胞株亦有明顯的促凋亡作用,其作用機制是阻滯SHG-44細胞株的增殖,將其細胞周期停滯在G2/M期,對G2/M期的阻滯作用和對腫瘤細胞的促凋亡作用均存在明顯的劑量和時間依賴性。欖香烯可顯著降低Bcl-2蛋白和增強Bax蛋白的水平表達。亦證實了欖香烯注射液對腫瘤細胞具有顯著的抑制增殖作用和誘導其凋亡作用,其作用機制主要是阻滯細胞周期中G2/M期的發生發展,以及抑制Bcl-2蛋白表達。
周興芹等[16]證實了欖香烯對腫瘤細胞的增殖具有明顯抑制作用,將A549 細胞停滯在G2/M期,并可誘導細胞凋亡,同時增殖抑制作用對藥物濃度和作用時間具有一定的依賴性。趙永順等[17]研究指出欖香烯誘導U87細胞凋亡的作用機制是抑制其賴以生存的Raf/MEK/ERK通路,從而下調Raf/MEK/ERK通路下游信號癌基因Bcl-2表達,增加Bax/Bcl-2比值,啟動線粒體凋亡程序,最終誘導U87細胞凋亡。
1.3 抑制腫瘤細胞遠處轉移 惡性腫瘤細胞發生浸潤和遠端轉移是其發生發展的主要特征之一,轉移過程由一系列連續和相互關聯的步驟組成,包括:腫瘤細胞從原發腫瘤脫離并侵入鄰近的健康組織、侵入血液和淋巴管,以及通過血流循環(循環腫瘤細胞)到達其他部位或身體組織中,在其特定的組織器官中生長發育而形成繼發性腫瘤。腫瘤細胞的浸潤和轉移與其運動、黏附能力密切相關,腫瘤細胞只有先突破其周圍的基底膜及細胞外間質,才能發生遠端轉移[18-20]。陳龍邦等[21]研究證實了β-欖香烯可明顯抑制B16細胞運動和遠處轉移,其作用機制通過抑制B16細胞對纖維結合蛋白和粘連層蛋白兩種基質的黏附,從而抑制腫瘤細胞運動和遠處轉移。馮利等[22]研究亦證實了欖香烯對腫瘤細胞的遠處轉移具有明顯的抑制作用,通過對腫瘤細胞基底膜和細胞外間質屏障的保護,從而抑制其發生遷徙和轉移。鄭瑾等[23]通過劃痕試驗進一步證實了β-欖香烯可以降低肝癌細胞的侵襲、遷移能力。Fu X等[24]采用β-欖香烯聯合紫杉醇治療卵巢癌時,發現患者卵巢癌細胞的生長、遷移和侵襲受到明顯地抑制,發現β-欖香烯聯合紫杉醇可明顯誘導SKOV3細胞凋亡、下調SKOV3細胞抗凋亡Bcl-2和Bcl-xl基因表達,上調促凋亡p53和Apaf1基因表達,以及在S期阻止SKOV3細胞周期并下調CDK1、細胞周期蛋白-B1、SKOV3細胞中MDR1、LRP和TS的p27基因表達和凋亡相關抗性基因表達。抑制磷酸化的STAT3和NF-κB表達,通過下調SKOV3細胞中的STAT-NF-κB信號通路來抑制遷移和侵襲。Cai B等[25]研究發現經β-欖香烯可顯著增加膀胱癌細胞凋亡數,還可明顯抑制膀胱癌細胞的侵襲和遷移,而且β-欖香烯還能上調PTEN和降低pAKT的表達而發揮其抗腫瘤作用。由此可見,β-欖香烯可通過抑制腫瘤細胞黏附和運動,阻止其向遠端轉移而發揮其抗腫瘤作用。AEBF9029-B1FF-42BF-B20C-2CD454E35734
1.4 抑制腫瘤血管生成 腫瘤的血管生成是腫瘤發生、發展和遠處轉移的基本要素,大量新生的腫瘤血管作為“運輸通道”,為癌細胞快速增殖提供了豐富的氧氣和養料。腫瘤局部或癌周廣泛存在的新生血管為癌細胞入血轉移提供了“通道”,讓游離癌細胞得以快速地隨全身血液流動向遠處播散。因此破壞或抑制腫瘤局部的新生血管,切斷腫瘤細胞生長所需氧氣及其他營養物質,是抗血管生成治療的核心基礎。陶磊等[26]研究發現,欖香烯可顯著抑制喉癌細胞株Hep-2增殖和誘導其凋亡,通過抑制堿性纖維母細胞生長因子(basic fibroblast growth factor, bFGF)和血管內皮生長因子(vascular endothelial growth factor, VEGF)的表達,而發揮其抗腫瘤血管生成作用。進一步研究證實,欖香烯主要是通過降低真核細胞翻譯起始因子(eukaryotic initiationg factor, eIF)家族成員eIF4E、eIF4G、bFGF和VEGF的表達,從而減輕瘤體的體積和重量,同時其作用與藥物濃度呈正相關。張志鋒等[27]驗證了欖香烯能夠降低腫瘤VEGF的生成和VEGF受體(VEGF-1、VEGF-2)的表達,從而腫瘤血管生成。另外,周昆等[28]研究表明欖香烯對腫瘤血管和淋巴管轉移的抑制作用,亦是通過抑制SPC-A-1生長的同時降低VEGFR-3和VEGF-C的表達水平而實現。因此,欖香烯抑制腫瘤血管生成的作用機制與其降低eLF家族成員中VEGF和bFGF的蛋白表達有關。
1.5 增強腫瘤對放化療的敏感性 協同、增效作用放化療在腫瘤治療過程中發揮著非常重要的作用,但也有其不足之處。在殺傷腫瘤細胞的同時,也殺傷了正常組織細胞,限制了放化療的治療強度。因此,增強腫瘤對放化療的敏感性,在不增加毒副作用的基礎上提高放化療療效,是有效治療腫瘤的重要手段之一。
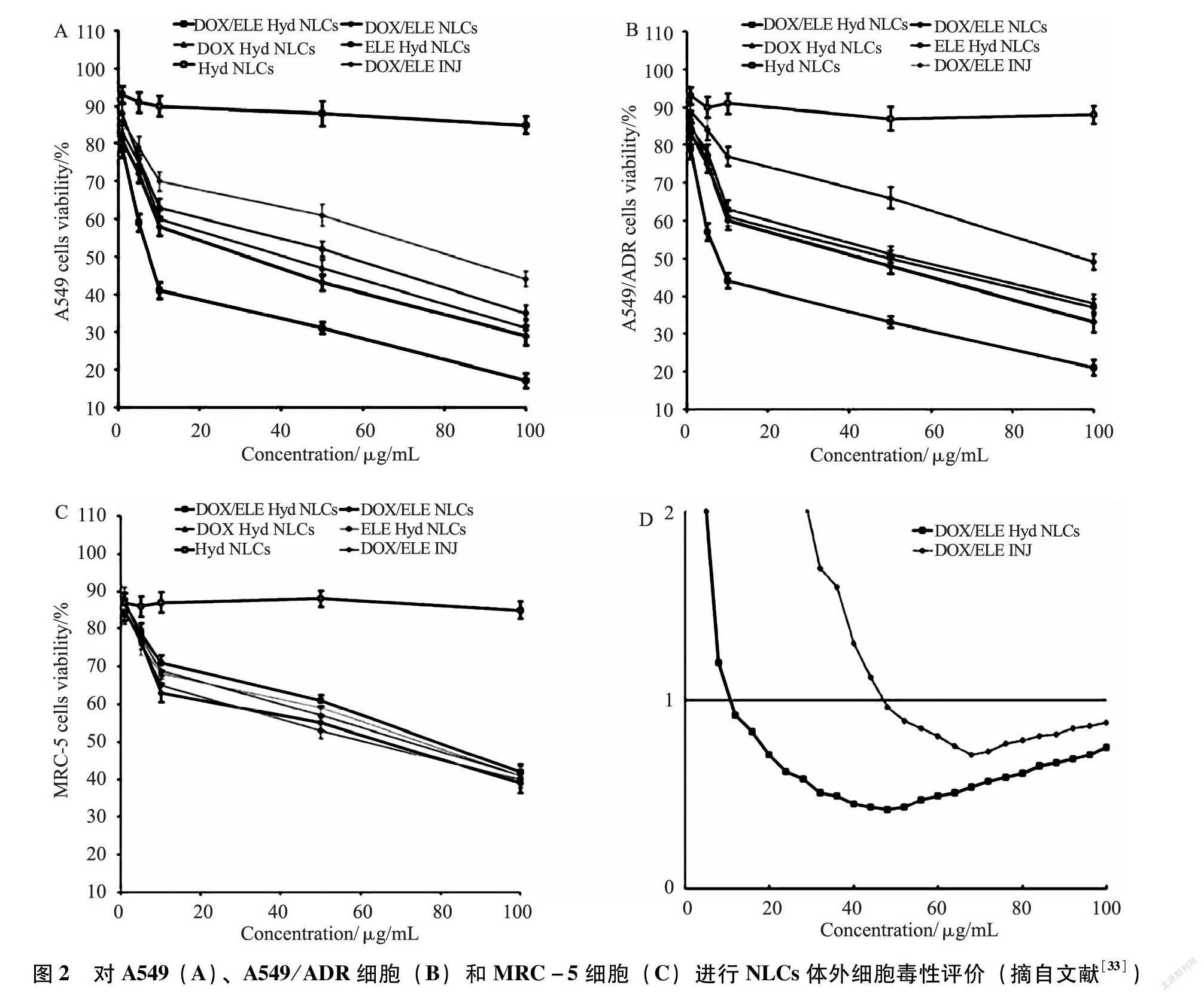
1.5.1 協同作用 郝立宏等[29]研究發現欖香烯能明顯增強阿霉素對CEM/ADM細胞的生長抑制和誘導凋亡作用,并且與藥物濃度和作用時間具有一定的依賴性。王利等[30]研究表明β-欖香烯可降低多藥耐藥相關蛋白和多藥耐藥基因mdr-1基因編碼的P-糖蛋白的表達,從而逆轉腫瘤細胞的多藥耐藥性。Li Q Q等[31]發現β-欖香烯可明顯增強肺癌A549和H460細胞株對順鉑的敏感性,從而促使其腫瘤細胞凋亡。β-欖香烯對肺癌細胞株的鉑增敏作用主要與下調Bcl-2、IAPs蛋白和線粒體介導的內在凋亡途徑有關。高金榮等[32]研究發現,低劑量欖香烯可誘導人卵巢癌HO-8910和人宮頸癌HeLa細胞對紫杉醇的反應性,并能顯著增加紫杉醇的細胞毒作用,尤其是對紫杉醇極不敏感的HeLa細胞具有高選擇性。Cao C等[33]通過研究在A549、A549/ADR和MRC-5細胞上評估NLC的體外細胞毒性(如圖2所示),發現任何藥物濃度中A549和A549/ADR細胞上,DOX/ELE Hyd NLC(阿霉素和β-欖香烯共載,pH敏感的納米結構脂質載體)的細胞毒性均高于DOX/ELE NLC(DOX和ELE共同裝載的NLC不包含pH敏感的Hyd)。DOX / ELE NLCs高于DOX/ELE INJ(DOX和ELE的注射液);DOX/ELE Hyd NLC比單藥加載的DOX Hyd NLC和ELE Hyd NLC表現出更好的細胞抑制作用。含DOX的制劑對A549/ADR細胞的療效低于A549細胞,而欖香烯則可以幫助該系統實現細胞毒性。當0.2﹤Fa(受影響細胞的分數)﹤0.8時,IC50值﹤1,DOX / ELE Hyd NLC具有顯著協同作用。由此可知,欖香烯對化療具有明顯的協同抗癌作用。
1.5.2 增敏作用 佘軍軍等[34]采用6 Mev X線聯合β-欖香烯乳劑對腎動脈灌注治療時,發現腫瘤的放射增敏效應得以明顯增強,亦延緩了腫瘤的生長和增強了對腫瘤細胞的誘導凋亡作用。進一步的研究證實了β-欖香烯可抑制和延緩腫瘤瘤體的生長,及其具有明顯的放射增敏作用。欖香烯能增強放療對DNA分子的損傷作用,主要是通過Caspase-3途徑顯著下調Bcl-2表達,并誘導腫瘤細胞凋亡而致其增敏作用[35]。吳大鵬等[36]研究證實了β-欖香烯乳具有誘導腫瘤細胞凋亡作用,并從蛋白水平上初步推測了β-欖香烯乳對腫瘤細胞的放療增敏機制。
Jiang H等[37]研究證實了欖香烯的放射增敏作用與其上調腫瘤細胞p53及下調bcl-2的表達存在一定的相關性。張卓[38]研究發現低濃度的β-欖香烯對A549細胞即有一定的放射增敏作用,10 μg/mL和20 μg/mL β-欖香烯放射增敏比SERD0值為(1.54±0.20)和(1.63±0.32);SERDq值為(1.53±0.15)和(1.75±0.19),而且放射增敏比和放射增敏作用的強弱均與β-欖香烯的濃度呈正相關。同時發現β-欖香烯乳聯合放療對A549細胞周期的分布具有明顯的影響,即阻滯G2/M期的發生和發展,從而導致細胞凋亡。G2/M期細胞比率和凋亡率亦與β-欖香烯的濃度呈正相關。證實了β-欖香烯對放療的增敏作用主要是通過上調A549細胞p53和下調Bcl-2的基因表達而實現。研究表明,β-欖香烯乳聯合放療時,明顯抑制了DNA雙鏈損傷修復基因Ku70和DNA-PKcs的表達,進而增強A549細胞對放療的敏感性。亦發現A549細胞DNA-PKcs、Ku70基因表達與p53表達呈顯著負相關,而與Bcl-2表達顯著正相關。由此可見,β-欖香烯可通過對DNA雙鏈損傷修復和誘導細胞凋亡途徑的影響,而明顯增強其放射敏感性和誘導細胞凋亡作用。
1.6 逆轉腫瘤細胞耐藥 腫瘤細胞對化療藥物的耐受性是現今化療失敗的最主要原因之一,防止多藥耐藥(MDR)的發生,或逆轉多藥耐藥是目前提高化療療效的重要途徑之一。胡軍等[39]研究發現β-欖香烯可誘導腫瘤細胞對阿霉素耐藥性發生逆轉,從而增強該耐藥細胞對阿霉素的敏感性。Li X等[40]研究發現β-欖香烯對人卵巢癌細胞中順鉑耐藥細胞株的增生具有明顯的抑制作用,而且對人卵巢癌細胞具有高度的選擇性;進一步研究發現β-欖香烯可明顯增強對腫瘤細胞G2-M期的阻滯作用,從而增強順鉑對腫瘤耐鉑藥細胞株的增殖抑制作用。郝立宏等[41]發現β-欖香烯主要是通過抑制Bcl-2的表達而實現其逆轉腫瘤細胞的MDR和誘導腫瘤細胞凋亡作用,同時β-欖香烯又可顯著降低ADM對K562/ADM細胞的IC50。欖香烯能逆轉K562/ADM細胞的MDR,可能是通過下調K562/ADM細胞的P-gp的表達而實現[42]。此外,楊愛珍等[43]發現人肺腺癌細胞株SPC-A1中對紫杉醇、多西他賽、長春瑞濱和阿霉素均高度耐藥的細胞亞株SPC-A1/Tax 01,對欖香烯具有高度的敏感性,說明欖香烯對紫杉醇耐藥的腫瘤細胞仍具有明顯的抑殺作用。陳春美等[44]研究發現欖香烯對人腦膠質瘤U251/ADM細胞耐藥性具有逆轉作用,逆轉機制可能與其抑制耐藥基因mdr-1、MRP和GST-π的表達具有一定的相關性。Zhao Y F等[45]研究發現非小細胞肺癌細胞對分子靶向藥吉非替尼的敏感性與p21蛋白的高表達有關。腫瘤細胞對吉非替尼耐藥時,明顯降低了PC9-ZD中p21的表達,而聯用β-欖香烯可上調PC9-ZD中p21的表達,進而逆轉腫瘤細胞對吉非替尼的耐藥性。Deng M等[46]通過研究發現β-欖香烯能調節MMP-2/9表達和逆轉上皮-間質轉化,還可通過上調Cbl-b的表達,從而抑制EGFR-ERK/AKT通路,進而調節MMP-2/9的表達,同時β-欖香烯亦能通過抑制miR-1323表達而上調Cbl-b的表達。發現β-欖香烯處理后的裸鼠肺中轉移性腫瘤結節的數量顯著減少,證實了β-欖香烯可通過調節miR-1323/Cbl-b/EGFR信號轉導軸來抑制MDR胃癌細胞的轉移。由此可見,β-欖香烯對MDR癌細胞具有顯著的抗轉移作用。AEBF9029-B1FF-42BF-B20C-2CD454E35734
1.7 激活抗腫瘤免疫、增強細胞免疫功能 機體免疫系統具有識別和通過免疫機制特異地清除“非己”細胞,抵御腫瘤發生發展的特性。腫瘤細胞可通過多種機制逃避機體免疫系統的識別和攻擊,在機體內得以迅速地生存和發展,形成腫瘤。因此,通過激發機體抗腫瘤免疫應答和增強細胞的免疫原性,是有效治療腫瘤的途徑之一。肖立森等[47]通過MTT法檢測和比較了β-欖香烯與5-FU、ADM、ADD、VCR、MTX、Vp-16、MMC等7種抗癌藥物的敏感性,發現β-欖香烯對胰頭癌、乳腺癌、食管癌、胃癌及大腸癌的體外細胞毒性與上述抗癌藥物相似,證實了欖香烯可阻滯腫瘤細胞的有絲分裂,以及具有抑制腫瘤細胞生長代謝的作用,從而加速腫瘤細胞的凋亡。吳偉忠等[48]研究發現β-欖香烯可增強H22細胞的免疫原性,同時能夠激發機體產生特異性抗腫瘤免疫,其抗腫瘤效應與腫瘤細胞膜上HSP70蛋白的表達介導有關。官成濃等[49]研究發現欖香烯聯合化療藥物治療擴散期胃癌時患者血常規和生化水平無明顯變化,說明欖香烯對機體的免疫功能具有很好地保護作用,而且在機體抵抗腫瘤和抑制腫瘤的發生發展中起著非常重要的作用。張思奮等[50]研究發現欖香烯可顯著提高經欖香烯灌注介入治療的直腸癌患者外周T細胞亞群CD3、CD4及CD4/CD8比值。從而證實了欖香烯有提高患者免疫功能的作用。姚淑娟等[51]研究發現欖香烯可以促進化療后荷瘤C57BL/6小鼠機體免疫功能的恢復和提高T細胞的轉化能力,以促進機體產生白細胞介素-2(IL-2)和自然殺傷細胞(NK),從而激發機體產生特異性抗腫瘤免疫療效。由此可見,欖香烯是一種良好的腫瘤疫苗。
1.8 欖香烯注射液在線粒體途徑下的作用研究 線粒體是生物體細胞代謝和信號轉導途徑的重要場所,是對各種損傷最為敏感的細胞器之一,而腫瘤細胞的線粒體功能障礙是其重要的特征之一。可見,線粒體的功能在腫瘤的發生發展過程中起著決定性的作用。王茜莎等[52]研究發現δ-欖香烯能升高線粒體內的Bax蛋白水平,促使線粒體內cyto C和AIF釋放入胞質,進而導致線粒體膜電位的降低。姚成才等[53]研究指出不同濃度欖香烯均可明顯抑制A549/DDP細胞株的生長,并具有一定的濃度和時間依賴性,同時亦能逆轉A549/DDP細胞株對鉑的耐藥性和提高腫瘤細胞對鉑的敏感性。欖香烯與順鉑聯合應用時,發現欖香烯能夠明顯降低A549/DDP細胞株的線粒體膜電位,亦能上調胞質中Cyto C、Caspase-3、Bad的蛋白表達,以及下調 Pro-caspase-3、Bcl-2的蛋白表達,增加ROS濃度,降低GSH/(GSSG+GSH)比值。進一步研究證實,在40 μg/mL濃度欖香烯中加入線粒體PTP抑制劑Cyclos-Porine A和Caspase-3抑制劑DEVD-CHO時,發現Caspase-3表達減低。Cyclos-Porine A能阻止PTP的通透性,DEVD-CHO能抑制Caspase-3的激活,從而抑制A549/DDP細胞凋亡。表明Cyto C釋放、Caspase激活及Bcl-2蛋白低表達和Bad高表達可促使欖香烯逆轉A549/DDP細胞的耐藥性。由此可見,欖香烯逆轉腫瘤細胞耐藥性機制,可能與其損傷線粒體膜和誘導線粒體凋亡路徑有關。
史亞博等[54]研究指出在線粒體相關途徑下欖香烯對抑制腫瘤細胞生長增殖及遷徙轉移、誘導腫瘤細胞凋亡、增強治療敏感性及逆轉耐藥效應具有協同作用,而且都受到Survivin表達的影響。由此揣測,Survivin作為共同效應的作用靶點同時可能具有相應的特異性,Survivin對Cyto C、Caspase、線粒體膜電位亦可能有一定程度的影響。Survivin蛋白僅僅表達于腫瘤和胚胎組織,欖香烯對Survivin的抑制作用是否為其線粒體相關途徑下抗腫瘤效應與其他藥物的不同點尚需進一步明確。
1.9 欖香烯注射液作用的基因靶點研究 細胞發生癌變主要是由于細胞信號轉導通路的失調而導致了細胞的無限增殖,腫瘤細胞內異常信號系統靶點的特異性研究,為腫瘤的治療提供了又一途徑。鄭京勝等[55]通過網絡藥理學研究發現195個欖香烯注射液靶標基因與血栓癥疾病靶標基因的交集基因,欖香烯注射液的靶點信息集主要富集在胃、肺結、直腸、卵巢和乳腺等組織中。欖香烯注射液交集靶基因的生物功能主要包括鉀離子跨膜轉運、類固醇激素介導的信號通路、蛋白質同源寡聚化及調節心房肌細胞膜復極化等,而交集靶基因主要作用于不對稱突觸、軸突末端和GABA-A受體復合物等。交集靶基因的分子功能主要是RNA聚合酶II轉錄因子活性、配體激活的序列特異性DNA結合和類固醇激素受體活性等。同時還發現欖香烯注射液的靶點主要富集在Caspase-3、Bcl-2和CDC42等信號通路,這些信號通路均已被證明參與腫瘤細胞的直接抑殺和誘導凋亡過程。欖香烯對腫瘤細胞的直接抑殺和誘導凋亡機制主要與Bcl家族成員有關,即下調Bcl-2、Bcl-X(L)等抗凋亡成員,上調Bax、Bak等促凋亡成員以及激活Caspase酶族,其中Caspase-3為欖香烯抗腫瘤過程中最為關鍵的Bcl成員。
2 改善患者生活質量
欖香烯輔助放化療治療惡性腫瘤具有顯著的療效,可有效降低或減弱放化療引起的毒副反應,明顯延長患者的生存期,從而提高患者的生活質量[56]。此外,欖香烯可參與到機體的免疫調節過程中,增強細胞的免疫功能和機體的抗腫瘤效果,同時還能降低或減少放化療引起的骨髓抑制、胃腸道反應及神經毒性等毒副反應的發生率,使患者的生活質量得以大大的提高或改善。田鋒奇等[57]研究證實了欖香烯對腫瘤腦轉移患者具有非常顯著的輔助治療效果,有效改善化療所致的白細胞減少,降低感染的發生率,從而提高腫瘤患者的生活質量。Jiang X等[58]通過系統評價和薈萃分析欖香烯注射液聯合放療在肺癌腦轉移患者的治療中,亦證實了欖香烯注射液能提高放療的治療效果,并且能顯著降低患者骨髓抑制、白細胞減少的發生率和減輕患者放療時引起的不良反應。Yao Y等[59]通過meta分析發現,動脈灌注欖香烯可以明顯改善TACE患者的ORR和顯著提高其生存期,欖香烯還可明顯改善TACE患者不良反應的發生率和強度,如骨髓抑制、胃腸道反應(腹痛、惡心和嘔吐等)、發燒或肝功能障礙(轉氨酶升高)等。由此可見,欖香烯可增強放化療的治療效果,顯著降低或減弱放化療引起的毒副反應,明顯延長患者的生存期,從而提高患者的生活質量。AEBF9029-B1FF-42BF-B20C-2CD454E35734
3 討論
欖香烯注射液是從姜科植物溫郁金和溫莪術中提取的一種具有抗腫瘤活性的化合物,其中醫、中藥學應用可見于《藥性論》《本草備要》《本草經讀》等著作。莪術和郁金具有活血行氣、開郁止痛、涼血清心和利膽退黃之功效,可用于破血消癥以及治療瘀血經閉、食積腹脹、癥瘕痞塊等病癥,為臨床常用的活血化瘀類藥物。此外,郁金屬苦寒之藥,而腫瘤多屬陽,因此郁金不單具有清熱解毒之功效,還能專攻抗癌,引諸藥直達病所,以使攻伐消散之品專于病所而不傷正。從莪術和郁金中,可提取出欖香烯以制備抗腫瘤藥物。1994年,我國上市了自主研發的欖香烯注射液,其具有療效確切、副作用輕微等特點,屬于二類非細胞毒性抗腫瘤新藥。欖香烯注射液對腫瘤細胞具有直接或破壞作用,并誘導其凋亡,而且還具有抑制腫瘤血管生成、增強機體自身的免疫功能以及促進機體對腫瘤的免疫原性等作用,亦能增強惡性腫瘤對放化療的敏感性,更能明顯改善和提高患者的生活質量。現今臨床中使用的抗腫瘤藥物均有不同程度的細胞毒性作用,即在抑殺腫瘤細胞的同時,也能殺傷或損傷機體的某些正常的組織細胞或功能器官,尤其是殺傷人體中生長發育旺盛的血液、淋巴組織細胞等,嚴重破壞了機體的免疫防御系統,從而使化療藥物的劑量或使用受到一定的限制,以致腫瘤迅速地發生和發展。而欖香烯注射液的問世,因其低毒、價廉且高效等優點,為腫瘤的防治提供了一種全新的選擇。
現今針對欖香烯注射液的抗腫瘤、抗癌效果,研究者們進行了大量的臨床試驗,對欖香烯藥理、藥效上的研究越來越精細,認識也越來越深入。但是欖香烯抗腫瘤作用的某些機制尚不甚明確,如在蛋白水平及線粒體等方向上還未能明確其相關作用機制,蛋白水平和線粒體等方向上具體的作用靶點和基因的相關研究亦較少。而且欖香烯注射液與免疫或化療藥物聯合應用抗腫瘤治療時的最佳搭配方案仍需要更進一步的深入研究。今后對于欖香烯注射液在分子水平和線粒體等方向上關于其作用靶點和相關基因學,以及欖香烯的最佳配伍方案的深入研究,將有助于為惡性腫瘤的治療提供更為全面的理論依據,同時亦能為腫瘤患者的治療制定出相應的最佳方案。
參考文獻
[1]楊驊, 王仙, 郁琳琳, 等. 欖香烯抗癌作用與誘發腫瘤細胞凋亡[J]. 中華腫瘤雜志, 1996, 18 (3): 11-14.
[2]BAI Z, YAO C,ZHU J,et al. Anti-Tumor Drug Discovery Based on Natural Product β-Elemene: Anti-Tumor Mechanisms and Structural Modification[J]. Molecules. 2021, 26(6):1499.
[3]曾建紅, 黃慶龍, 陳旭. 莪術抗癌活性成分的研究進展[J]. 中華中醫藥雜志, 2008, 23 (5): 426-428.
[4]孫靜. 莪術抗癌活性成分的研究進展[J]. 中國現代藥物應用, 2008, 2 (19): 118.
[5]花文峰, 蔡紹輝. β-欖香烯抗腫瘤作用的基礎與臨床研究[J]. 中藥材, 2006, 29 (1): 93-97.
[6]曹陽, 陳文娜, 趙丹玉, 等. 欖香烯誘導人肺癌細胞株A549凋亡研究[J]. 遼寧中醫藥大學學報, 2008, 10 (4): 146-147.
[7]龔敏, 梁鑫淼, 崔曉楠. 欖香烯對人肝癌HepG-2細胞增殖及拓撲異構酶Ⅰ的影響[J]. 中國癌癥雜志, 2011, 21 (5): 321-325.
[8]徐希, 莊彥, 章圣輝, 等. 欖香烯對B細胞淋巴瘤Raji細胞株的體內外抑制作用[J].中國臨床藥理學與治療學, 2011, 16 (8): 874-879.
[9]朱廷準, 徐英輝, 李曉明, 等. MEK信號通路活化在欖香烯致人源U87MG膠質瘤細胞增殖抑制及G0/G1細胞周期阻滯中的作用[J]. 實用藥物與臨床, 2013, 16 (1): 1-5.
[10]鄒麗娟, 李杰, 于麗敏, 等. β-欖香烯抗癌作用與誘發腫瘤細胞凋亡的研究[J]. 大連醫科大學學報, 1998, 20 (2): 9-11.
[11]李傳剛, 劉用楫, 馮秉安, 等. β-欖香烯對人BIU-87細胞誘導凋亡的實驗研究[J]. 中國中西醫結合外科雜志, 1999, 5 (6): 388-390.
[12]方寧, 陳代雄, 王海燕. β-欖香烯對腫瘤細胞內鈣離子的影響[J]. 遵義醫學院學報, 2002, 25 (1): 4-5.
[13]黃富春, 范鈺, 林庚金, 等. β-欖香烯誘導結腸癌LO-VO細胞凋亡的作用[J]. 復旦學報(醫學版), 2003, 30 (1): 49-51.
[14]吉慶明. 欖香烯對白血病K562細胞中凋亡相關基因PDCD5表達的影響[J]. 中國醫藥指南, 2008, 6 (3): 16-18.
[15]丁華, 趙洪瑜, 王燕, 等. 欖香烯注射液對腦膠質細胞瘤SHG-44細胞株放射增敏作用的研究[J]. 中國腫瘤臨床, 2009, 36 (21): 1253-1255.
[16]周興芹, 仇曉軍, 趙洪瑜, 等. 欖香烯乳對人肺腺癌549細胞株細胞周期及凋亡的影響[J].交通醫學, 2010, 24 (3): 233-235.
[17]趙永順, 吳春明, 董斌, 等. 欖香烯抑制Raf/MEK/ER信號通路誘導人源膠質瘤U87細胞凋亡[J]. 實用藥物與臨床, 2011, 14 (5): 365-367.
[18]LEBER M F, EFFERTH T. Molecular principles of cancer invasion and metastasis (review)[J]. Int J Oncol, 2009, 34: 881-895.AEBF9029-B1FF-42BF-B20C-2CD454E35734
[19]WOODHOUSE E C,CHUAQUI R F,LIOTTA L A. General mechanisms of metastasis[J]. Cancer, 1997, 80: 1529-1537.
[20]SILLETTI S, PAKU S, RAZ A. Tumor cell motility and metastasis: Autocrine motility factor as an example of ecto/exoenzyme cytokines[J]. Pathol Oncol Res, 1997(3):230-254.
[21]陳龍邦, 臧靜, 王靖華, 等. β-欖香烯對小鼠B16黑色素瘤細胞黏附、運動和間隙連接通訊功能的影響[J]. 腫瘤防治研究, 1999, 26 (3): 195-196.
[22]馮利, 林洪生.欖香烯對Lewis肺癌小鼠基底膜及細胞外間質影響的實驗研究[J]. 中國腫瘤臨床, 2005, 32 (15): 891-894.
[23]鄭瑾, 劉強, 任凱夕, 等. β-欖香烯對肝癌細胞SK-hep-1的遷移和侵襲力的影響[J]. 現代腫瘤醫學, 2009, 17 (11): 2054-2058.
[24]FU X, LV L, AN J, et al. Treatment with β-elemene combined with paclitaxel inhibits growth, migration, and invasion and induces apoptosis of ovarian cancer cells by activation of STAT-NF-κB pathway[J]. Braz J Med Biol Res, 2020, 53(6): e8885.
[25]CAI B, MA L, NONG S, et al. β-elemene induced anticancer effect in bladder cancer through upregulation of PTEN and suppression of AKT phosphorylation[J]. Oncol Lett, 2018, 16 (5): 6019-6025.
[26]陶磊, 周梁, 鄭璐瀅, 等. 欖香烯對真核細胞翻譯起始因子家族表達和血管生成的抑制作用[J]. 中華耳鼻咽喉頭頸外科雜, 2005, 40 (11): 840-845.
[27]張志鋒, 陳金水, 林小燕, 等.欖香烯聯合紫杉醇抗Lewis肺癌血管生成的研究[J]. 現代中西醫結合雜志, 2008, 17 (30): 4685-4687.
[28]周昆, 崔黎, 閆焱, 等. 欖香烯對人肺腺癌SPC-A-1細胞VEGF-C及VEGFR-3表達的影響[J]. 中國老年學雜志, 2008, 28 (6): 551-553.
[29]郝立宏, 盧步峰, 于麗敏, 等. β-欖香烯嗎素與阿霉素聯合應用對CEM/ADM細胞生長的影響[J]. 大連醫科大學學報, 2002, 22 (3): 165-167.
[30]王利, 魏品康, 秦志豐, 等. 欖香烯對耐藥胃癌細胞的逆轉實驗研究[J]. 成都中醫藥大學學報, 2005, 28 (2): 51-53.
[31]LI Q Q, WANG G,ZHANG M, et al. Beta-elemene, a novel plant-derived anti- neoplastic agent, increases cisplatin chemosensitivity of lung tumor cells by triggering ap-optosis[J]. Oncol Rep, 2009, 22 (1): 161-170.
[32]高金榮, 黃建鳴, 張國楠, 等.欖香烯增加人卵巢癌和宮頸癌細胞對紫杉醇反應性的研究[J].現代婦產科進展, 2010, 19 (8): 565-568.
[33]CAO C,WANG Q,LIU Y. Lung cancer combination therapy: doxorubicin and β-elemene co-loaded, pH-sensitive nanostructured lipid carriers[J].Drug Des Devel Ther, 2019(13):1087-1098.
[34]佘軍軍, 王子明, 車向明, 等. β-欖香烯對兔VX2腎移植癌的放射增敏作用[J]. 中西醫結合學報, 2006, 4 (4): 392-396.
[35]佘軍軍, 王子明, 車向明, 等. β-欖香烯對兔VX2腎癌放療增敏作用中Caspase-3及Bcl-2的表達[J]. 第四軍醫大學學報, 2006, 27 (24): 2285-2287.
[36]吳大鵬, 姜睿斌, 趙德強, 等.β-欖香烯乳對體外培養Tca-8113細胞放射增敏、細胞周期、凋亡及Bcl-2、Bax蛋白表達的影響[J]. 鄭州大學學報(醫學版), 2009, 44 (2): 414-417.
[37]JIANG H, MA S L,FENG J G. In vitro study of fadioseensiti-zation by β-elemene in A549 cell line from adenocarino-ma of lung[J]. Chin German J Clin Oncol, 2009, 8 (1):12-15.AEBF9029-B1FF-42BF-B20C-2CD454E35734
[38]張卓.β-欖香烯乳放射增敏作用及其相關靶點基因篩選的研究[D].大連:大連醫科大學, 2010.
[39]胡軍, 金偉, 楊佩滿.β-欖香烯逆轉人乳腺癌MCF-7/ADM細胞對阿霉素耐藥性的研究[J].中華腫瘤雜志, 2004, 26 (5): 268-270.
[40]LI X, WANG G, ZHAO J, et al. Anti-proliferative effect of beta-elemene in chemoresistant ovarian carcinom cells is mediated through arrest of the cell cycle at the G2-M phase[J]. Cell Molec Life Sci, 2005, 62 (7-8): 894-904.
[41]郝立宏, 趙瑾瑤, 丁艷芳, 等. β-欖香烯逆轉K562/ADM細胞MDR機制的探討[J]. 中國腫瘤臨床, 2005, 32 (10): 548-550.
[42]郝立宏, 趙瑾瑤, 高船舟, 等. β-欖香烯對K562/阿霉素細胞多藥耐藥性的逆轉及其對P-糖蛋白表達的影響[J]. 解剖學報, 2006, 37 (1): 48-51.
[43]楊愛珍, 錢軍, 秦叔逵, 等.人肺腺癌紫杉醇耐藥細胞株的建立及其生物學特性研究[J].臨床腫瘤學雜志, 2006, 11 (9): 657-661.
[44]陳春美, 楊衛忠, 王春華, 等.欖香烯對人腦膠質瘤U251/ADM耐藥細胞株多藥耐藥性的逆轉作用[J]. 中華實驗外科雜志, 2006, 23 (4): 601-603.
[45]ZHAO Y F, WANG C R, WU Y M, et al. P21 (wafl/cipl) is required for non-small cell lung cancer sensitive to Ge-fitinib treatment[J]. Biomed Pharmacotherapy, 2011, 65 (3): 151-156.
[46]DENG M, LIU B, SONG H, et al. β-elemene inhibits the metastasis of multidrug-resistant gastric cancer cells through mir-1323/cbl-b/egfr pathway[J]. Phytomedicine, 2020(69):153184.
[47]肖立森, 李佩蘭, 陸煒炎, 等. MTT法檢測欖香烯對人癌細胞敏感性的研究[J]. 中國腫瘤臨床, 1996, 23 (3): 223.
[48]吳偉忠, 劉康達.β-欖香烯誘導的抗腫瘤免疫保護作用機理初探[J]. 中華腫瘤雜志, 1999, 21 (6): 405-408.
[49]官成濃, 何國章, 銀正民, 等. 欖香烯乳配合化療對進展期胃癌患者免疫功能的影響[J].中國腫瘤臨床, 2001, 28 (2): 123-124.
[50]張思奮, 任東林, 羅湛濱, 等.動脈灌注欖香烯乳與直腸癌細胞的凋亡和增殖[J]. 腫瘤學雜志, 2002, 8 (5): 264-265.
[51]姚淑娟, 劉伯陽, 呂麗艷.欖香烯提高腫瘤化療藥物療效及抗免疫抑制作用的研究[J].中醫藥學刊, 2006, 24 (3): 456-457.
[52]王茜莎, 楊威, 董金華, 等.δ-欖香烯通過線粒體途徑誘導人結腸癌細胞DLD-1凋亡的研究[J]. 中國藥理學通報, 2010, 26 (5):647-654.
[53]姚成才, 涂遠榮, 姜杰, 等. 欖香烯乳誘導線粒體凋亡途徑逆轉肺癌A549/ DDP細胞株耐藥[J]. 現代腫瘤醫學, 2014, 22 (6): 1276-1281.
[54]史亞博, 陳婷婷. 欖香烯在線粒體相關途徑下抗腫瘤研究進展[J]. 現代中醫藥, 2020, 40 (5): 88-96.
[55]鄭京勝, 葉晶晶, 金利思, 等. 基于網絡藥理學的欖香烯注射液作用機制分析[J]. 中國中醫藥科技, 2020, 27 (5): 719-725.
[56]周興芹, 季斌, 仇曉軍, 等. 欖香烯乳注射液聯合放療治療肺癌腦轉移的臨床觀察[J]. 臨床腫瘤學雜志, 2010, 15 (11): 1014-1016.
[57]田鋒奇, 杜娟. 欖香烯注射液輔助治療肺癌腦轉移患者的臨床療效觀察[J].中國醫院藥學雜志, 2016, 36 (5): 395-397.
[58]JIANG X, HIDRU T H, ZHANG Z, et al. Evidence of elemene injection combined radiotherapy in lung cancer treatment among patients with brain metastases: A systematic review and meta-analysis[J]. Medicine (Baltimore), 2017, 96(21):6963.
[59]YAO Y, CHEN J,JIAO D, et al. Elemene injection combined with transcatheter arterial chemoembolization for unresectable hepatocellular carcinoma: A meta-analysis[J]. Medicine, 2019, 98 (44): 17813.
(收稿日期:2021-09-01 編輯:劉 斌)AEBF9029-B1FF-42BF-B20C-2CD454E35734

