不同外周血單個核細胞分離方法對流式細胞術分析結果的影響
牟大超,吳沙沙,周 軼
(四川大學華西醫院人類疾病和免疫治療研究室,四川 成都 610041)
外周血單個核細胞(peripheral blood mononuclear cell,PBMC)包括淋巴細胞、單核細胞、中性粒細胞等,PBMC被廣泛應用于生物醫學領域。在天然免疫方面,通過分離PBMC能分化誘導出不同類型的樹突狀細胞(dendritic cell,DC),DC在抗原識別和遞呈方面的研究較為廣泛[1]。在體液免疫方面,通過流式細胞術可分選出B淋巴細胞,該細胞對于全人源抗體的開發和應用具有重要意義。在細胞免疫方面,分離PBMC用于研究T淋巴細胞亞群和細胞因子水平能反映疾病發展程度[2-3]。此外,在生物治療領域,如嵌合抗原受體T細胞免疫療法等也離不開較好的PBMC分離方法[4-5]。
PBMC的分離方法有較為經典的Ficoll密度離心法、Percoll離心法和羥乙基淀粉(hydroxyethyl starch,HES)沉降法等[6-9],根據樣本類型和PBMC的后續應用可選擇不同的分離方法。本研究采用Ficoll離心法、HES沉降法和先HES沉降再Ficoll離心(HES+Ficoll)3種方法來分離相同樣本的PBMC,以探討不同分離方法對所得細胞后續流式細胞術分析結果的影響。
1 資料與方法
1.1 一般資料2019年5月,選擇四川大學華西醫院人類疾病和免疫治療研究室6位體檢健康的工作人員為受試對象,采集每位受試者外周血15 mL。受試者納入標準:無自身免疫性疾病、腫瘤、病毒和細菌感染等。本研究通過四川大學華西醫院生物醫學倫理委員會審查[2019年審(332)號],每位受試者均簽署知情同意書。
1.2 試劑與儀器人外周血淋巴細胞分離液購自北京Solarbio公司,HES購自加拿大Stemcell公司,1640高糖培養基和青鏈霉素購自美國Gibco公司,胎牛血清購自阿根廷Natocor公司,CD3流式抗體、CD4流式抗體和CD8流式抗體購自美國BD公司;細胞計數儀和顯微鏡購自美國Olympus公司。
1.3 實驗方法
1.3.1 PBMC分離將15 mL外周血平均分為3份,分別采用Ficoll離心法、HES沉降法和HES+Ficoll 法進行分離。Ficoll離心法:用等體積1640基礎培養基稀釋后,加入預先加了3 mL外周血淋巴細胞分離液的分離管中,平角離心機中800×g(離心機加速度和減速度調至最低)22 ℃離心15 min,取中間白膜層用磷酸鹽緩沖液(phosphate buffer saline,PBS)洗滌2次,所得細胞沉淀即為PBMC。HES沉降法:60 g·L-1的HES水溶液以51稀釋混勻后在37 ℃孵箱中靜置30 min,取上層澄清液體,離心得細胞沉淀,再用PBS洗滌2次,所得細胞沉淀即為PBMC。HES+Ficoll法:先用HES法得到細胞沉淀,再用外周血淋巴細胞分離液對其進行密度梯度離心,所得沉淀即為PBMC。分別用顯微鏡和細胞計數儀對3種方法得到的PBMC細胞進行形態觀察和計數。
1.3.2 PBMC凍存采用每1×106個細胞加入1 mL 凍存液的體系進行細胞凍存,凍存液為含體積分數10%二甲基亞砜的胎牛血清,加入凍存液的細胞放入細胞凍存管,再放入程序降溫盒,-80 ℃凍存過夜后轉出,于-80 ℃長期凍存。
1.3.3 流式細胞術檢測淋巴細胞將3種分離方法得到的凍存前后PBMC(凍存后細胞于37 ℃水浴復蘇)用熒光活化細胞分選系統(fluorescence actirated cell sorting,FACS)buffer洗1遍后進行FVS780染色,然后用含體積分數1%新生牛血清的PBS溶液洗滌細胞2遍,進行CD3、CD4和CD8抗體染色,抗體稀釋度均為1100,室溫避光孵育 30 min,洗滌后于200 μL PBS中重懸,然后進行流式細胞術檢測。根據前向散射光(forward scatter,FSC)和側向散射光(side scatter,SSC)確定淋巴細胞群,并計算PBMC中淋巴細胞所占比例、淋巴細胞中活細胞(FVS780熒光強度小于1×102為活細胞)所占比例(細胞存活率)和活細胞中CD4+T細胞數量與CD8+T細胞數量的比值(CD4+T/CD8+T)。
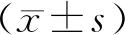
2 結果
2.1 3種分離方法得到的PBMC的形態和計數結果比較3種分離方法得到的PBMC形態均一致(圖1),相比于另外2種方法,用HES沉降法分離得到的PBMC除淋巴細胞外還有部分紅細胞。

A:Ficoll離心法;B:HES沉降法;C:Ficoll+HES法。
細胞計數結果顯示,Ficoll離心法、HES沉降法和Ficoll+HES法得到的PBMC數量分別為(2.50±0.27)×109、(5.75±1.64)×109、(8.98±0.81)×108L-1,HES沉降法所得PBMC數量顯著多于Ficoll離心法和Ficoll+HES法,差異均有統計學意義(P<0.05);Ficoll離心法所得PBMC數量高于Ficoll+HES法,差異有統計學意義(P<0.05)。
2.2 3種分離方法得到的PBMC凍存前后流式細胞術分析結果比較結果見表1。凍存前,Ficoll離心法、HES沉降法和Ficoll+HES法得到的PBMC中淋巴細胞存活率比較差異均無統計學意義(P>0.05)。HES沉降法得到的PBMC中淋巴細胞比例顯著低于Ficoll離心法和HES+Ficoll法,差異均有統計學意義(P<0.05);Ficoll離心法和HES+Ficoll法所得到的PBMC中淋巴細胞比例比較差異無統計學意義(P>0.05)。Ficoll離心法、HES沉降法和Ficoll+HES法得到的存活細胞中CD4+T/CD8+T比值比較差異無統計學意義(P>0.05)。

表1 3種分離方法得到的PBMC凍存前后流式細胞術分析結果比較
凍存6個月后,Ficoll離心法、HES沉降法和Ficoll+HES法得到的PBMC中淋巴細胞存活率比較差異均無統計學意義(P>0.05)。HES沉降法得到的PBMC中淋巴細胞比例顯著低于Ficoll離心法和HES+Ficoll法,差異均有統計學意義(P<0.05);Ficoll離心法和HES+Ficoll法所得到的PBMC中淋巴細胞比例比較差異無統計學意義(P>0.05)。Ficoll離心法、HES沉降法和Ficoll+HES法得到的存活細胞中CD4+T/CD8+T比值比較差異均無統計學意義(P>0.05)。
3種方法分離得到的PBMC凍存后淋巴細胞存活率均低于凍存前,PBMC中淋巴細胞比例高于凍存前,差異均有統計學意義(P<0.05);存活細胞中CD4+T/CD8+T比值與凍存前比較差異無統計學意義(P>0.05)。
3 討論
PBMC的分離已成為細胞生物學、免疫學,特別是流式細胞術分析和分選細胞的必備技術手段[10-11]。目前常用的分離方法有Ficoll分離法、Percoll密度梯度離心和HES沉降法等。Ficoll和Percoll分離法均為密度梯度原理[12],將樣本中不同大小細胞進行分離,相對來說Ficoll分離法成本更低,常見于實驗室中對外周血樣本的單個核細胞進行分離,但需要依賴高速離心條件,對儀器和技術人員依賴較大。HES沉降法主要利用其能與紅細胞所帶的負電荷相結合,使紅細胞凹面相貼,從而加速紅細胞的沉降,分離出上層白細胞[13],對硬件和技術人員要求不高,可用于病房、診所及事故發生地血樣的及時處理,并用于流式細胞術檢測。
臨床來源的樣本以外周血為主,當前流式細胞術是分析免疫細胞亞群最常用的手段,故本研究主要評價3種分離方法得到的PBMC對后續流式細胞術分析結果的影響,以驗證更為簡便的HES分離方法替代傳統Ficoll離心法的可行性。同一樣本以Ficill離心法分離PBMC時,細胞較為均一,極少有紅細胞混雜;使用HES沉降法進行分離時,所得細胞數量最多,但顯微鏡檢查結果顯示細胞不純,含有部分紅細胞;先HES沉降再進行Ficoll離心雖然細胞也較純,但收獲細胞數量受到影響。在對3種方法獲得的單個核細胞進行流式細胞術分析時發現,無論是新鮮分離的PBMC還是凍存后的PBMC,其中的淋巴細胞存活率比較差異均無統計學意義;雖然使用Ficoll離心法所得的PBMC中淋巴細胞比例最高,HES沉降法所得的PBMC中淋巴細胞比例最低,但從能反應機體免疫功能的指標CD4+T/CD8+T比值來看,3種分離方法所得結果比較差異無統計學意義,說明3種分離方法均能反映樣本的真實情況。使用HES法所得的淋巴細胞比例不高可能與其樣本中摻雜了紅細胞,導致細胞總量大有關。與凍存前相比,PBMC凍存后淋巴細胞存活率略有下降,但3種分離方法的淋巴細胞存活率仍高于75%,在可接受范圍內。凍存后淋巴細胞中CD4+T/CD8+T比值與凍存前比較差異無統計學意義,證實PBMC凍存的可行性。有研究顯示,HES分離方法還能用于稀有樣本或少量樣本的分離,如臍帶血、骨髓等,但影響HES分離效率的因素較多,如HES濃度、HES與樣本體積比例、沉降距離等[7,14],因此針對具體樣本,仍需對該方法進一步優化,形成針對特定樣本的標準化分離流程。
綜上所述,從分離所得細胞數量和純度以及免疫細胞亞群來看,HES沉降法分離得到的PBMC可用于后續FACS分析,在條件有限的實驗室可替代傳統Ficoll分離法用于 PBMC的分離。

