金絲桃苷對黃嘌呤氧化酶的抑制作用及分子機理
王 敏,徐國輝,趙一靈,王剛強,黃贛輝,
(1.南昌大學食品科學與技術國家重點實驗室,江西南昌 330047;2.江西省撫州市檢驗檢測認證中心,江西撫州 344000;3.四川樂山天馬晨達農業有限公司,四川樂山 614500)
黃嘌呤氧化酶(Xanthine oxidase,XOD)是動物機體內催化黃嘌呤和次黃嘌呤生成尿酸的關鍵酶[1]。過多的尿酸會進一步造成高尿酸血癥,長遠來看,高尿酸血癥還可誘發高血壓、糖尿病和腎功能衰竭等疾病[2]。如何有效抑制XOD活性一直是國內外研究的熱點。目前,市場上用于治療高尿酸血癥的西藥主要為別嘌呤醇和非布索坦(Febuxostat)等,這類藥物雖然可以有效地抑制XOD活性從而降低體內尿酸的含量,但長期服用會伴隨腹瀉、皮疹和頭暈等副作用的產生[3]。因此,尋找天然、有效、安全和廉價的XOD抑制劑至關重要。
金絲桃苷(Hypericin,HYP)是一種廣泛存在于黃蜀葵花中的天然膳食黃酮,其化學結構為槲皮素-3-O-β-D-吡喃半乳糖苷[4]。現代研究表明金絲桃苷具有抗氧化、抗癌、抗疲勞等多種功效[5-6],關于其抑制XOD的特性尚缺乏報道。因此,研究金絲桃苷與XOD的相互作用在XOD抑制劑的挑選中具有重要意義。目前,國內外主要利用酶動力學[7]、多光譜法[8]和分子對接[9]技術由表及里、從現象到機理來系統地分析小分子物質與蛋白酶的相互作用,通過這些方法可以分析得到小分子與蛋白酶的結合常數、結合位點、作用力類型以及作用過程中發生的構象變化等信息。而在實際應用中,除上述方法外,三維熒光光譜法可以利用三維投影圖和二維等高線圖提供直觀的猝滅信息[8]。如胡鵬[10]利用三維熒光光譜法研究了幾種多酚對牛乳蛋白的猝滅機制。但三維熒光光譜法、酶動力學法和分子對接還尚未應用于金絲桃苷和XOD的相互作用之中。因此,有必要結合多種研究方法從分子相互作用角度系統研究金絲桃苷對XOD活性的抑制作用,從而拓寬和提升金絲桃苷在膳食和醫藥領域的資源化利用。
本文以金絲桃苷和XOD為對象,采用酶抑制動力學來分析金絲桃苷對XOD活性的抑制作用,并通過多種熒光光譜法、紫外吸收光譜法和圓二色譜法探究金絲桃苷對XOD空間構象的影響,進一步采用分子對接技術預測金絲桃苷與XOD相互作用過程中分子作用力類型、結合位點、結合能量的變化。該研究旨在從分子層面上初步揭示金絲桃苷抑制XOD活性的機理,為金絲桃苷在開發具有潛力的功能性食品或藥品方面提供實驗和理論基礎。
1 材料與方法
1.1 材料與儀器
金絲桃苷(純度98%) 上海源葉生物科技有限公司;黃嘌呤氧化酶(Grade 1,from bovine milk,≥0.4 units/mg protein)、非布索坦和黃嘌呤 美國Sigma公司。
BSA124S電子天平 賽多利斯科學儀器(北京)有限公司;Multiskan FC酶標儀 上海賽默飛儀器有限公司;F-4500熒光分光光度計 日本日立有限公司;Cary 60紫外可見分光光度計 美國安捷倫公司;J-1700圓二色譜 日本分光(JASCO)公司;Auto Dock Tool軟件。
1.2 實驗方法
1.2.1 抑制動力學 參照Lin等[11]方法,并作適當修改。將金絲桃苷(200 μL,0~200 μmol/L),黃嘌呤(400 μL,2 mmol/L)和XOD(50 μL,0.5 U/mL)進行混合。孵育10 min后加入NaOH(100 μL,1.0 mol/L)終止反應。利用酶標儀在295 nm處測定吸光值。抑制率計算公式為:
式中:A1為不含金絲桃苷的陽性空白體系的吸光度;A2是樣本組的吸光度;非布索坦為陽性對照。
參照上述方法,固定黃嘌呤濃度(2 mmol/L),隨著XOD濃度(0~0.5 U/mL)的增加,分別測定不同濃度下金絲桃苷抑制XOD的酶促反應速率;固定XOD的濃度(0.5 U/mL),隨著黃嘌呤濃度(10~80 μmol/L)的增加,分別測定不同濃度反應體系下的酶促反應速率。由酶促反應速率(v)與XOD濃度[XOD]繪制的曲線可以評價抑制XOD的可逆性,以Lineweaver-Burk雙倒數作圖法可以判斷抑制類型,具體計算公式為[12-13]:

式中:v為有無金絲桃苷時XOD的催化反應速率;Km和Ki代表Michaelis-Menten常數和抑制常數;Vmax為XOD的最大反應速率;[I]和[S]分別為金絲桃苷和黃嘌呤的濃度;α是表觀系數。經二次計算后,斜率和y軸截距與[I]的曲線是線性擬合的,表明此時只有一種或一類抑制位點存在[14]。
1.2.2 普通熒光光譜分析 參考Liu等[15]的方法,并作適當修改。金絲桃苷(100 μL,100~500 μmol/L)和XOD(2 mL,0.1 U/mL)充分混合,空白對照是Tris-HCI緩沖液。將各反應溶液置于298、305和312 K溫度下孵育5 min后進行掃描。激發和發射波長分別設置為280、300~500 nm,狹縫寬度為5 nm,掃描速率為700 nm/min。
1.2.3 同步熒光光譜分析 溶液配制方法同1.2.2。不同的是,在250~350 nm的波長范圍內,Δλ(λem~λex)值調整為15和60 nm。由如下公式計算同步熒光猝滅率(RSFQ):

式中:F和F0分別為有無金絲桃苷時XOD的熒光強度。
1.2.4 三維熒光光譜分析 參照Li等[8]的方法,并作適當修改。金絲桃苷(100 μL,300 μmol/L)和XOD(2 mL,0.1 U/mL)充分混合,空白溶液代表XOD的熒光光譜。在發射波長和激發波長范圍分別為230~600、200~360 nm,增量10 nm的條件下測定各反應溶液的熒光強度。
1.2.5 紫外吸收光譜 參照Sarmah等[16]的方法,并作適當修改。金絲桃苷(200 μL,100~500 μmol/L)和XOD(3 mL,0.1 U/mL)充分混合后孵育5 min。波長范圍設置為200~500 nm,用紫外吸收光譜儀對各反應溶液進行測定。
1.2.6 圓二色譜 參照Li等[17]的方法,并作適當修改。簡而言之,金絲桃苷(0.5 mL,12.5~100 μmol/L)與XOD(0.5 mL,0.1 U/mL)的混合物在波長為200~250 nm,掃描速度100 nm·min-1條件下進行掃描。測定結果導入SELCON3應用程序(http://dichr oweb.cryst.bbk.ac.uk/html/home.shtml),分 析XOD不同二級結構的含量變化。
1.2.7 分子對接 Auto Dock Tool軟件可以預測金絲桃苷與XOD的相互作用信息[18]。配體小分子從ZINC數據庫中獲取,XOD(PDB code:1FIQ)的三維晶體結構從Protein Data Bank數據庫下載。在對接軟件上刪除XOD的A、B鏈以及原始配體非布索坦,僅保留C鏈和MOS,并設置C鏈的活性中心坐標為(X,Y,Z)=(24.645,15.383,108.204)。經前處理和指令運行后,根據結合能(Eb)越低,結合越穩定的原理對對接結果進行分析[19]。將HYP-XOD配合物的主導構象導入PYMOL軟件進行繪圖[20]。
2 結果與分析
2.1 金絲桃苷對XOD的抑制分析
體外測定不同濃度金絲桃苷對XOD的抑制結果表明,金絲桃苷的IC50值為(162.059±2.291)μmol/L,遠高于陽性對照非布索坦(0.222±0.019)μmol/L。這說明金絲桃苷具有一定的抑制作用,可能是一種有效的XOD抑制劑。推測其抑制能力與化學結構有關:金絲桃苷A環的5',7'位置和B環的3',4'位置上含有羥基,以及C環3'位置上連接的葡糖基外圍有四個羥基,這些有利的羥基可能決定著XOD的抑制能力[12,21]。
金絲桃苷介導的抑制劑的抑制可逆性由酶動力學曲線圖判斷。圖1A顯示,每條直線都經過原點,且隨著金絲桃苷濃度的增加,其斜率逐漸減小,這表明金絲桃苷以可逆的方式抑制XOD活性,且金絲桃苷抑制XOD是由黃嘌呤氧化引起的酶活性總體下降引發的,而不是有效酶數量的減少[22]。
Lineweaver-Burk圖可判斷金絲桃苷對XOD的抑制類型。由圖1B可看出,每條直線的斜率和截距都不同,但都相交于第二象限,這說明金絲桃苷是通過混合競爭的方式來抑制XOD的。對斜率Slope(1C)和y軸截距Y-intercept(1D)與抑制劑濃度[I]進行二次計算后,得知Ki值和α值分別為(18.079±0.154)和(8.027±0.031)μmol/L,這表明金絲桃苷與游離XOD的結合比與XOD配合物的結合更容易且更緊致。此外,斜率Slope與抑制劑濃度[I]線性擬合狀態良好,表明金絲桃苷對XOD只有一個或一類抑制位點[11]。
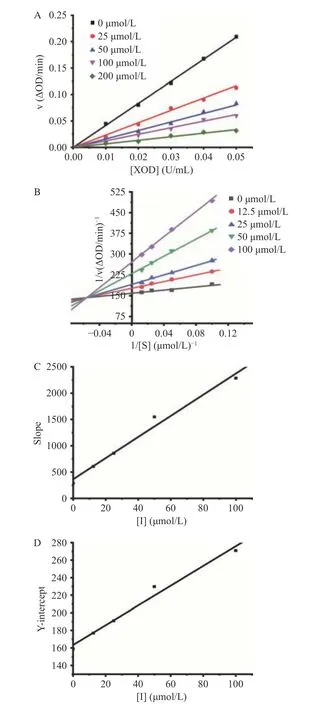
圖 1 不同金絲桃苷濃度下的動力學曲線圖Fig.1 Enzyme kinetic curves of hypericin at different concentrations
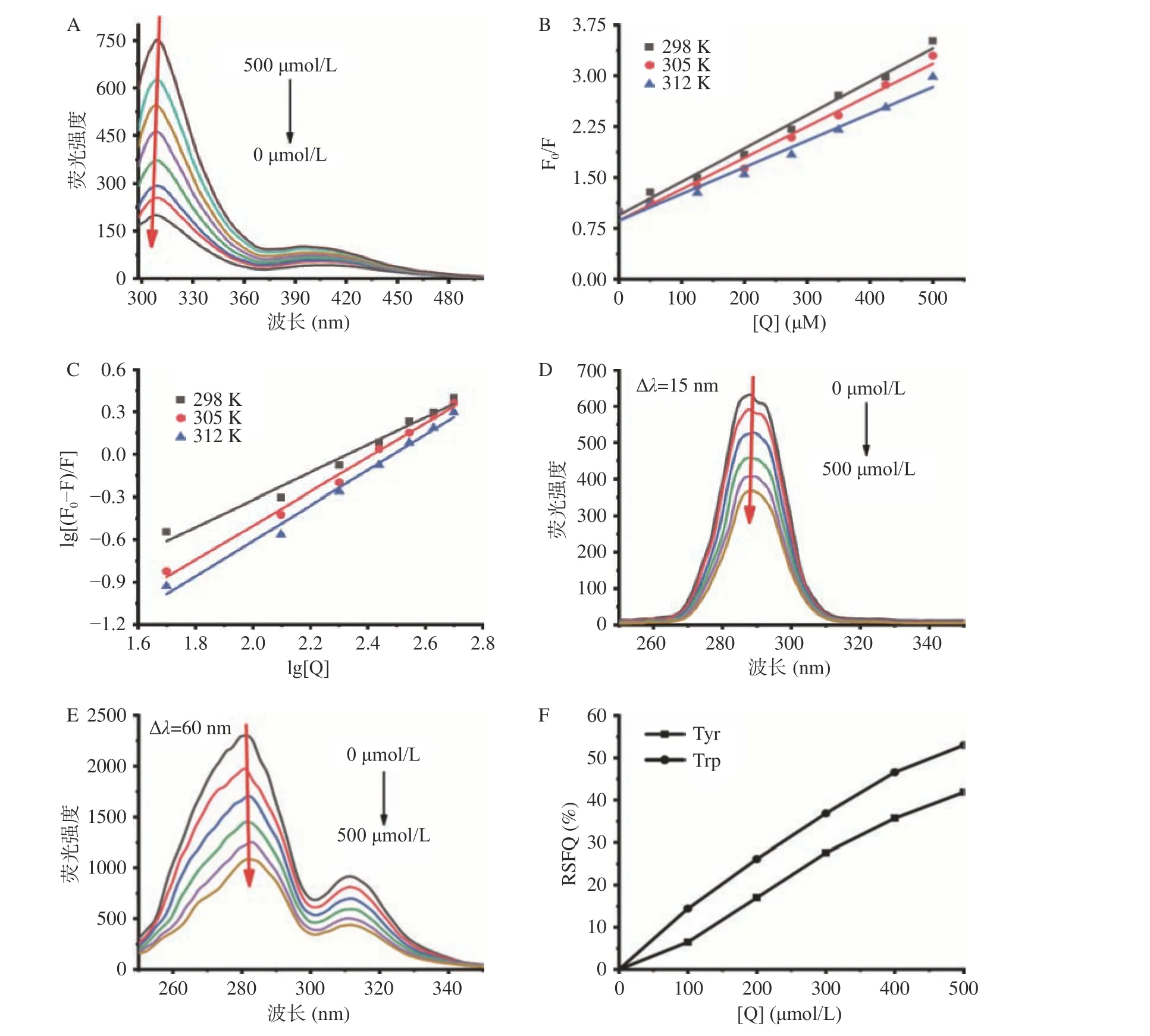
圖 2 不同金絲桃苷濃度下的熒光猝滅曲線圖Fig.2 Fluorescence quenching curves of hypericin at different concentrations
2.2 熒光猝滅分析
基于上述實驗中測定的抑制動力學結果,熒光猝滅分析將提供更多關于相互作用過程中的信息,如結合機制、結合常數和結合位點等[23]。眾所周知,熒光猝滅是指由于某些過程使樣品的熒光強度減弱,包括多種分子相互作用,如激發態絡合物形成(靜態猝滅)和碰撞淬滅(動態淬火)。當激發波長為280 nm時,可測定色氨酸(Trp)和酪氨酸(Tyr)兩種氨基酸殘基的熒光強度,由Stern-Volmer方程表示為:
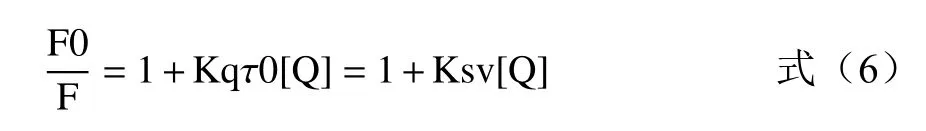
式中:F0為XOD的熒光強度;F為加入猝滅劑后的熒光強度;[Q]為金絲桃苷的濃度;Kq為猝滅速率常數;τ0(10-8s)為未加入猝滅劑時熒光團的平均壽命;Ksv是Stern-Volmer猝滅常數。
如圖2A所示,隨著金絲桃苷濃度的增加,XOD的熒光強度逐漸被猝滅,發射峰的位置略有移動,這是金絲桃苷與XOD發生相互作用的直接證據。由圖2B可知,隨著溫度的升高,Kq值(在298、305和312 K下,分別為4.92、4.63和3.94×1010L·mol-1·s-1)遠大于最大散射碰撞猝滅常數(2×1010L·mol-1·s-1),說明金絲桃苷對XOD的熒光猝滅機制為靜態猝滅而非動態猝滅,且進一步說明了金絲桃苷與XOD形成了配合物,在較高溫度下,HYP -XOD配合物的穩定性會減弱。
結合強度(結合常數Ka)和結合位點(n)由雙對數方程得到:
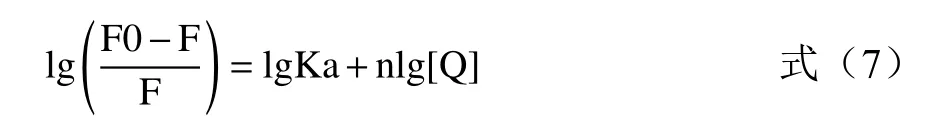
根據圖2C中lg[(F0-F)/F]與lg[Q]的回歸曲線的截距和斜率,計算出三種溫度下HYP-XOD配合物的Ka和n值(見表1)。較高的Ka值(105L/mol)和較高的線性相關系數表明HYP-XOD配合物具有很強的親和力;n值在不同溫度下近似等于1,這些結果說明金絲桃苷在XOD上只有一個或一類結合位點,該實驗結論與上述酶動力學實驗結果一致。
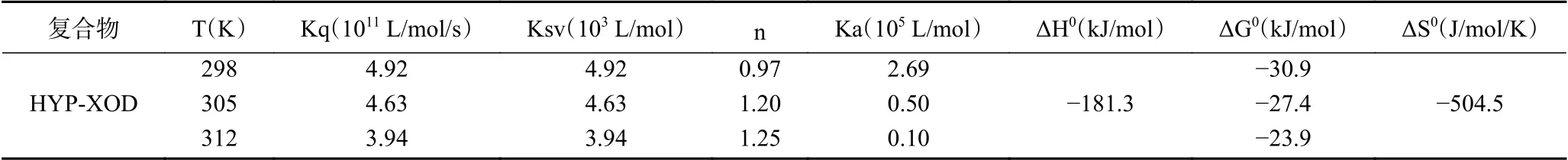
表1 不同溫度下金絲桃苷與XOD相互作用的結合常數和熱力學參數Table 1 Bind constants and thermodynamic parameters for the interaction of XOD with hypericin at different temperatures
2.3 熱力學參數測定
配體與大分子結合的驅動力主要有氫鍵、范德華力、靜電引力和疏水作用力[24]。反應系統的熱力學參數如焓變(△H0)、熵變(△S0)和自由能變化(△G0),通常是判斷作用力類型的主要依據,由Van’t Hoff方程可得:

式中:Ka為結合常數(298、305、312 K);T為實驗溫度;R為氣體常數,8.314 J/mol·K。
當ΔH0>0和ΔS0>0時,表示主要驅動力為疏水作用力;ΔH0<0和ΔS0<0則表示主要驅動力為范德華力和氫鍵;ΔH0<0和ΔS0>0則為靜電相互作用[25]。通過計算ΔH0和ΔS0的正負性可以發現(表1),范德華力和氫鍵是HYP-XOD配合物形成的主要驅動力;ΔG0<0說明金絲桃苷與XOD的結合過程是自發的。這些結果表明,金絲桃苷在與XOD結合的過程中通過形成范德華力和氫鍵作用力改變了XOD的空間構象,在此有必要進一步探討金絲桃苷對XOD構象的影響。
2.4 同步熒光光譜分析
同步熒光光譜已成為一種觀測蛋白酶構象變化的理想手段。當設置測量波長間隔(Δλ)分別為15和60 nm時,可以提供XOD中酪氨酸(Tyr)和色氨酸(Trp)殘基的特征信息,從而可以解釋發色團分子周圍極性和疏水性的變化[15]。
圖2D和圖2E顯示了金絲桃苷在XOD上的同步熒光光譜。由圖可知,XOD的熒光強度隨金絲桃苷的加入而有規律地降低,這再一次說明了結合過程中發生了熒光猝滅。隨著金絲桃苷的加入,親水性氨基酸Tyr殘基的最大熒光發射峰沒有發生位移,而疏水性氨基酸Trp殘基的最大熒光發射峰則出現輕微的紅移(281.2到282.0 nm)。這一現象表明:金絲桃苷的加入改變了XOD中疏水性氨基酸Trp殘基附近的微環境,使得Trp殘基所處的微環境疏水性略微增強,從而影響XOD的空間構象。此外,通過計算Tyr和Trp殘基的RSFQ值(圖2F)發現,在同樣的條件下,Trp的RSFQ值顯著(P<0.05)高于Tyr,說明Trp殘基對XOD的熒光猝滅有較好的促進作用,金絲桃苷與XOD活性部位的Trp殘基接近,而不靠近Tyr殘基[26]。

圖 3 XOD體系和HYP-XOD體系的三維熒光光譜及二維等高線圖Fig.3 Three-dimensional fluorescence spectra and corresponding contour maps of XOD and HYP-XOD systems
2.5 三維熒光光譜
三維熒光光譜可以充分顯示蛋白酶的熒光信息[27]。由XOD(圖3A和圖3B)和HYP-XOD配合物(圖3C和圖3D)的三維熒光光譜可以看到,有一個類似“脊”的瑞利散射峰(峰a)和兩個類似“竹筍”的熒光峰(峰1和峰2)。峰1代表蛋白酶上的內源熒光特征峰,峰1的變化反映了蛋白酶三級結構的變化;峰2是由蛋白質多肽的碳骨架π→π*躍遷引起的,峰2的強度反映蛋白酶二級結構的變化[11]。其中XOD和HYP-XOD配合物的熒光強度分別為411.0和272.5;隨著金絲桃苷的加入,峰1和峰2強度明顯降低。HYP-XOD配合物強度變化越大,表明金絲桃苷可能極大的改變了XOD的空間構象。此外,隨著金絲桃苷的加入,峰1和峰2的位置有輕微移動,說明金絲桃苷和XOD相互作用導致蛋白質多肽鏈發生輕微的解折疊,從而使XOD的空間構象發生變化,這和文獻報道的茶多酚能和乳球蛋白相互作用導致蛋白發生解折疊的結論一致[28]。
2.6 紫外吸收光譜
為了進一步驗證猝滅機制,紫外可見吸收光譜已經成為評估蛋白酶構象變化的有用方法[15]。如圖4A所示,XOD的紫外可見吸收光譜圖中有兩個明顯的吸收峰,最大吸收峰分別位于Band Ⅰ的376 nm和Band Ⅱ的266 nm處。隨著金絲桃苷濃度的增加,Band Ⅰ和Band Ⅱ的吸收值逐漸增大。據了解,靜態猝滅可以增加或減少蛋白酶的吸收光譜,而動態猝滅只會影響熒光團的激發態,不改變蛋白酶的吸收光譜[15]。吸光值的增加可能是由于金絲桃苷與XOD相互作用時引起某些氨基酸殘基的結構發生變化所致。由此可知,結果再次證明金絲桃苷與XOD結合是靜態猝滅過程。
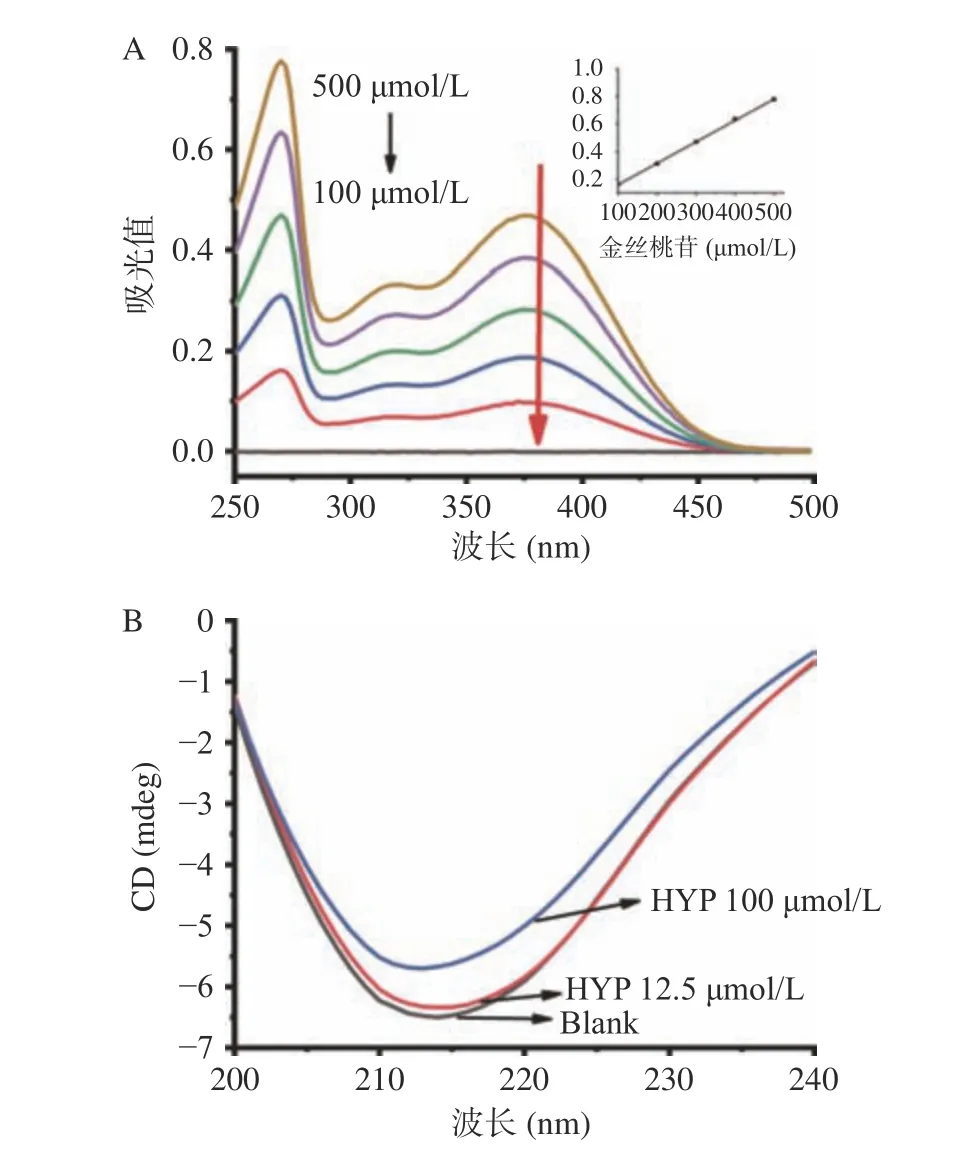
圖 4 不同金絲桃苷濃度下的紫外吸收光譜和圓二色譜圖Fig.4 UV-vis absorption spectra and CD spectra of hypericin at different concentrations
2.7 圓二色譜分析
CD光譜可以定量分析金絲桃苷介導的XOD的二級結構,詳細闡述XOD二級結構的具體變化值[16]。在216 nm附近有一個負峰(圖4B),這是二級結構β-折疊的特征峰,負峰強度隨著金絲桃苷濃度的增加而逐漸降低,說明金絲桃苷可以改變XOD的二級結構。由表2可知,α-螺旋和無規則卷曲的含量分別從8.2%增加到17.5%、26.4%增加到34.2%;β-折疊和β-轉角的含量分別從44.8%減少到29.9%、20.6%減少到18.3%。由此推測,金絲桃苷引起的構象變化可能會阻止黃嘌呤(底物)與XOD活性域(Mo-pt)的結合,從而阻止催化反應的發生。此外,我們還發現XOD以β-折疊結構為主,這與Zhang等[1]的報道一致。

表2 CD光譜分析金絲桃苷對XOD二級結構含量的影響Table 2 Effect of the content secondary structure of hypericin on XOD by CD spectra
2.8 分子對接
分子對接可以預測小分子(膳食黃酮)與XOD之間的相互作用,且可直觀看到兩者間相互作用的具體形式。從理論上講,活性中心一旦與抑制劑結合,周圍的大部分空間就會被堵塞,此時將會阻礙黃嘌呤(底物)的著落,最終阻止XOD發生催化反應[10]。圖5顯示了金絲桃苷與XOD的結合,金絲桃苷與大量氨基酸殘基(GLN767, GLY797, PHE798, GLY913,MET1038, GLN1040, LEU1042, LYS1045, ALA 1078, ALA1079, SER1080, VAL1081, SER1082,ASP1084, GLN1194, ALA1258, GLU1261)形成范德華力,這些范德華力可能有利于形成穩定空腔,相關殘基均在活性域內。C-4'上的羥基與殘基THR1083形成氫鍵(?=2.3),說明氫鍵是金絲桃苷與XOD結合的另一個主要作用力。這些結果表明,在金絲桃苷與XOD的非共價相互作用中,范德華力和氫鍵是主要作用力,證實了上述熱力學參數分析的正確性。
3 結論
本研究發現,金絲桃苷主要以氫鍵和范德華力與XOD的催化活性區域發生相互作用,并以混合競爭的方式抑制XOD的活性;金絲桃苷在與XOD結合的過程中使得發色團XOD發生熒光猝滅效應,且隨著猝滅劑濃度的增加,XOD的熒光強度逐漸減弱;金絲桃苷的加入改變了XOD的二級結構,其中α-螺旋和無規則卷曲的含量增加,β-折疊和β-轉角的含量減少。這些結果均說明金絲桃苷能夠有效地抑制XOD活性。接下來將進一步通過動物實驗及臨床研究對金絲桃苷抑制XOD的藥代動力學以及藥物安全性進行探討,希望能將金絲桃苷作為一種有用的膳食黃酮真正應用于高尿酸血癥患者的飲食當中。

