響應面法優化牛初乳免疫球蛋白熱保護劑的配方
楊 紅,劉愛國, ,劉立增,強 鋒,楊 毅
(1.天津商業大學生物技術與食品科學學院,天津市食品與生物技術重點實驗室,天津 300134;2.天津天獅學院,天津 301700;3.彼特銳斯(天津)商貿有限公司,天津 300300)
隨著經濟的迅速發展,功能性保健食品越來越受到大眾的青睞,牛初乳作為一種富含免疫活性物質的功能性食品原料,在食品市場受到廣泛關注。牛初乳是健康奶牛正常產犢三天內從乳腺分泌出來的乳汁,含有大量的優質蛋白質、維生素、礦物質、生物活性成分以及20多種病原體特異性抗體[1],因其具有增強人體免疫力[2]、促進組織生長[3]、預防上呼吸道感染[4]、修復受損組織[5]和調節腸道菌群[6]的功效,已成為近年來國內外研究熱點。
IgG是牛初乳中最重要的生物活性蛋白之一,其是以二硫鍵連接兩條重鏈和兩條輕鏈,由四個多肽亞單位組成的“Y”型四肽鏈分子。新鮮的牛初乳中IgG的質量濃度是30~87 mg/mL[7],大約是常乳的50倍,具有極高的營養價值,因此,開發以牛初乳為原料的新型功能性食品具有一定的實際意義。但是IgG易受外界受熱、酸、堿等不良環境因素影響而變性[8],牛初乳在實際食品加工過程中要經過巴氏殺菌和噴霧干燥等熱處理工藝,IgG活性損失極為嚴重,其營養功效不能充分展現,因此,提高IgG的穩定性從而有效發揮其生理活性尤為重要。
目前對牛初乳IgG活性保護的相關研究已有報道,在牛初乳中加入糖、多元醇和氨基酸等物質具有的保護作用,可以有效提高牛初乳IgG的穩定性[9],研究表明,可能是由于這些物質增強了IgG分子中疏水相互作用,也可能是添加保護劑后的溶液中蛋白質分子優先溶劑化進而導致蛋白質的表面張力和溶液黏度的增加[10],在一定程度上,氨基酸對IgG的保護作用可能是由氨基酸的羧基引起的,不同種類的氨基酸因其羧基基團的數量和位置不同,其保護效果也存在明顯差異[11]。Chao等[10]以蔗糖、乳糖、葡萄糖、半乳糖和麥芽糖等物質作為IgG熱保護劑,研究發現,添加5%的果糖或麥芽糖保護效果最好,可以將殘留IgG含量提高到31%,添加量大于30%會導致殘留IgG含量下降。雷昌貴等[12]選取常用食品添加劑等對牛初乳IgG的熱穩定性的影響進行探討,研究發現磷酸氫二鈉、蔗糖、乳酸鈣、葡萄糖、羧甲基纖維素鈉等食品添加劑對IgG有一定的保護作用。但以上相關報道主要集中在探究單一種類的物質對其活性的影響,且添加的物質缺乏功能性,關于IgG復合熱保護劑的研究鮮有報道。
因此,本研究以牛初乳IgG作為研究對象,采用菊粉、甘氨酸、麥芽糖醇制備成復合熱保護劑,以IgG活性保留率為響應值,采用響應面法對IgG復合熱保護劑配方進行優化,并通過傅里葉變換紅外光譜和內源性熒光光譜表征不同方式處理的牛初乳IgG結構。旨在為IgG在實際生產加工過程中的活性保持技術提供新思路,為牛初乳這一優質功能性食品原料的高值利用提供一定理論依據。
1 材料與方法
1.1 材料與儀器
牛初乳(產犢48 h內) 天津嘉立荷牧業有限公司第五牧場;凝乳酶(890 U) 山東悠樂滋生物科技有限公司進口分裝;IgG標準品(36 μg/mL) 廈門慧嘉生物科技有限公司;麥芽糖醇、甘氨酸 食品級,河南萬邦實業有限公司;菊粉 食品級,重慶驕王天然產物股份有限公司;磷酸二氫鉀、磷酸氫二鈉、硫酸銨分析純,天津市光復科技發展有限公司;ELISA試劑盒 廈門慧嘉生物科技有限公司。
FA2004A電子天平 上海精天儀器有限公司;HW-S24電熱恒溫水浴鍋 上海一恒科學儀器有限公司;EL20實驗室pH計 梅特勒-托利多儀器有限公司;TG16-WS臺式高速冷凍離心機 長沙湘儀離心機儀器有限公司;F-4600熒光分光光度計 日立高新技術公司;Nicolet傅里葉變換紅外光譜儀 美國尼高力儀器有限公司;Spark-10M酶標儀 帝肯上海貿易有限公司。
1.2 實驗方法
1.2.1 免疫球蛋白的提取 參照徐欽[13]的方法,并稍作修改,牛初乳于4 ℃,1000 r·min-1離心20 min除去上層脂肪,在脫脂后的牛初乳中,加入0.02%的凝乳酶反應30 min后,于4 ℃,8000 r·min-1離心30 min得到去除酪蛋白的乳清液。按1:1比例向乳清液中加入PBS緩沖液(pH7.4,0.01 mol/L),再緩慢滴加2倍于乳清體積的飽和(NH4)2SO4至終濃度為50%,4 ℃靜置24 h后,于4 ℃,8000 r·min-1離心30 min,將沉淀用5%原乳清體積的PBS緩沖液(pH7.4,0.01 mol/L)溶解后裝入透析袋,4 ℃透析48 h,中間更換溶液2~3次。以1% BaCl2或納氏試劑檢測透析液,直至無SO42-或NH4+出現為止,將透析所得產物冷凍干燥后即得IgG粗提物,-20 ℃儲存待用。
1.2.2 IgG活性保留率計算 準確稱取IgG粗提物5 g溶于PBS緩沖液(pH7.4,0.01 mol/L)中制成5 g/L的免疫球蛋白稀溶液備用,在室溫條件下,用渦旋混合器充分混勻,在不同質量濃度下將熱保護劑添加至IgG粗提物的稀釋溶液中,待熱保護劑充分溶解后,于75 ℃水浴5 min后立即用冰水水浴[14],空白對照組不添加任何熱保護劑在同樣條件下進行熱處理。采用IgG酶聯免疫試劑盒測定IgG質量濃度,按照試劑盒說明書進行操作,在450 nm處測得樣品的吸光度,用下式計算IgG活性保留率[15]。

式中:a表示IgG加熱后質量濃度,μg/mL;b表示IgG加熱前質量濃度,μg/mL。
1.2.3 單因素實驗 以IgG活性保留率為指標,分別選取甘氨酸添加量(0.1%、0.3%、0.5%、0.7%、0.9%)、菊粉添加量(5%、10%、15%、20%、25%)、麥芽糖醇添加量(5%、10%、15%、20%、25%)進行單因素實驗,考察不同因素對牛初乳中IgG活性保留率的影響(每組因素添加量的中間值為固定添加量)。
1.2.4 響應面試驗設計 在單因素實驗的基礎上,根據中心組合Box-Behnken設計原理,以IgG活性保留率為響應值,選取甘氨酸、菊粉和麥芽糖醇作為響應因子,進行3因素3水平響應面試驗設計,確定IgG的最優復合熱保護劑配方,試驗因素水平見表1。

表1 響應面設計因素與水平Table 1 Factors and levels of response surface experiment
1.2.5 傅里葉紅外變換光譜分析 根據曲金萍等[16]的方法用紅外光譜測定樣品的二級結構,將光譜純KBr研磨成細粉,將待測樣品與干燥的KBr按質量比50:1充分混合,制成均勻的圓形透明薄片,用紅外光譜儀進行紅外光譜掃描,得到紅外光譜掃描圖,用KBr制作空白壓片。紅外光譜分析條件為:透射模式,掃描波數4000~400 cm-1,掃描次數32次,分辨率4 cm-1,每個樣品做三次平行實驗。采用ONMIC軟件對數據圖像進行處理,并對樣品的紅外圖譜進行基線校正、對酰胺I帶區域進行傅里葉自去卷積計算,分開重疊在一起的不同峰,在二階導數譜圖基礎上進行高斯擬合,根據分開峰的位置確定子峰的歸屬,通過計算子峰的峰面積,求出擬合后的樣品二級結構含量(用百分數表示)。
1.2.6 內源性熒光光譜分析 采用1.2.2的方法制備5 g/L免疫球蛋白溶液,采用F-4600熒光分光光度計在280 nm下的激發波長下,測定溶液的熒光強度。熒光分光光度計分析條件為:激發波長為280 nm,掃描記錄區間為300~400 nm,激發和發射狹縫寬度設置為10 nm,數據采集速度為60 nm/min,光電倍增管電壓為400 V。
1.3 數據處理
采用Design-Expert.V8.0.6軟件進行響應面試驗設計,采用SPSS18.0軟件進行數據分析,采用Origin 9.5軟件對數據進行繪圖,采用SPSS(P<0.05)軟件中ANOVA方法對數據進行差異顯著性檢驗分析,所有試驗均平行測定3次。
2 結果與分析
2.1 IgG的標準曲線
按照1.2.2方法進行檢測,用ELISA試劑盒于450 nm波長處測定不同質量濃度IgG標準品的吸光度值,以IgG標準品的質量濃度為橫坐標,吸光度值為縱坐標。所獲得的標準曲線方程為:y=0.151x+0.0483(R2=0.9992),說明測定的濃度范圍內標準曲線的相關性良好,后續IgG含量測定均使用此方程進行計算。
2.2 IgG粗提物紅外光譜分析
蛋白質或多肽在1700~1200 cm-1紅外光譜區有明顯的特征吸收帶,其中酰胺I帶和II帶為強吸收帶,酰胺III帶為弱吸收帶,這些吸收帶能反映蛋白質的二級結構變化[17]。酰胺I帶的譜峰歸屬是目前研究相對較為成熟的[18]:1610~1640 cm-1為β-折疊;1640~1650 cm-1為無規卷曲;1650~1658 cm-1為α-螺旋;1660~1695 cm-1為β-轉角。采用1.2.1的方法將牛初乳中IgG進行提取得到其粗提物,將IgG標準品和IgG粗提物在4000~400 cm-1波數范圍內進行掃描。圖1顯示了IgG標準品和IgG粗提物的紅外圖譜,與IgG標準品相比,牛初乳中的IgG經過提取后,粗提物中均保留了特征峰,說明提取過程對IgG的結構性質方面的影響不大,基本保持了IgG原有的結構。

圖 1 IgG標準品與粗提物的紅外光譜對比Fig.1 FT-IR spectra comparison of IgG standard sample and crude extract
2.3 單因素實驗結果
2.3.1 不同添加量甘氨酸對IgG活性保留率的影響
不同添加量甘氨酸對IgG活性保留率的影響結果如圖2所示,據文獻研究報道,甘氨酸對于牛初乳IgG的熱保護效果較好[19]。不添加任何熱保護劑時,在75 ℃條件下處理5 min,IgG活性保留率僅為20.34%。由圖2可以看出,當甘氨酸添加量從0.1%提高到0.3%時,IgG活性保留率32.64%提高到36.56%。當甘氨酸的添加量達0.5%時,IgG活性保留率與添加量為0.3%時無顯著差異,當添加量達到0.7%時,IgG活性保留率顯著下降(P<0.05),這可能是由于IgG分子的結合部位全部被占用后,繼續添加甘氨酸反而抑制了對IgG的熱保護作用[20],因此,選取適當的甘氨酸添加量尤為重要,適當添加甘氨酸可以提高牛初乳IgG的活性保留率,添加量過多則會帶來負面效果,終選定甘氨酸添加量0.5%為響應面設計中心點。

圖 2 不同添加量甘氨酸對IgG活性保留率的影響Fig.2 Effect of different additions of glycine on the retention rate of IgG
2.3.2 不同添加量菊粉對IgG活性保留率的影響不同添加量菊粉對IgG活性保留率的影響結果如圖3所示,由圖3可知,隨著菊粉添加量的增加,樣品中IgG活性保留率呈現先上升后下降的變化趨勢,當菊粉量超過10%以后,只能使IgG活性保留率輕微上升,可能的原因是當菊粉添加量達到一定的濃度后,IgG能夠與羥基結合的部位基本上被全部占用,無法增強IgG分子中疏水相互作用[20-21],當菊粉添加量超過15%(m/V)以后,IgG活性保留率開始顯著下降(P<0.05)。由單因素方差分析可知,不同添加量的菊粉對IgG活性保留率的影響存在顯著差異(P<0.05),最終選定菊粉添加量15%為響應面設計中心點。

圖 3 不同添加量菊粉對IgG活性保留率的影響Fig.3 Effect of different addition amount of inulin on the retention rate of IgG
2.3.3 不同添加量麥芽糖醇對IgG活性保留率的影響 不同添加量麥芽糖醇對IgG活性保留率的影響結果如圖4所示,由圖4可知,隨著麥芽糖醇添加量的增加,樣品中IgG活性保留率呈現先上升后平緩的變化趨勢,這與羅磊等[21]研究結果一致,當麥芽糖醇添加量達到10%以后,添加更多的麥芽糖醇只能使IgG活性保留率些許上升,最后趨于平緩,且15%、20%、25%添加量的活性保留率并無顯著性差異(P>0.05),推測其原因與菊粉相似,因為麥芽糖醇和菊粉同為多羥基化合物。由單因素方差分析可知,不同添加量的麥芽糖醇對IgG活性保留率的影響存在顯著性差異(P<0.05),但10%、15%、20%和25%的麥芽糖醇添加量的活性保留率均無顯著差別,考慮到食品中糖醇類物質不能添加過多[22],因此最終選定麥芽糖醇添加量10%為響應面設計中心點。

圖 4 不同添加量麥芽糖醇對IgG活性保留率的影響Fig.4 Effect of different addition amounts of maltitol on the retention rate of IgG

圖 5 甘氨酸添加量和菊粉添加量的交互作用對IgG活性保留率的響應面圖和等高線圖Fig.5 Response surface plot and contour plot of the interaction between glycine supplemental level and inulin supplemental level on IgG retention
2.4 響應面試驗優化結果
2.4.1 響應面試驗設計及結果 在單因素實驗的基礎上,根據中心組合Box-Behnken設計原理進行響應面優化試驗,隨機進行17組試驗,試驗方案及結果如表2所示。
2.4.2 模型建立及擬合分析 采用Design Expert 8.0.6軟件對表2的試驗結果進行多元非線性回歸擬合,得到IgG保留率(Y)對甘氨酸添加量(A)、菊粉添加量(B)、麥芽糖醇添加量(C)的二次回歸方程:Y=36.34-0.37A-0.24B+1.15C+1.65AB-0.88AC+0.90BC-4.30A2-1.57B2-1.49C2。

表2 響應面試驗結果Table 2 Results of response surface experiment
為檢驗該二次回歸方程的有效性,對IgG保留率的數學模型進行模型系數顯著性檢驗和方差分析,結果見表3,該回歸模型極顯著(P<0.01),失擬項不顯著(P>0.05),這兩種結果均表明多元回歸模型擬合方程在回歸區域內擬合較好,理論誤差值較小,可用該回歸模型對牛初乳IgG熱保護劑的最優配方進行預測。模型多元決定系數R2=94.51%,校正決定系數R2adj=87.46%,說明響應值(IgG活性保留率)的變化有94.51%來自于所選的變量(甘氨酸、菊粉和麥芽糖醇的添加量)。各因素的F值可以反映各因素對試驗指標的重要性,F值越大,表明對響應值IgG活性保留率的影響越大。由表3可知,各因素對IgG活性保留率的影響順序為:C(麥芽糖醇添加量)>A(甘氨酸添加量)>B(菊粉添加量)。從表3中還可以看出,二次項A2對結果有極高顯著的影響(P<0.001),一次項C、交互項AC、二次項B2和二次項C2對結果的影響為顯著(P<0.05),這表明各因素對響應值(IgG活性保留率)不是簡單的線性關系。

表3 回歸模型方差分析Table 3 Analysis of variance of regression model
2.4.3 兩因子間交互作用分析 通過Design Expert 8.0.6軟件對回歸方程進行分析,得到兩個交互項之間的響應面圖及等高線圖,如圖5~圖7所示。響應面圖曲面的坡度和等高線的形狀可以較為直觀地反映出各因素的交互作用影響的大小[23]。曲面坡度越陡峭,表明兩個變量交互作用越顯著,反之則不顯著;等高線的形狀為橢圓形表示交互作用對響應值的影響顯著,而圓形則表示交互作用對響應值的影響不顯著。由圖5、圖6、圖7可知,菊粉和甘氨酸添加量的響應面曲面坡度較為陡峭,等高線圖越接近橢圓,說明這兩個變量的交互作用對響應值具有顯著性影響,菊粉和麥芽糖醇添加量交互作用的響應面曲面坡度較為平緩,等高線圖越平緩近似圓形,說明彼此之間的交互作用越弱。
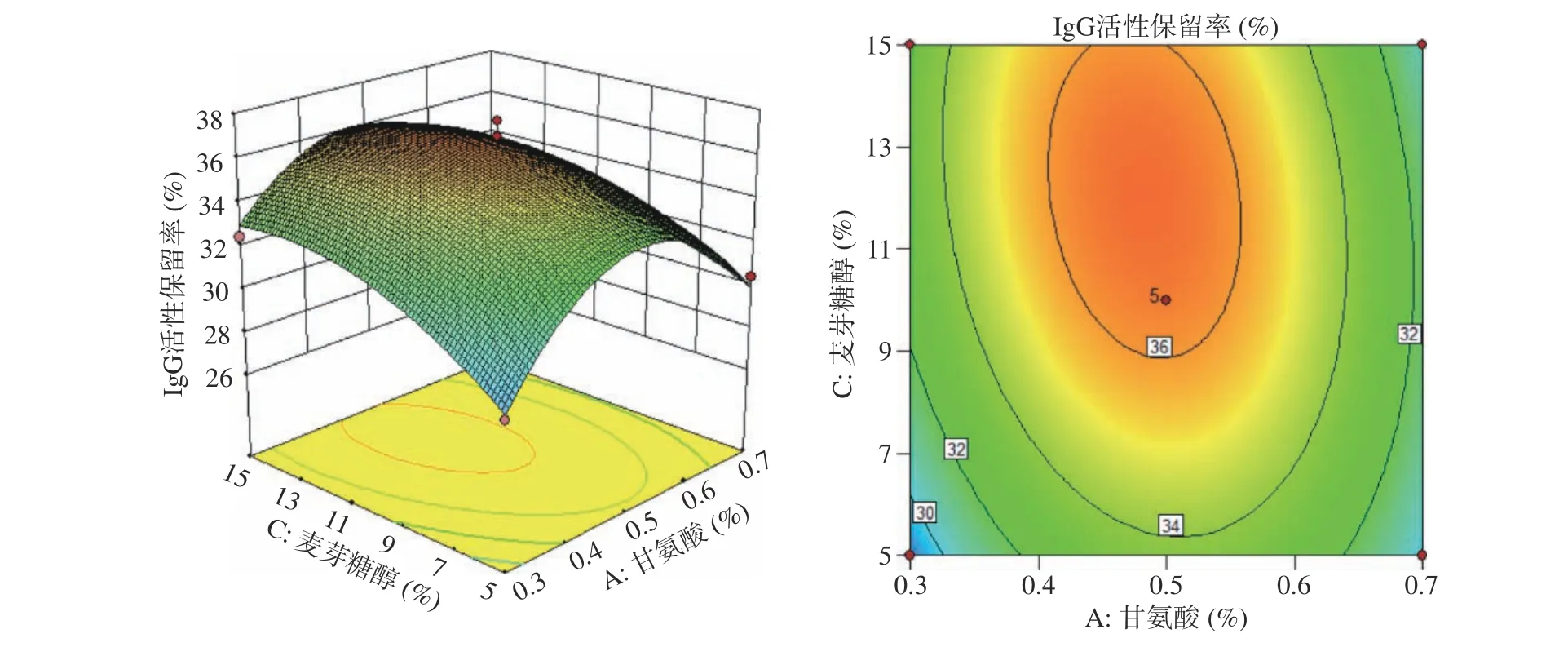
圖 6 甘氨酸添加量和麥芽糖醇添加量的相互作用對IgG活性保留率的響應面圖和等高線圖Fig.6 Response surface plot and contour plot of the interaction between glycine and maltitol supplemental levels on IgG retention

圖 7 菊粉添加量和麥芽糖醇添加量的相互作用對IgG活性保留率的響應面圖和等高線圖Fig.7 Response surface plot and contour plot of the interaction between inulin and maltitol supplemental levels on IgG retention

圖 8 不同處理方式下IgG的FT-IR譜圖Fig.8 FT-IR spectra of IgG under different ways
通過Design Expert 8.0.6軟件對方程求極大值,得到牛初乳IgG復合熱保護劑最優配方:甘氨酸添加量0.48%,麥芽糖醇添加量12.50%,菊粉添加量14.98%,此時IgG活性保留率36.59%。考慮到試驗過程實際操作的可行性,將最佳配方調整為甘氨酸添加量0.50%,麥芽糖醇添加量12.50%,菊粉添加量15.00%,按此條件下,進行3次重復驗證試驗,結果取平均值,得到牛初乳IgG保留率38.11%±0.84%,驗證值與預測值的誤差在允許范圍5%內,說明該模型合理可靠。
2.5 傅里葉變換紅外光譜分析
傅里葉變紅外換光譜可快速有效地測定蛋白質的二級結構。蛋白質的傅里葉紅外圖譜一般有3組特征吸收帶,分別是酰胺I帶、酰胺II帶和酰胺III帶,對應的波數分別為1700~1600 cm-1、1550~1530 cm-1、1330~1260 cm-1[24]。酰胺I帶對蛋白質二級結構較為敏感,因此,紅外圖譜的酰胺I帶(1700~1600 cm-1)是研究蛋白質的二級結構最有價值的區域,其紅外吸收峰主要是由C=O的伸縮震動引起的,且吸收最強。利用傅里葉變換紅外光譜儀對不同方式處理的IgG樣品進行全波段掃描,結果如圖8所示。由圖8可知,IgG紅外光譜圖中于3300 cm-1左右呈現強而寬的吸收峰,表明IgG分子多聚體中可能存在許多分子內或分子間氫鍵,不同條件下處理的IgG樣品紅外圖譜形狀趨勢相似,對比未經熱處理的IgG樣品的紅外圖譜,加熱處理后的蛋白樣品紅外光圖譜的特征峰強度明顯減弱,表明熱處理可以造成IgG樣品二級結構的轉化和改變。
熱處理會破壞分子內的氫鍵作用,影響蛋白質的二級結構單元比例,使蛋白質結構部分分解折疊,導致無序結構增加,表現為β-轉角和無規則卷曲含量增加[25]。由表4可以看出,三種樣品的二級結構均以β構象為主,但是未熱處理樣品(A)占比相對較高。經過75 ℃,5 min條件下熱處理后ɑ-螺旋顯著降低(P<0.05),可能是因為熱處理后IgG的二級結構穩定性降低,其熱變性導致ɑ-螺旋中的氫鍵逐漸斷裂,進而發生解旋現象,導致ɑ-螺旋比例降低;無規則卷曲顯著增加(P<0.05),表明IgG樣品的結構從有序向無序轉變;β構象是蛋白聚集體的特征構象,熱處理可引起樣品熱變性并促進分子間的聚集,進而導致熱聚集體增加,表現為β-折疊含量增加,熱處理后IgG的β-折疊含量增加表明熱聚集體增加,但顯著(P<0.05)低于未熱處理樣品,初步推測這可能與添加復合熱保護劑的IgG在熱處理后形成的內環境有關。添加復合熱保護劑后的熱處理IgG樣品(C)與空白對照組(B)相比,β-折疊含量顯著下降(P<0.05),無規則卷曲含量顯著下降(P<0.05),表明熱聚集體減少[26],二級結構較為有序,β-轉角含量顯著上升(P<0.05),可能由于熱處理過程中行成熱聚集體,IgG分子結構部分解折疊誘導無序結構的增加,添加的復合熱保護劑與IgG分子發生一定的反應,使分子間的β-折疊結構易轉變成β-轉角結構,進而導致其含量增加。綜上,該復合熱保護劑對維持牛初乳IgG結構穩定性的氫鍵具有一定的保護作用。

表4 IgG的二級結構含量分布Table 4 Secondary structural contents of IgG samples
2.6 內源性熒光光譜分析
蛋白質分子中的氨基酸殘基側鏈含有一定量的發色團,如色氨酸、酪氨酸和苯丙氨酸[27],其中色氨酸殘基是蛋白質中最主要的內源熒光來源,色氨酸殘基側鏈(吲哚基團)的內源性熒光信號對其微環境的極性非常敏感,因此可利用內源性熒光作為監測蛋白的三級結構構象和微環境的極性變化十分有效[28]。熱處理會使蛋白質的三級結構構象發生改變,而蛋白質三級結構構象變化可通過色氨酸等氨基酸殘基的暴露程度來反映[29],圖9為不同方式熱處理的IgG樣品在300~400 nm的內源性熒光圖譜。由圖9可知,不同處理方式對其熒光光譜的形狀影響不明顯,即IgG構象變化不明顯,而熒光強度有所改變。未添加復合熱保護劑熱處理后的樣品比未熱處理樣品相比,熱處理后IgG的三級結構展開嚴重,其天然排列方式被破壞,色氨酸殘基的暴露程度增大,導致其熒光強度增大。與未添加復合熱保護劑的熱處理樣品相比,在加熱條件下添加復合熱保護劑的IgG樣品的熒光強度明顯降低,張和平等[30]發現牛初乳IgG在超高壓條件下添加蔗糖時對其具有保護作用,使IgG樣品熒光強度降低,本文結果與其一致。該結果表明添加復合熱保護劑對IgG的三級結構具有保護作用,可能是因為復合熱保護劑添加到IgG中,減少了色氨酸等疏水性氨基酸殘基的暴露,降低了表面疏水性,使IgG分子堆積更加緊密,維持其天然狀態[31]。

圖 9 不同方式處理下IgG內源性熒光光譜圖Fig.9 Fluorescence intensity of IgG tryptophan under different protective ways
3 結論
本研究通過單因素及響應面法對牛初乳IgG復合熱保護劑進行配方優化,得到一種最優的IgG復合熱保護劑:甘氨酸添加量0.48%、菊粉添加量14.98%、麥芽糖醇添加量12.50%,該復合熱保護劑對IgG結構具有一定的穩定作用,可以效地減少熱處理時牛初乳中IgG的活性損失,熱處理(75℃,5 min)后IgG活性保留率可達36.59%,較空白對照組的IgG樣品提高了16.25%。結果表明:添加復合熱保護劑后熱處理的IgG樣品與空白對照組相比,β-折疊含量顯著下降(P<0.05),無規則卷曲含量顯著下降(P<0.05),二級構象呈現較為有序的狀態;熒光強度降低,減少了色氨酸等疏水性氨基酸殘基的暴露,降低了表面疏水性,使IgG分子堆積更加緊密。該復合熱保護劑在牛初乳產品的進一步開發具有較好的實際應用價值,為牛初乳功能性食品的研發提供了一定的參考依據。本文未考察在酸堿條件下牛初乳IgG保護劑的最佳配方,目前國內外學者對牛初乳IgG活性保留率的影響因素有較多研究,但對其活性保持的機理及其結構變化的研究報道鮮少,并缺乏系統性研究,以后應嘗試從分子層面研究保護劑對牛初乳IgG的作用機制。

