百香果皮總黃酮的復合酶輔助超聲波提取工藝優化及其抗氧化活性分析
張小梅 ,王 聰,靳曉琳,侯旖旎,鄭麗萍
(1.鄭州工程技術學院化工食品學院,河南鄭州 450053;2.河南牧業經濟學院,河南鄭州 450046)
百香果(Passiflora edulis),又稱為西番蓮、雞蛋果,是一種熱帶亞熱帶特色水果,原產于巴西,二十世紀初引入我國,廣泛種植于廣西、四川、臺灣等地[1-3]。百香果皮,重量約為單果質量的一半,但在果肉加工過程中,大量果皮作為廢料被丟棄或少量用作飼料,造成資源的極大浪費。國內的百香果研究側重于它的采后品質與保鮮技術研究[3-5],隨著對百香果深加工利用的不斷重視,百香果皮深加工的相關研究也相繼出現,如從百香果皮中提取果膠[6]、多糖[7]、酚類[8],制備超微果皮粉[9]、果脯[10]等。研究表明,從植物中提取的黃酮類化合物具有較高的藥用價值,如抗癌[11]、抗氧化[12]、抗焦慮[13]、抗炎[14]等作用。因此,植物類黃酮的提取也引起了眾多學者的重視。而百香果皮中活性成分的有效提取,將為百香果的深加工利用[15]提供了一條有效途徑。
目前,關于百香果皮總黃酮的提取研究方法已有相關報道,如超聲輔助乙醇提取法[16],逆流提取法[17]提取其黃酮,也有采用聯合法進行提取,如余啟明等[18]通過對比實驗說明:微波預處理-超聲波提取法得到百香果皮提取物的黃酮得率和體外抗氧化活性都要比單獨用超聲和浸提法優越;酶解提取法由于能破壞植物細胞的纖維素、半纖維素和果膠等物質結構,使得總黃酮更容易釋放而被眾多學者廣泛應用于提取黃酮上。研究表明,復合酶的效果好于單一酶,如徐玉霞等[19]研究了單一酶和復合酶對海紅果中總黃酮提取率的影響,試驗表明使用酶法提取黃酮要優于傳統的有機溶劑萃取法,且復合酶的效果好于單一酶,當纖維素酶與果膠酶質量之比為2:1時效果最好。但是有關復合酶輔助超聲波法對百香果皮中黃酮提取的研究還鮮見報道。
因此,本文將復合酶解提取技術和超聲波提取技術相結合,應用響應面設計方案,并對百香果皮中提取的總黃酮進行體外抗氧化實驗,測定了DPPH自由基和羥自由基清除能力,以期為百香果皮中黃酮的進一步研究提供參考。
1 材料與方法
1.1 材料與儀器
百香果(新鮮、完整無破損) 購自廣西贛南;蘆丁標準品(HPLC≥98%) 上海賢鼎生物科技有限公司;纖維素酶(50000 U/g)、果膠酶(60000 U/g)食品級,浙江一諾生物科技有限公司;1,1-二苯基-2-苦肼基(DPPH) 上海易恩化學技術有限公司;硝酸鋁、亞硝酸鈉、水楊酸、過氧化氫 分析純,天津市科密歐化學試劑有限公司;氫氧化鈉、硫酸亞鐵 分析純,天津市風船化學試劑科技有限公司;無水乙醇、抗壞血酸、95%乙醇、檸檬酸、檸檬酸鈉 分析純,天津市通凱化學試劑有限公司。
400A多功能粉碎機 永康市紅太陽機電有限公司;FA2204B電子天平 上海精科天美科學儀器有限公司;L530離心機 上海盧湘儀離心機儀器有限公司;SHZ-82回旋式水浴恒溫振蕩器 金壇市水北科普實驗儀器廠;KQ-600KDE高功率數控超聲波清洗儀 昆山市超聲儀器有限公司;TU-1810紫外可見分光光度計 北京普析通用儀器設備有限責任公司。
1.2 實驗方法
1.2.1 百香果皮預處理 去掉百香果果肉,將果皮洗凈,在50 ℃的烘箱中烘烤24 h取出,用粉碎機將其粉碎,過80目篩,裝入自封袋低溫保存并備用。
1.2.2 百香果皮黃酮提取工藝 參考張麗靜等[20]的方法,并作修改。取1.00 g樣品于50 mL離心管中,按照設定的料液比添加所需濃度的乙醇溶液,放入超聲波清洗儀在240 W的功率下超聲一定的時間,再加入不同質量的復合酶、采用pH為4.6的檸檬酸-檸檬酸鈉緩沖溶液調節體系的pH,搖勻后,在50 ℃的水浴振蕩器中酶解一定時間。離心機的轉速設置為8000 r/min,離心5 min;取上清液用體積分數為60%乙醇溶液定容至50 mL得黃酮粗提取液。
1.2.3 百香果皮黃酮得率的測定
1.2.3.1 蘆丁標準溶液的配制 參考王洪彪[21]的方法,并作修改。稱取0.2000 g蘆丁標準品于燒杯中,用60%的乙醇超聲波溶解后,全部轉移至100 mL容量瓶中并定容,配制為2 mg/mL的溶液,吸取5 mL溶液于50 mL的容量瓶中,定容即為0.2 mg/mL的蘆丁標準溶液。分別吸取0.00、0.50、1.00、2.00、3.00、4.00 mL 0.2 mg/mL標準溶液于6只10 mL容量瓶中,加入0.3 mL 5% NaNO2,搖勻,靜置6 min;再加入0.3 mL 10% Al(NO3)3,搖勻,靜置6 min;最后,加入4 mL 4% NaOH,用60%乙醇定容后,靜置15 min;即得到0.00、0.01、0.02、0.04、0.06、0.08 mg/mL蘆丁標準溶液,在400~600 nm處紫外光譜掃描,于508 nm處測吸光值。
1.2.3.2 百香果皮中黃酮得率的測定 取1.00 mL 1.2.2中制備的黃酮粗提取液于10 mL容量瓶中,按照1.2.3.1繪制標準曲線的方法進行顯色反應后于508 nm處測定其吸光值。根據標準曲線方程計算黃酮濃度,參照公式(1)得到黃酮得率。
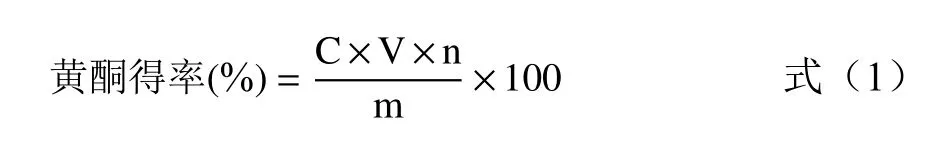
式中:C為樣品中黃酮濃度,mg/mL;V為黃酮粗提取液的體積,50 mL;n為稀釋倍數,10;m為百香果皮粉末的質量,mg。
1.2.4 單因素實驗
1.2.4.1 酶解時間對百香果皮黃酮得率的影響 稱取1.00 g預處理后的百香果皮粉末置于50 mL離心管中,固定超聲功率240 W、復合酶(纖維素酶和果膠酶復配比為2:1(g/g))用量4%、酶解溫度50 ℃、液料比25:1 mL/g,超聲時間45 min,改變酶解時間(15、30、45、60、75、90 min)研究其對百香果皮黃酮得率的影響。
1.2.4.2 復合酶的添加量對百香果皮黃酮得率的影響 在1.2.4.1的基礎上,固定酶解時間45 min,改變復合酶的用量(1%、2%、3%、4%、5%、6%)研究其對百香果皮黃酮得率的影響。
1.2.4.3 乙醇體積分數對百香果皮黃酮得率的影響
在1.2.4.2的基礎上,固定復合酶的添加量4%,改變不同體積分數的乙醇溶液(40%、50%、60%、70%、80%)研究其對百香果皮黃酮得率的影響。
1.2.4.4 料液比對百香果皮黃酮得率的影響 在1.2.4.3的基礎上,固定60%的乙醇溶液,改變液料比(15:1、20:1、25:1、30:1、35:1、40:1 mL/g)研究其對百香果皮黃酮得率的影響。
1.2.4.5 超聲時間對百香果皮黃酮得率的影響 在1.2.4.4的基礎上,固定液料比25:1 mL/g,改變超聲時間(25、35、45、55、65 min)研究其對百香果皮黃酮得率的影響。
1.2.5 響應面試驗設計 根據Box-Behnken試驗設計原理,綜合單因素實驗結果,選取影響復合酶輔助超聲法提取百香果皮黃酮得率的主要因素復合酶添加量(A)、酶解時間(B)、料液比(C)和超聲時間(D)作為自變量,以黃酮得率為響應值,利用軟件Design-Expert.V8.0.6.1設計四因素三水平的優化試驗。因素及水平編碼見表1。
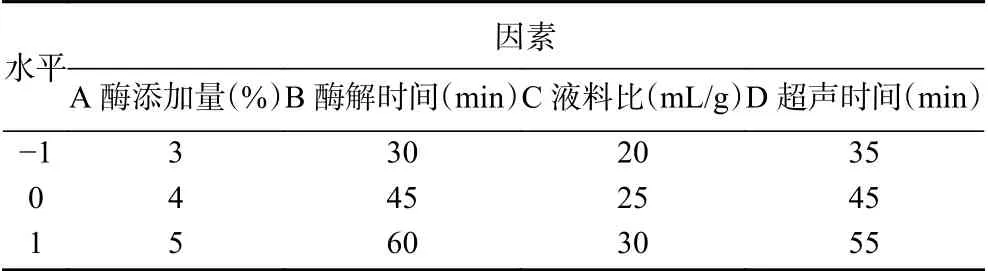
表1 響應面試驗因素水平設計Table 1 Box-Behnken test design
1.2.6 百香果皮黃酮抗氧化活性的測定 百香果皮中黃酮抗氧化活性強弱以樣品清除率為50%時所對應的濃度(EC50,mg/mL)來判斷。
1.2.6.1 DPPH自由基清除率測定 參考張會香等[22]與楊宗玲等[23]的方法,并作修改。在1.2.2實驗中得到最優的黃酮粗提取液濃度為44.2 mg/mL。取5支試管,分別加入0.2、0.4、0.6、0.8、1.0 mL百香果皮黃酮粗提取液,用60%的乙醇定容后,即得到濃度依次為0.09、0.18、0.27、0.35、0.44 mg/mL的黃酮粗提取液。再取5支試管,對應移取不同濃度梯度的黃酮粗提取液2 mL,各加入2 mL 7.5 mmol/L的FeSO4,搖勻后,避光反應30 min,在517 nm處測定吸光值AS。取2 mL不同濃度的樣品黃酮提取液于試管中,分別向其中加入2 mL的無水乙醇并搖勻,作為對照,在517 nm處測定吸光值AC。再取一支試管,加入2 mL DPPH溶液和2 mL無水乙醇,搖勻并在517 nm處測定吸光值AB,抗壞血酸組為對照。參照公式(2)計算DPPH清除率。
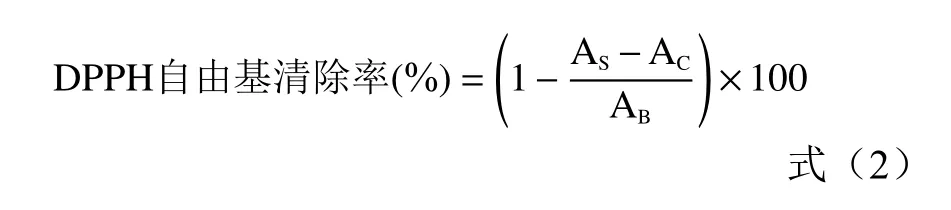
1.2.6.2 OH自由基清除率測定 參考張倩茹[24]的方法,稍作修改。取5支比色管,向每支管中依次加入1.00 mL上述再次稀釋10倍后的黃酮粗提取液、9 mmol/L FeSO4溶液1.00 mL以及1.00 mL 8.8 mmol/L H2O2溶液,混勻后靜置10 min。最后加入1.00 mL 9 mmol/L水楊酸乙醇溶液,搖勻靜置30 min后在510 nm處測吸光值Ai。1.00 mL蒸餾水與1.00 mL 9 mmol/L FeSO4溶液、1.00 mL 8.8 mmol/L H2O2溶液按照上述步驟反應后測吸光值A0。1.00 mL不同濃度梯度的黃酮粗提取液、1.00 mL 8.8 mmol/L H2O2溶液及1.00 mL蒸餾水混勻后按上述步驟反應后測吸光值Aj。OH自由基清除率按照公式(3)計算:
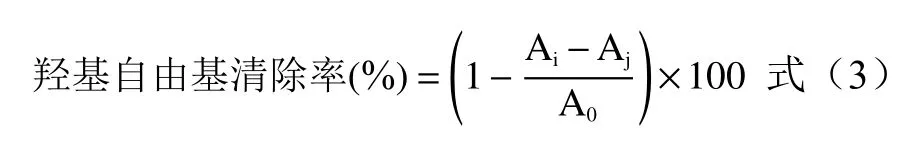
1.3 數據處理
以上處理均做3次平行試驗,圖表中數據為3次實驗數據的平均值。利用軟件Design-Expert.V8.0.6.1進行試驗設計,軟件Origin 8.0對試驗數據進行繪圖。
2 結果與分析
2.1 蘆丁標準曲線的繪制
按照1.2.3.1方法測定吸光值,以蘆丁質量濃度為橫坐標,吸光值為縱坐標繪制標準曲線,見圖1。得到回歸方程:y=11.693x-0.0196(R2=0.9966),其中y為吸光值A,x為蘆丁濃度(mg/mL)。根據試驗結果,蘆丁在0.00~0.08 mg/mL的濃度范圍內與吸光值有良好的線性關系。
2.2 單因素實驗
2.2.1 酶解時間對百香果皮黃酮得率的影響 由圖2所示,隨著酶解時間的不斷增加,黃酮的得率逐漸提高,并在酶解45 min時有最大得率;但是隨著酶解時間的繼續延長,黃酮的得率不斷下降。原因可能是:a.酶解時間較短,復合酶不能將百香果皮的細胞壁完全分解,黃酮物質不能較好的與提取溶劑乙醇接觸,提取不完全;b.隨著酶解時間的延長,細胞壁酶解充分,黃酮得率隨之提高;c.酶解時間過長,產物的積累、酶活性部位發生變化導致酶活降低等現象都會使得酶受到抑制作用,最終使得黃酮得率降低[25]。因此,選擇酶解時間為45 min最佳。
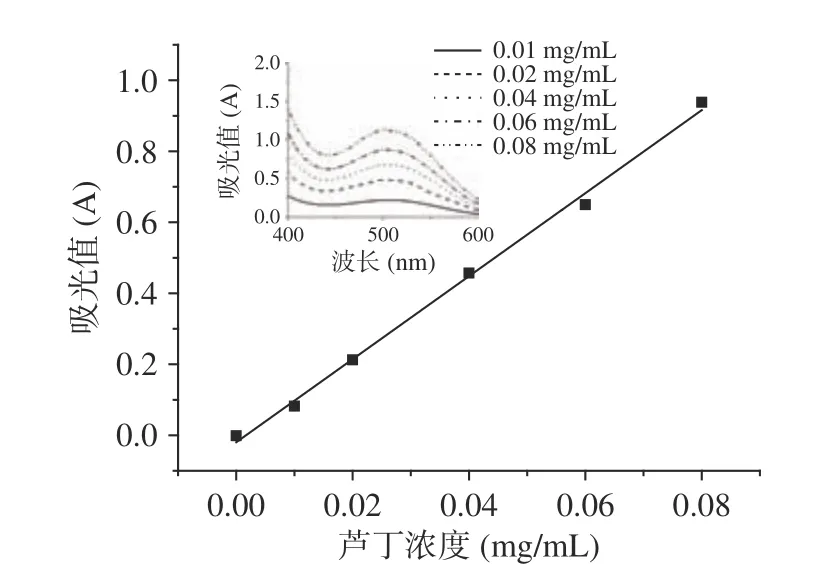
圖 1 蘆丁標準曲線Fig.1 Rutin standard curve
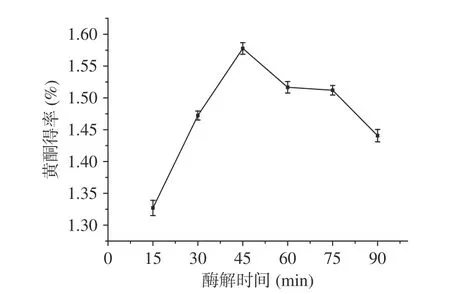
圖 2 酶解時間對百香果皮黃酮得率的影響Fig.2 Effect of enzymolysis time on the extraction yield of flavonoids from Passiflora edulis peel
2.2.2 復合酶的添加量對百香果皮黃酮得率的影響圖3是復合酶的添加量對百香果皮黃酮得率的影響。應用前期試驗結果纖維素酶與果膠酶復配比例為2:1,當其添加量為4%時,百香果皮中黃酮的得率最高。因為百香果皮中含有大量的果膠和纖維素,纖維素酶和果膠酶可以較好分解果皮的細胞壁,使得提取溶劑直接作用于活性物質,有利于黃酮的提取。繼續增加酶的添加量時黃酮得率則降低,可能原因為:當復合酶的濃度過高時,酶和部分分解的纖維素會附著在百香果皮粉的表面,阻止黃酮化合物與提取溶劑直接接觸,不利于有效成分的溶出[26]。
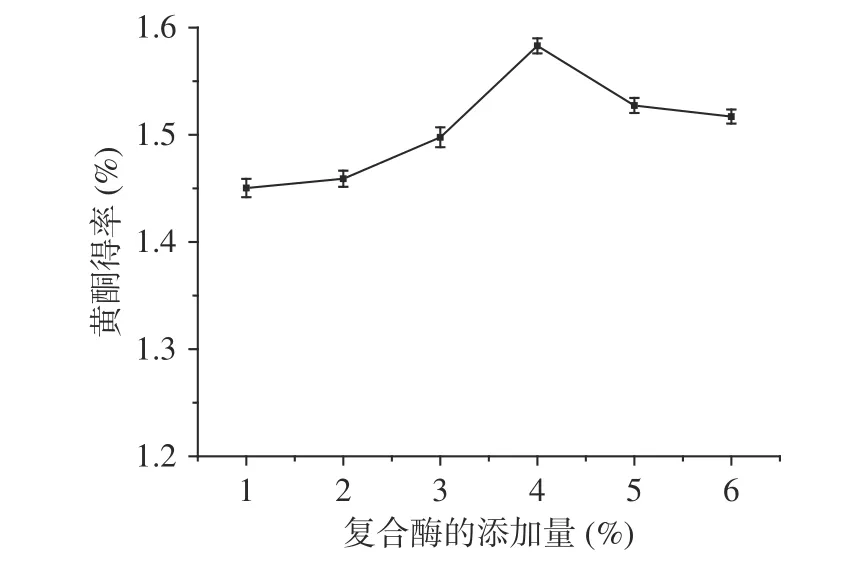
圖 3 復合酶的添加量對百香果皮黃酮得率的影響Fig.3 Effect of compound enzyme dosage on the extraction yield of flavonoids from Passiflora edulis peel
2.2.3 乙醇體積分數對百香果皮黃酮得率的影響不同體積分數的乙醇溶液對黃酮得率的影響見圖4。從圖中可以看出,乙醇體積分數在60%處黃酮得率最高,乙醇濃度在40%~60%之間時,隨著乙醇溶液濃度逐漸增大,黃酮得率逐漸提高,但當乙醇的體積分數繼續增大時,黃酮得率減少,這可能是因為,百香果皮中黃酮的極性和60%乙醇極性最接近,可以最大程度地溶出黃酮[27],當濃度繼續增大時,極性差異增大,可能會引起醇溶性物質的析出,間接導致黃酮得率的下降[17]。因此,乙醇濃度可以設定為60%。
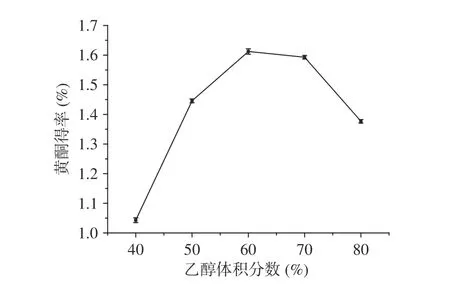
圖 4 乙醇體積分數對百香果皮黃酮得率的影響Fig.4 Effect of ethanol concentration on the extraction yield of flavonoids from Passiflora edulis peel
2.2.4 液料比對百香果皮黃酮得率的影響 液料比對百香果皮黃酮得率的影響見圖5。當液料比為25:1 mL/g時,百香果果皮黃酮得率最高。液料比在15:1~25:1 mL/g范圍內,隨著液料比的增大,百香果皮黃酮的得率不斷提高。繼續增大液料比黃酮的得率降低。原因可能是:加入的溶劑越多,果皮細胞的內外濃度差增大,溶劑的滲透擴散作用增強,溶解的黃酮化合物也就越多;但溶劑量達到一定程度時,溶解黃酮的量達到飽和狀態,溶解其他雜質的量變大,從而使得黃酮得率下降[28]。
2.2.5 超聲時間對百香果皮黃酮得率的影響 超聲時間對百香果皮黃酮得率的影響如圖6所示。由圖6可知,隨著超聲時間的延長,百香果皮中黃酮的得率逐漸提高,且在超聲45 min時黃酮得率最高為1.960%,之后隨超聲時間延長,黃酮得率下降。主要原因可能是:在提取黃酮的最開始階段,溶劑內外存在較大的濃度差,因此隨著超聲時間的增加,黃酮會迅速進入提取溶劑中,從而提高黃酮得率;但隨著超聲時間的不斷延長,樣品中其他醇溶性物質被浸提出來,導致總黃酮得率有所下降[28]。綜合考慮到時間和成本問題,最后在響應面優化試驗中,選取超聲時間為35、45、55 min三水平。
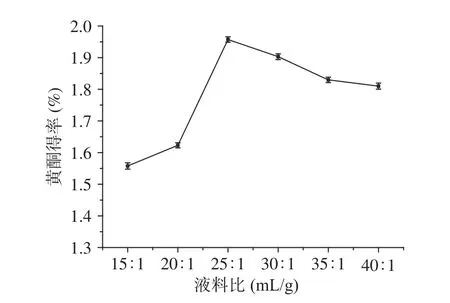
圖 5 液料比對百香果皮黃酮得率的影響Fig.5 Effect of liquid-solid ratio on the extraction yield of flavonoids from Passiflora edulis peel
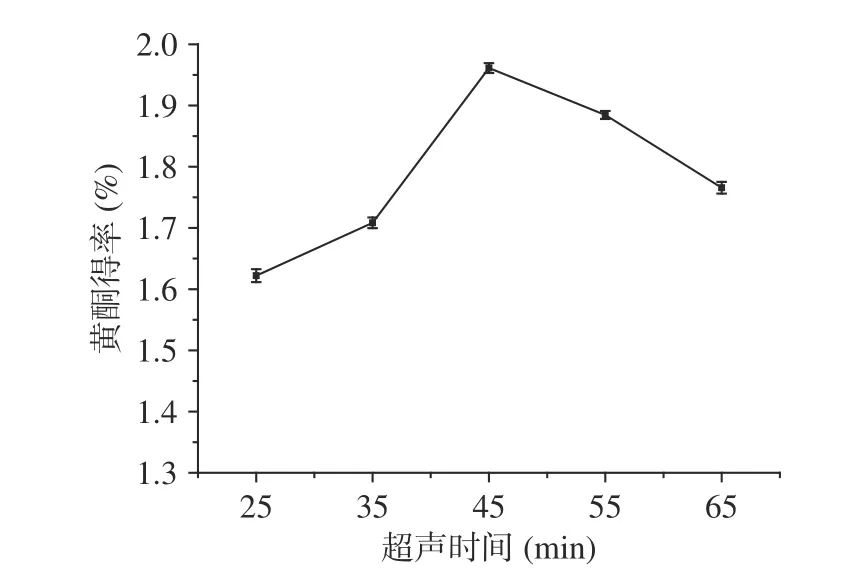
圖 6 超聲時間對百香果皮黃酮得率的影響Fig.6 Effect of ultrasonic time on the extraction yield of flavonoids from Passiflora edulis peel
2.3 響應面試驗
2.3.1 響應面設計結果及回歸模型方差分析 根據單因素實驗結果,選擇因素復合酶添加量(A)、酶解時間(B)、液料比(C)和超聲時間(D)為考察對象,百香果皮中黃酮得率(Y)為響應值(表2),采用軟件Design-expert 8對實驗數據處理后,得到二次多元回歸方程:
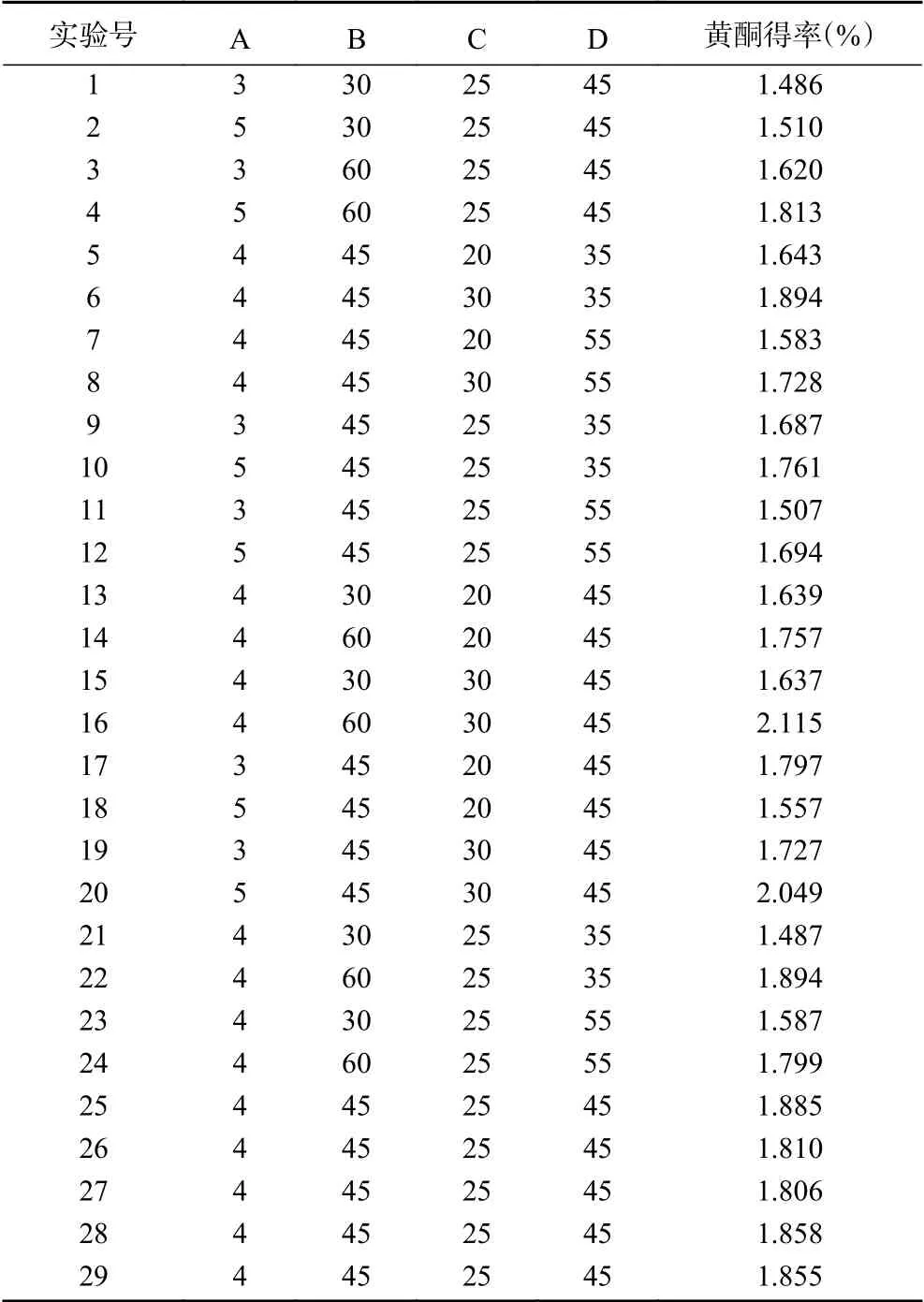
表2 響應面分析試驗及結果Table 2 Response results of Box-Behnken design

由表3可知,百香果皮黃酮得率的模型方程F值為12.84,具有顯著性(P<0.0001);失擬項差異不顯著(P失擬=0.0924>0.05),方程的決定系數R2=0.9278,大于0.8,說明該模型與試驗因素擬合較好,可以用來分析和預測百香果皮黃酮提取的工藝條件。各自變量因素對百香果皮黃酮得率的影響情況如下:一次項中酶解時間(B)和液料比(C)對黃酮得率具有極顯著的影響,交互項AC、二次項A2、B2、D2對實驗結果具有高度顯著影響(P<0.01)。F值越大,說明該因素對百香果皮中黃酮得率的影響就越大[26],故所選的四個因素對黃酮得率的影響為:酶解時間(B)>液料比(C)>酶添加量(A)>超聲時間(D)。
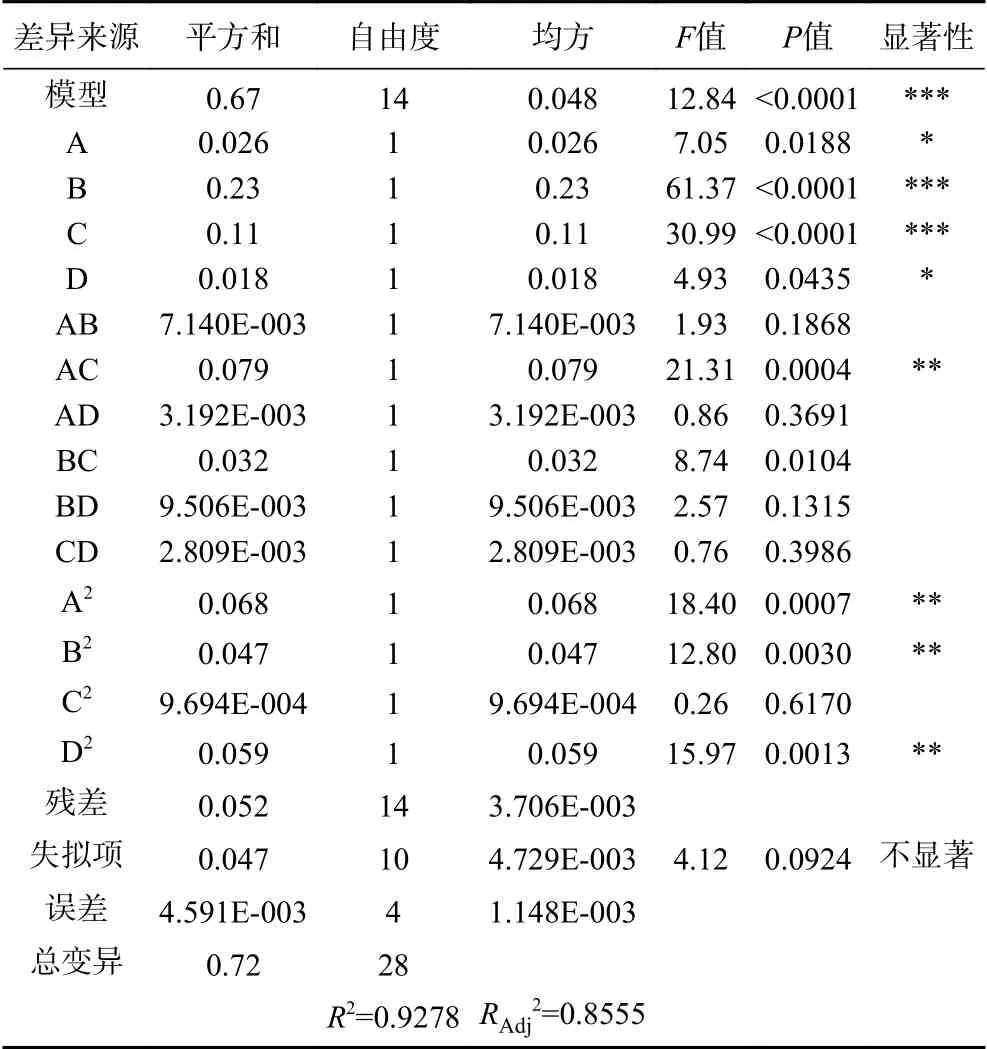
表3 響應面回歸模型方差分析Table 3 Analysis of variance of response surface regression model
各因素交互對百香果皮黃酮得率的影響見圖7。曲面越陡峭,說明百香果皮黃酮得率對該因素的改變就越敏感,反之,則說明該因素對黃酮得率影響不大;AB、AD、BD的曲面較陡峭等高線呈現橢圓形,說明酶添加量、酶解時間、超聲時間交互作用顯著[28]。由上圖可知,酶添加量與酶解時間(AB)、酶添加量與超聲時間(AD)、酶解時間與超聲時間(BD)之間的交互作用對百香果皮中黃酮的得率影響顯著;AC的響應面曲線具有顯著的陡峭曲面,說明該交互作用可以顯著地影響百香果皮黃酮的提取效果,與顯著性差異結果一致。
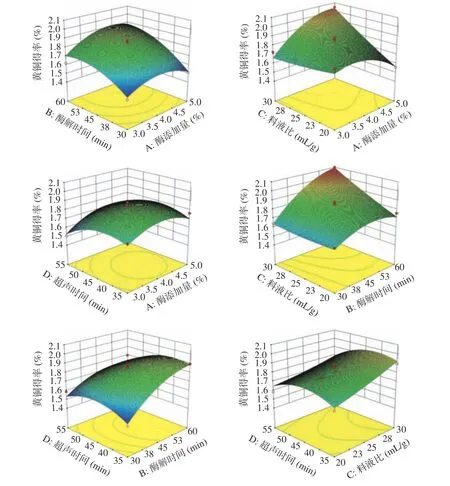
圖 7 各因素交互作用對黃酮得率影響的響應面圖Fig.7 Surface graph of the effect of interaction on the yield of flavonoids
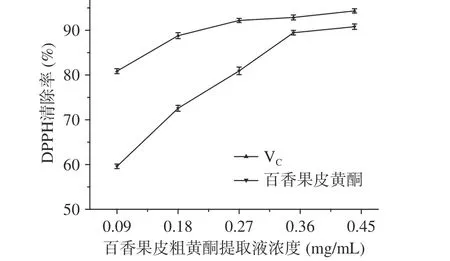
圖 8 百香果皮中粗黃酮提取液與VC對DPPH自由基的清除率Fig.8 DPPH free radical scavenging rate by flavonoids from Passiflora edulis peel and VC
為驗證響應面試驗結果是否可靠,根據得到的優化條件選擇酶添加量4.84%、酶解時間60 min、液料比30:1 mL/g、超聲時間42.12 min進行提取百香果皮總黃酮,為方便試驗,將最佳工藝調整為酶添加量4.8%、酶解時間60 min、料液比30:1 mL/g、超聲時間42 min,在此條件下進行3次平行試驗以驗證該工藝的可行性。結果表明,在所得最佳工藝條件下,百香果皮黃酮得率可達(2.20%±0.05%),此結果與模型預測值2.24%相當(<1%),模型重復性較好,說明該優化的工藝參數具有可靠性。
2.4 百香果皮中黃酮抗氧化活性
2.4.1 清除DPPH自由基能力 圖8是百香果皮中的黃酮與VC對DPPH自由基清除率的對照圖,從圖中可以看出,在0.09~0.44 mg/mL的濃度范圍內,隨著提取液濃度的增加,DPPH自由基的清除率也在不斷提高,當黃酮粗提取液濃度為0.44 mg/mL時,有最大的清除率為90.8%。與相同濃度的抗壞血酸相比較,黃酮的清除率較小于抗壞血酸的清除率,但從數據的趨勢來看,最大黃酮濃度時的清除率與抗壞血酸的清除率比較接近。說明了百香果皮中的黃酮粗提取液對DPPH自由基具有較強的抗氧化作用[23]。
2.4.2 清除羥基自由基能力 圖9為百香果皮黃酮提取液對羥基自由基的清除率的影響,從圖中可以看出,黃酮提取液的濃度不斷提高,其對羥基自由基的清除率也逐漸增強,當黃酮粗提取液濃度為44 μg/mL時,有最大的清除率為84.1%。用抗壞血酸做對照,可以看到相同濃度下黃酮粗提取液對羥基自由基的清除效果略低于VC溶液。
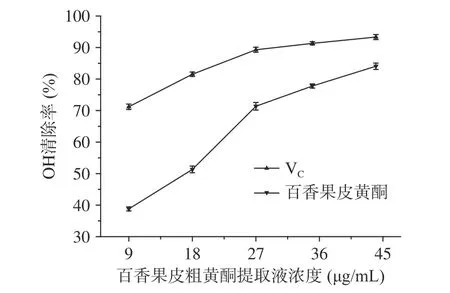
圖 9 百香果皮中黃酮與VC對OH自由基的清除率Fig.9 OH free radical scavenging rate by flavonoids from Passiflora edulis peel and VC
3 結論
本文采用復合酶輔助超聲波法,設計單因素實驗及響應面法優化百香果皮總黃酮的提取工藝,建立了黃酮得率的模擬回歸方程,且模型擬合程度較好。得到最佳工藝參數:復合酶(纖維素酶與果膠酶復配比例為2:1)的用量4.8%、酶解時間1 h、乙醇的體積分數60%、液料比30:1 mL/g、超聲時間42 min。在此條件下總黃酮得率達到達到(2.20%±0.05%),回歸模型的實測值與預測值2.24%(<1%)接近,模型可靠,該結果可為加快百香果皮開發與利用提供一種高效、節能、安全的提取黃酮的工藝參考。
體外抗氧化活性研究表明百香果皮總黃酮具有較高的抗氧化活性,并且其抗氧化能力與濃度呈正向線性關系。當百香果皮中黃酮濃度為0.44 mg/mL時,對DPPH自由基的清除率可達到90.8%;當百香果皮黃酮濃度為44 μg/mL時,對OH自由基的清除率可達到84.1%。試驗結果證明了百香果皮中黃酮具有較強的抗氧化能力,是一種理想的天然抗氧化劑。

