基于線粒體Cytb基因序列的山瑞鱉 保種群體遺傳多樣性分析
黃松茂 趙玉姣 張銘梟 劉霄 姚創(chuàng) 孔令富 武祥偉


摘要:為研究云南地區(qū)山瑞鱉(Palea steindachneri)保種群體遺傳多樣性和遺傳結構。該研究基于線粒體細胞色素b(Cytb)基因,利用PCR擴增和測序技術,分析了2個云南地區(qū)山瑞鱉保種群體的單倍型分布情況、遺傳距離、遺傳結構和群體歷史動態(tài)等,擴增得到F3代群體和F4代群體共45個個體的線粒體Cytb基因序列。用DNAStar和MEGA軟件剪切校對后序列長度為1000bp,堿基A、T、C和G的平均含量分別為31.28%、27.19%、30.18%和11.35%。在兩個群體中共檢測到9種單倍型,其中F3代群體有7種單倍型,F(xiàn)4代群體有3種單倍型,單倍型間沒有明顯的譜系結構,親緣關系較近。兩個群體內(nèi)遺傳背景單一,個體間平均遺傳距離較小,隨著保種代數(shù)的增加群體的遺傳多樣性水平也在逐漸降低,近交現(xiàn)象明顯。中性檢驗和核苷酸歧點分布圖顯示,F(xiàn)3代群體和F4代群體歷史上可能經(jīng)歷過擴張。研究結果表明,該保種群體的群體內(nèi)遺傳多樣性較低,在今后的保種過程中應采取不同的保種策略,避免近親繁殖。
關鍵詞:山瑞鱉;Cytb基因;保種群體;遺傳多樣性;遺傳結構
中圖分類號:Q343.2;S968.3文獻標志碼:A
山瑞鱉(Palea steindachneri),隸屬于龜鱉目(Testudines)、鱉科(Trionychidae)、山瑞鱉屬(Palea)[1],保護等級為國家二級保護動物,在中國分布范圍不廣,云南省是山瑞鱉的主要棲息分布地之一。山瑞鱉形態(tài)與中華鱉(Pelodiscus sinensis)相似,個體較中華鱉大且生長快,性格比較溫順,屬于亞熱帶鱉類,有較高的藥用價值[2],早些年人為捕撈對山瑞鱉種群結構破壞較大。再加上近年來修建水利工程等活動嚴重破壞了山瑞鱉原有的棲息地,使其在自然界的競爭中處于劣勢狀態(tài),現(xiàn)在野外環(huán)境下已很難覓其蹤跡。云南省野生山瑞鱉的資源量嚴重下降,保護山瑞鱉現(xiàn)有種群,恢復山瑞鱉自然種群結構已刻不容緩。
有關山瑞鱉的研究主要集中在生物學、馴化養(yǎng)殖和人工繁育等方面[3],分子水平的研究主要是對其親緣關系和系統(tǒng)學地位進行鑒定[4]。作為珍稀瀕危保護動物,關于云南地區(qū)山瑞鱉群體的遺傳多樣性研究還未有人報道。該研究團隊自2008年開始搜集云南山瑞鱉野生群體,以自然繁殖的方式進行人工保種,隨著人工保種年限的增長,本研究團隊發(fā)現(xiàn)保種后代的繁殖性狀出現(xiàn)明顯的衰退,主要表現(xiàn)在受精率降低、受精后孵化率減小且孵化出膜后幼體存活率低,初步推測是由于親本的遺傳多樣性低,親緣關系近,可能存在近交衰退現(xiàn)象。因此,了解山瑞鱉保種群體的遺傳多樣性和遺傳結構,有助于為山瑞鱉制定科學的保種方式,制定不同的繁殖策略,防止種質資源退化。本研究采用線粒體細胞色素b(Cytb)基因作為分子標記,利用PCR和測序技術獲得2個山瑞鱉群體樣本的線粒體Cytb基因序列,通過序列比對、系統(tǒng)進化樹構建和群體遺傳結構分析等,對云南地區(qū)山瑞鱉保種群體的遺傳多樣性和遺傳結構進行了初步研究。克服了形態(tài)特征鑒別困難、受環(huán)境影響變化較大的缺陷,可以更準確地梳理群體的系統(tǒng)進化關系,為云南地區(qū)山瑞鱉持續(xù)保種提供科學依據(jù)。
1 材料和方法
1.1 試驗材料與總DNA提取
實驗所用山瑞鱉樣本為云南地區(qū)人工馴化養(yǎng)殖群體。其中F3代群體12只,F(xiàn)4代群體33只,剪取少量裙邊組織保存于95%酒精中備用。總DNA提取參照常規(guī)的酚-氯仿[5]方法進行提取。使用1%瓊脂糖凝膠電泳檢測DNA質量,并采用超微量分光光度計(NP80Touch)測定DNA的濃度,于-20℃保存待用。
1.2 線粒體Cytb基因序列擴增
使用已發(fā)表文獻中的山瑞鱉線粒體Cytb基因擴增引物,引物序列為turtle-cytb-F1:GGACTYTAACCAAGACCAATG和turtle-cytb-R1:TCAATCTTTGGTTTACAAGAC[6],引物由上海生物工程有限公司(Sangon)合成。PCR反應體系總體積為20μL,其中12.6μL超純水,2.5μL10×PCR buffer,dNTP Mixture(2.5mM each)1.5μL,上、下游引物(10 μmoL /L)各0.5μL,Taq DNA聚合酶(5U/μL)0.4μL、DNA模板2μL。PCR反應程序為95℃預變性5min;95℃變性1min,52℃退火40s,72℃延伸1min,35個循環(huán);最后72℃充分延伸10mins,4℃保存。取5μL PCR擴增產(chǎn)物用1%瓊脂糖凝膠電泳檢測,選擇電泳條帶清晰的PCR產(chǎn)物直接委托北京擎科生物科技有限公司昆明分公司進行雙向測序。
1.3 數(shù)據(jù)統(tǒng)計與分析
Cytb基因序列測序結果使用DNAStar[7]軟件包中的SeqMan程序先對測序結果的ab1文件手動剪切首尾兩端不準確的序列,之后對正反引物序列進行比對拼接,并對拼接結果檢查校正。使用MEGA10.1.8[8]中的clustalw(參數(shù)為默認參數(shù))對齊序列,計算序列的堿基組成、變異位點和遺傳距離等,并構建單倍型最大似然樹(參數(shù)為:使用bootstrap method算法,檢驗次數(shù)為500次,遺傳距離計算使用Kimura 2-parameter model,插入/缺失堿基處理方式為partial deletion50%)等。對齊后的序列用DnaSP6.12.03[9]軟件分析群體的單倍型數(shù)目、單倍型分布、單倍型多樣性指數(shù)和核苷酸多樣度等,并繪制核苷酸歧點分布圖,使用gengrate程序生成單倍型信息文件用于Network10.2.0.0[10]軟件繪制單倍型網(wǎng)絡圖,分析單倍型之間的進化關系。利用Arlequin3.5[11]軟件進行群體分子方差分析(AMOVA),計算群體內(nèi)和群體間的自由度、方差總和、變異組分和變異貢獻率以及Tajima's D[12]和Fu's Fs[13]中性檢驗,結合核苷酸歧點分布圖檢測群體內(nèi)和群體之間的遺傳分化和群體歷史擴張等。4C1F193C-5322-4D34-A264-0695750EB7AF
2 結果與分析
2.1 山瑞鱉Cytb基因堿基組成和變異分析
經(jīng)對齊校對獲得2個群體45條山瑞鱉Cytb基因序列,序列長度為1000bp。序列中四種堿基A、T、C和G的平均含量分別為31.28%、27.19%、30.18%和11.35%,堿基A+T的含量(58.47%)高于G+C的含量(41.53%)。在密碼子第1位表現(xiàn)出了對堿基A和C的偏好性,使用頻率分別為45.0%和37.5%。在密碼子第2位,堿基T的使用頻率(40.2%)最高,分別是A和C的2.0倍和1.5倍,更是G的3.0倍。而在密碼子第3位上,四種堿基使用頻率的差別不大(表1)。在這1000bp 序列中,共檢測到9個多態(tài)位點,占分析位點總數(shù)的0.90%。其中5個為單一多態(tài)位點,4個為簡約信息位點。
2.2單倍型分布情況和遺傳多樣性分析
45個個體共檢測到9種單倍型(表2),編號為Hap_1~Hap_9。單倍型Hap_1出現(xiàn)頻率最高(82.22%),分布于F3代群體和F4代群體,其余單倍型均為某個群體的個體特有,F(xiàn)3代群體共有(Hap_1~ Hap_7)7種單倍型,F(xiàn)4代群體(Hap_1、Hap_8和Hap_9)有3種。使用Network做出單倍型的網(wǎng)狀關系圖發(fā)現(xiàn),單倍型Hap_4位于所有單倍型的中間,其他單倍型都是從單倍型Hap_4分化出去的,從單倍型Hap_4分化出單倍型Hap_8再分化出最大的單倍型Hap_1。單倍型Hap_2、Hap_3、Hap_4和Hap_8聯(lián)系密切,從單倍型Hap_4分化出單倍型Hap_5和單倍型Hap_7,再由Hap_5分化出單倍型Hap_9(圖1)。
基于2個山瑞鱉群體Cytb基因單倍型構建的最大似然樹特點可以看出,2個群體體明顯形成了2大分支,單倍型Hap_7單獨聚為一支,單倍型Hap_1、Hap_6和Hap_8聚為一支,單倍型Hap_2、Hap_3和Hap_4聚為一支,單倍型Hap_5和Hap_9聚為一支,F(xiàn)4代群體單倍型與F3代之間沒有明顯的分化(圖2)。結合單倍型的網(wǎng)狀關系圖可以看出,雖然單倍型Hap_7單獨聚為一支,但是這種單倍型還是由單倍型Hap_4分化出去的,兩個群體不存在明顯的譜系結構。
2.3 群體遺傳多樣性
根據(jù)山瑞鱉2個群體的遺傳多樣性參數(shù)可以看出,在單倍型參數(shù)中,F(xiàn)3代群體的單倍型數(shù)量(12)和單倍型多樣性(0.773)最高,F(xiàn)4代群體的單倍型多樣性(0.119)較低;核苷酸多樣性參數(shù)表明,F(xiàn)3代群體的核苷酸多樣性為0.00184,遺傳多樣性比F4代群體(0.00042)高(表3),F(xiàn)4代群體可能出現(xiàn)了退化;兩個群體都表現(xiàn)出了高單倍型多樣性和低核苷酸多樣性的特點。
F3代群體個體間的平均遺傳距離為0.00183,F(xiàn)4代群體個體間的平均遺傳距離為0.00042,F(xiàn)3代群體的遺傳多樣性比F4代群體高,F(xiàn)3代群體與F4代群體的群體間遺傳距離為0.00138(表4),表明群體內(nèi)、群體間遺傳距離較小,親緣關系較近。
2.4遺傳結構和群體歷史動態(tài)
山瑞鱉群體AMOVA分析結果表明,群體間自由度為1,群體內(nèi)自由度為43,群體間方差總和(2.923)較群體內(nèi)(16.811)小,群體內(nèi)的變異組分(0.39094 Vb)和變異貢獻率(73.10%)較群體間的變異組分(0.14385 Va)和變異貢獻率(26.90%)高(表5)。表明變異來源主要在群體內(nèi),群體間差異不大,兩個群體親緣關系較近。
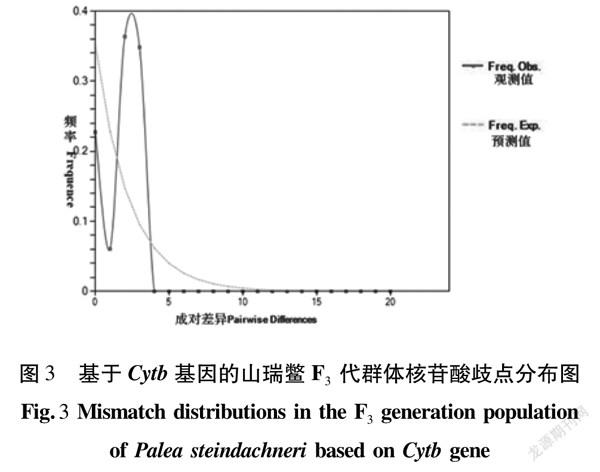
基于山瑞鱉Cytb基因單倍型對兩個群體分別進行中性檢驗,檢驗顯示Tajima′s D test和Fu′s Fs test均為負值(表6),F(xiàn)4代群體Tajima′s D test和F3代群體Fu′s Fs test差異顯著(P<0.05),F(xiàn)3代群體Tajima′s D test和F4代群體Fu′s Fs test差異不顯著(P>0.05)。核苷酸歧點分布圖表明,F(xiàn)3代和F4代群體核苷酸歧點分布圖為單峰(圖3,圖4)。結果表明,這個山瑞鱉群體歷史上可能發(fā)生過擴張。
3 討論
3.1 山瑞鱉群體遺傳多樣性分析
在自然群體中保持了大量的遺傳變異,在DNA水平上關于這種變異的信息可以從核苷酸之間的差異獲得[12]。線粒體堿基對替換率不受母系遺傳和營養(yǎng)分離,在涉及短時間跨度的進化研究中更有用[14]。本研究獲得了45條山瑞鱉線粒體Cytb基因同源序列(1000bp),序列中四種堿基T(27.19%)、A(31.28%)、G(11.35%)和C(30.18%)的平均含量堿基C含量最低,與李小三[4]得到的山瑞鱉線粒體Cytb基因序列四種堿基平均含量相似,驗證了山瑞鱉Cytb基因堿基分布情況。山瑞鱉Cytb基因序列堿基組成C+G含量較A+T低、具有明顯的反G偏移等特點在中華鱉[15]和太湖大銀魚[16]中也有類似體現(xiàn),與大部分水產(chǎn)動物Cytb基因序列特征一致。群體內(nèi)突變位點占比小(0.90%),個體間變異較小,親緣關系較近。
遺傳多樣性是生物多樣性的形式之一,群體遺傳多樣性是反映群體適應性的重要指標[17]。線粒體基因組(mitochondria DNA,mt DNA)是真核細胞的第二遺傳系統(tǒng),動物線粒體基因由15-20kb的雙鏈環(huán)狀DNA分子構成,具有進化速率快、母系遺傳、無組織特異性和序列差異在群體中的個體間存在等遺傳特點,現(xiàn)已成為研究種內(nèi)、種間遺傳多樣性的重要依據(jù)[18,19]。Cytb基因是線粒體基因組的13個開放閱讀框之一,在進化上較為保守,在水產(chǎn)動物上通常被用于分子進化和遺傳多樣性的研究。從研究結果來看2個群體都表現(xiàn)出了高單倍型多樣性和低核苷酸多樣性的特點,說明該群體可能經(jīng)歷過快速的群體增長和突變[20]。F3代群體(0.00184)和F4代代群體(0.00042)的核苷酸多樣性均在0.0015~0.0047之間,表明這2個群體的遺傳多樣性處于較低水平,群體內(nèi)遺傳變異較小[21]。但F3代群體的單倍型多樣性和核苷酸多樣性較F4代群體高,F(xiàn)3代群體的遺傳多樣性較F4代豐富,群體內(nèi)平均遺傳距離也較F4代高得多,F(xiàn)4代群體可能在保種過程中出現(xiàn)了種質資源退化。兩個群體整體核苷酸多樣性為0.00090,群體間平均遺傳距離(0.00138)較低。綜上所述,兩個群體的親緣關系較近,保種過程中群體內(nèi)的變異逐漸減小,遺傳距離隨著保種年限的增加越來越小,在今后的保種過程中要根據(jù)親本的親緣關系制定繁殖策略,盡可能使雌雄搭配合理,避免近親繁殖。4C1F193C-5322-4D34-A264-0695750EB7AF
3.2 山瑞鱉群體遺傳結構分析
種群遺傳結構的研究有助于評估不同的種群的進化軌跡,或在多大程度上保持了基因流的聯(lián)系,是了解物種進化的先決條件[22]。山瑞鱉2個群體中共存在9種單倍型,其中F3代群體有7種單倍型,F(xiàn)4代群體有3種單倍型,兩個群體間共享單倍型僅有Hap_1,除了單倍型Hap_1有較多個體外,其余單倍型均只有1個個體,說明個體間同源性較高。從單倍型網(wǎng)狀關系圖可以看出,Hap_4單倍型可能為兩個群體的祖先單倍型,群體間不存在明顯的遺傳分化。根據(jù)進化樹推斷,F(xiàn)4代群體中的單倍型Hap_5和Hap_9親緣關系較近,單倍型Hap_1和Hap_8與Hap_6親緣關系較近,在繁殖過程中應盡量避免各單倍型內(nèi)的個體間交配,進化樹結果也與單倍型網(wǎng)狀關系圖中這些單倍型的聯(lián)系相對應。后續(xù)應理清所有用于人工保種群體個體間的遺傳關系,根據(jù)每個群體內(nèi)的遺傳距離和遺傳結構制定繁殖策略,提高后代群體的遺傳多樣性。
3.3 群體動態(tài)分析
群體中多態(tài)性的模式不僅受到突變和隨機漂移的影響,還受到自然選擇的影響,遺傳分化系數(shù)的引入為研究種群結構提供了一種方便的方法[23]。該研究山瑞鱉群體AMOVA分析結果顯示,該保種群體的變異來源主要來自群體內(nèi),群體間變異貢獻率為26.90%。中性檢驗結果顯示,兩個群體的Tajima′s D值和Fu′s Fs均為負值,說明這個山瑞鱉保種群體存在大量的低頻等位基因位點,古代群體可能經(jīng)歷過擴張。據(jù)李大命[24]等對個體間堿基不配對分布曲線的解釋,在山瑞鱉兩個保種群體中,核苷酸歧點分布圖為單峰,F(xiàn)3代群體和F4代群體歷史上可能發(fā)生過擴張,與中性檢驗結果相符。
群體遺傳多樣性水平反映了其在自然界的生存能力和進化潛力。根據(jù)研究結果可以看出,山瑞鱉兩個保種群體內(nèi)的遺傳多樣性較低,親緣關系較近,群體遺傳多樣性水平退化明顯。在接下來的保種過程中應采取不同的保種策略,盡量避免近親交配,利用分子生物技術的方法輔助保種,進而保護云南土著龜鱉種質資源,為山瑞鱉人工保種和保護云南生物多樣性提供科學依據(jù)。
參考文獻:
[1]王剴,任金龍,陳宏滿,等. 中國兩棲、爬行動物更新名錄[J]. 生物多樣性,2020,28(02): 189-218.
[2]鄭文彪,粱淡茹,肖智,等. 山瑞鱉與中華鱉的養(yǎng)殖生長和形態(tài)比較[J]. 淡水漁業(yè),1998,28(01):40-41.
[3]唐大由,李貴生,李海. 山瑞鱉的生物學特性及人工養(yǎng)殖技術[J]. 中藥材,1997,20(04):168-171.
[4]李小三,汪玲,周科,等. 基于線粒體Cytb基因全序列探討兩爪鱉和山瑞鱉的系統(tǒng)進化關系[J]. 生命科學研究,2010,14(05):413-418.
[5]SAMBROOK J, FRITSCH E P, MANIATIS T. Molecular Cloning: A Laboratory Manual [M]. Beijing: Science Press, 1996.
[6]陳合格,劉文彬,李建中,等. 三種鱉線粒體DNA細胞色素b基因序列的比較分析[J]. 水生生物學報,2006,30(04):380-385.
[7]BURLAND T G. DNASTAR′s Lasergene sequence analysis software[M]//Bioinformatics methods and protocols. Humana Press, Totowa, NJ, 2000: 71-91.
[8]KUMAR S, STECHER G, LI M, et al. MEGA X: molecular evolutionary genetics analysis across computing platforms[J]. Molecular biology and evolution, 2018, 35(6): 547-1549.
[9]ROZAS J, FERRER-MATA A, SANCHEZ-DELBARRIO J C, et al. DnaSP 6: DNA sequence polymorphism analysis of large data sets[J]. Molecular biology and evolution, 2017, 34(12): 3299-3302.
[10]FORSTER P, TOTH A, BANDELT H J. Evolutionary network analysis of word lists: Visualising the relationships between Alpine Romance languages[J]. Journal of Quantitative Linguistics, 1998, 5(3): 174-187.
[11]EXCOFFIER L, LISCHER H E L. Arlequin suite ver 3.5: a new series of programs to perform population genetics analyses under Linux and Windows[J]. Molecular ecology resources, 2010, 10(3): 564-567.
[12]TAJIMA F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics, 1989, 123(3): 585-595.4C1F193C-5322-4D34-A264-0695750EB7AF
[13]FU Y X, LI W H. Statistical tests of neutrality of mutations[J]. Genetics, 1993, 133(3): 693-709.
[14]BIRKY JR C W, MARUYAMA T, FUERST P. An approach to population and evolutionary genetic theory for genes in mitochondria and chloroplasts, and some results[J]. Genetics, 1983, 103(3): 513-527.
[15]張卉琴,陳志男,李戈銳,等.漢壽中華鱉線粒體細胞色素b基因克隆及其遺傳多樣性分析[J].激光生物學報,2018,27(04):359-366.
[16]李大命,張彤晴,唐晟凱,等. 太湖大銀魚(Protosalanx chinensis)細胞色素b基因序列多態(tài)性分析[J].江蘇農(nóng)業(yè)學報,2015,31(4):840-845.
[17]REED D H, FRANKHAM R. Correlation between Fitness and Genetic Diversity[J]. Conservation Biology, 2003, 17(1):230-237.
[18]廖順堯,魯成. 動物線粒體基因組研究進展[J]. 生物化學與生物物理進展,2000,27(05):508-512.
[19]閆華超,高嵐. 線粒體DNA遺傳特性的研究新進展[J]. 生物技術,2003,13(06):63-65.
[20]GRANT W A S, BOWEN B W. Shallow population histories in deep evolutionary lineages of marine fishes: insights from sardines and anchovies and lessons for conservation[J]. Journal of heredity, 1998, 89(5): 415-426.
[21]LAN H, SHI L. The origin and genetic differentiation of native breeds of pigs in southwest China: an approach from mitochondrial DNA polymorphism[J]. Biochemical genetics, 1993, 31(1): 51-60.
[22]DUMINIL J, FINESCHI S, HAMPE A, et al. Can population genetic structure be predicted from life-history traits?[J]. The American Naturalist, 2007, 169(5): 662-672.
[23]WEIR B S. Estimating F-statistics: A historical view[J]. Philosophy of science, 2012, 79(5): 637-643.
[24]李大命,張彤晴,唐晟凱,等. 洪澤湖野生河蜆(Corbicula fluminea)線粒體CO Ⅰ基因序列的遺傳多樣性分析[J]. 漁業(yè)科學進展,2015,36(05):81-86.
Genetic diversity analysis of Palea steindachneri conservation populations based on mitochondrial Cytb gene sequence
Abstract: To study the genetic diversity and genetic structure of Palea steindachneri conserved populations in Yunnan. In this study, we analyzed the haplotype distribution, genetic distance, genetic structure and population history dynamics of two populations of Palea steindachneri conserved in Yunnan, based on the mitochondrial cytochrome b(Cytb) gene, using PCR amplification and sequencing techniques, and amplified the mitochondrial Cytb gene sequences of 45 individuals from the F3 and F4 generation populations. The sequence length was 1000 bp after cut and aligned with DNAStar and MEGA software, and the average contents of bases A, T, C and G were 31.28%, 27.19%, 30.18% and 11.35%, respectively. A total of nine haplotypes were detected in the two populations, including seven haplotypes in the F3 generation population and three haplotypes in the F4 generation population, with no obvious genealogical structure between haplotypes and close kinship. The genetic background within the two populations was single, and the average genetic distance between individuals was small. The genetic diversity level of the populations was gradually decreasing with the increase of the number of conserved generations, and the inbreeding phenomenon was obvious. The neutrality test and nucleotide manifold distribution maps indicated that the F3 and F4 populations may have undergone expansion historically. The results indicated that the conserved population had low intra-population genetic diversity, and different conservation strategies should be adopted to avoid inbreeding in the future conservation process.
Key words: Palea steindachneri; Cytb gene; conservation population; genetic diversity; genetic structure
文章編號:16742419(2022)03000307
基金項目:國家自然科學基金(32060827)資助 [Supported by National Natural Science Fund(32060827)]。
作者簡介:黃松茂(1997-),男,云南農(nóng)業(yè)大學動物科學技術學院在讀碩士研究生,主要從事水產(chǎn)動物養(yǎng)殖與繁育研究。E-mail:2359282510@qq.com。
通信作者:孔令富(1975-),男,云南昭通人,碩士,云南農(nóng)業(yè)大學副教授。研究方向:水產(chǎn)種質資源保護與利用。E-mail:wzlklf@sina.com;武祥偉(1984-),男,山東菏澤人,博士,云南農(nóng)業(yè)大學講師。研究方向:云南土著魚類種質資源保護與利用。E-mail:wxw9559@126.com。4C1F193C-5322-4D34-A264-0695750EB7AF

