組蛋白修飾在水稻中的研究進展
楊濤, 馬小倩, 張全, 張洪亮
(中國農業大學農學院,北京 100019)
表觀遺傳是指生物體內不依賴于DNA序列改變、可穩定遺傳的變異,主要包括DNA甲基化、染色質重塑、基因組印記、非編碼RNA以及組蛋白修飾等多種類型[1]。
在真核生物中,DNA纏繞在組蛋白八聚體(由2個拷貝的組蛋白H2A、H2B形成的異源四聚體與H3、H4形成的四聚體組裝而成)形成核小體[2],這些纏繞著DNA的核小體經過復雜的空間折疊形成染色質。很多組蛋白基團可被翻譯后修飾,組蛋白上各種各樣的共價修飾在某些特定條件會發生動態變化,造成核小體和DNA的纏繞狀態發生改變,進一步影響基因的表達水平[3]。
水稻作為世界上重要的糧食作物之一,也是禾谷類單子葉植物分子生物學研究的理想模式植物。研究水稻產量、品質以及抗逆性等重要性狀的調控機制對提高水稻產量和品質具有重要意義。伴隨著高通量測序的發展,表觀遺傳尤其是DNA甲基化及組蛋白修飾在水稻中對于生長發育、重要農藝性狀、抗逆性等方面的研究取得了一系列重要進展。目前,關于組蛋白修飾在高等植物,特別是在重要農作物的研究熱度呈持續上升趨勢,本文詳細剖析了組蛋白修飾在水稻中的研究進展,以期為現代農業生產中作物產量和品質的遺傳改良、抗逆育種以及種質創新等相關研究提供理論參考。
1 組蛋白修飾類型
組蛋白的共價修飾主要發生在核小體的N端末端,近年來隨著檢測技術的進一步成熟,發現組蛋白的中間肽段位置以及C端也會被特異性修飾,這些修飾可以是甲基化、乙酰化、磷酸化、泛素化、核糖基化、SUMO(small ubiquitin-like modifier)修飾等,且不同的蛋白酶類控制不同位點的組蛋白修飾[4]。目前水稻組蛋白修飾研究較多的是甲基化和乙酰化。
1.1 組蛋白甲基化修飾
組蛋白甲基化可以作用在精氨酸和賴氨酸2個位點上。其中,精氨酸殘基可以被單甲基化或雙甲基化,雙甲基化按照發生共價修飾的位置又包括對稱性甲基化和非對稱性甲基化;而賴氨酸殘基可以發生單甲基化(me1)、雙甲基化(me2)以及三甲基化(me3)[5]。組蛋白不同位點的賴氨酸或精氨酸發生不同水平的甲基化修飾程度,豐富了組蛋白甲基化修飾參與轉錄調控的類型。組蛋白甲基轉移酶將S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)上的甲基轉移到組蛋白賴氨酸或精氨酸位點上以完成對組蛋白的甲基化修飾。組蛋白甲基化對于下游基因的轉錄水平既可以與RNA聚合酶協同作用來激活轉錄,又可以維持異染色質上基因的轉錄抑制[6-7]。
1.1.1 組蛋白賴氨酸甲基化修飾 組蛋白賴氨酸甲基化轉移酶(histone lysine methyltransferase)負責催化賴氨酸的甲基化修飾。大部分組蛋白賴氨酸甲基化轉移酶包含SET(Su,enhancer of zeste,and trithorax)結構域,也有部分KMTs包含DOT1L(disruptor of telomeric silencing 1 like)結構域[8]。組蛋白賴氨酸甲基化發生的位點包括組蛋白H3第4位(H3K4)、第9位(H3K9)、第27位(H3K27)、第36位(H3K36)、第79位(H3K79)及組蛋白H4第20位(H4K20)等[9]。
擬南芥中已發現可催化H3K4甲基化的蛋白,包括銅伴侶蛋白ATX等。除催化H3K4發生甲基化的酶外,還有一些酶催化H3K4發生去甲基化,這些酶被稱為H3K4去甲基化酶。目前,發現組蛋白賴氨酸特異性去甲基化酶1(lysine specific demethylase,LSD1)和某些 JMJ類的蛋白酶(含有JmjC結構域)具有H3K4去甲基化活性[10-11]。H3K4甲基化一般與基因的轉錄激活有關,其中,組蛋白H3第4位賴氨酸三甲基化(H3K4me3)最為重要,植物中大約有40%基因被H3K4me3修飾[12]。
水稻中共發現12個SET結構域蛋白家族(SET domain group,SDG),其中SDG710、SDG714和SDG727蛋白具有H3K9me2和H3K9me3甲基轉移酶活性[13]。啟動子區的H3K9me3通常與基因沉默有關[14]。
EZH2(enhancer of zeste homolog 2)是催化H3K27發生甲基化修飾的主要蛋白,其在發揮催化作用時需要形成多梳蛋白復合物PRC2(polycomb repressive complex 2)。H3K27甲基化使得組蛋白更加緊密,從而抑制基因的表達。此外,多梳蛋白復合物PRC1能夠對H3K27甲基化修飾區域造成的基因沉默起維持作用[15]。
1.1.2 組蛋白精氨酸甲基化修飾 蛋白質精氨酸甲基化酶負責將S-腺苷甲硫氨酸SAM的甲基轉移到組蛋白精氨酸位點的胍基上[16]。蛋白質精氨酸甲基化包括以下3種形式:精氨酸單甲基化(ω-NG-mono-methylarginine,MMA)、非對稱精氨酸二甲基化(ω-NG,NG-asymmetric methylarginine,aDMA)和對稱精氨酸二甲基化(ω-NG,NG-symmetric methylarginine,sDMA)。催化蛋白質發生精氨酸修飾的精氨酸甲基酶按照催化形式可以分為2種類型:蛋白質精氨酸甲基轉移酶(protein arginine methyltransferase,PRMT)家 族 中 的 PRMT1、PRMT2、PRMT3、PRMT4、PRMT6和 PRMT8可催化形成單甲基化和非對稱性二甲基化,屬于第一類精氨酸甲基化酶;PRMT5、PRMT7和PRMT9可催化形成單甲基化和對稱性二甲基化,屬于第二類精氨酸甲基化酶[17-18]。在已發現的酶中,除了PRMT3、PRMT8和PRMT9外,精氨酸甲基轉移酶均可以作用于組蛋白。
精氨酸殘基的翻譯后甲基化影響基因的表達,對許多細胞生物學過程具有調控作用,如信號轉導、mRNA剪接和轉錄調控等[19-20]。擬南芥中AtPRMT5缺失導致多效性表型,包括開花延遲、生長遲緩、葉色變深綠、葉片卷曲及對春化的敏感性降低等,由此表明,AtPRMT5在擬南芥的基本發育過程中發揮重要的調控作用[21-23]。在atprmt5突變體中,由于KRP(kip-related proteins)基因啟動子組蛋白H4R3甲基化減少造成KRP轉錄水平升高,導致芽的再生速率降低[24]。水稻中鑒定到8個編碼蛋白精氨酸甲基轉移酶(OsPRMTs)的基因,這些基因的編碼蛋白在水稻不同組織中呈現不同的表達模式,如GFP標記的OsPRMT1、OsPRMT5和OsPRMT10定位于細胞質和細胞核,而OsPRMT6a和OsPRMT6b定位于細胞核,OsPRMT1、 OsPRMT4、 OsPRMT5、 OsPRMT6a、OsPRMT6b和OsPRMT10在體外表現出了精氨酸甲基轉移酶活性[25]。
1.2 組蛋白乙酰化修飾
組蛋白乙酰化反應多發生在組蛋白N端的賴氨酸殘基,通過組蛋白乙酰轉移酶將乙酰輔酶A的乙酰基轉移到組蛋白的賴氨酸殘基上,該過程中和了1個正電荷,減弱了DNA與組蛋白的相互作用,使得DNA更容易與轉錄因子結合,因此組蛋白乙酰化往往與轉錄激活相關。組蛋白乙酰轉移酶包括 GNAT(GCN5-related N-acetyltransferase)、MYST(MOZ-YBF2/SAS3-SAS2-TIP60)、CBP/p300(CREB-binding protein) 和 TAF1(TBP-associated factor 1)4個亞家族[26]。不同的乙酰轉移酶負責催化不同的組蛋白位點:GNAT催化H3K14或 H3K12位點;MYST催化 H4K5;CBP/p300的作用位點較為廣泛,對所有可以發生乙酰化的位點均有作用。GNAT是最大的組蛋白乙酰轉移酶亞家族,包括GCN5(general control nondere-pressible 5) 、 PCAF (P300/CBP-associated factor)、Elp3(elongator protein 3)、Hat1(histone N-acetyltransferase 1)和 Hpa2(histone and other protein acetyltransferase)等。其中,GCN5是首個在酵母中被鑒定的組蛋白乙酰化酶,也是研究最為深入的組蛋白乙酰化酶之一[27-28];其是 SAGA(Spt-Ada-GCN5 acetyltransferase)復合物的核心組分,而該復合物是進化中非常保守的組蛋白乙酰化復合物[29-31]。
組蛋白乙酰化是可逆的過程,即在組蛋白去乙酰化酶的作用下組蛋白可發生去乙酰化。相比于組蛋白乙酰化酶,組蛋白去乙酰化酶的種類更多,并且數量更加龐大,目前鑒定到的組蛋白去乙酰化酶可以歸為3個亞家族:RPD3/HDA1、HD2和SIR2[32],同時植物中還有其特有的去乙酰化酶家族,即第4類HD2亞家族[33]。
1.3 其他組蛋白修飾
相比于組蛋白甲基化和乙酰化修飾,其他的組蛋白修飾還有待深入研究。組蛋白泛素化是指泛素單體與組蛋白C末端結合的過程,主要發生在組蛋白H2A和H2B,組蛋白泛素化也是可逆的組蛋白修飾調控過程,通過特定的泛素蛋白酶可以使連接的泛素單體從底物脫落。組蛋白磷酸化修飾作為重要的翻譯后修飾,能夠通過改變蛋白與DNA或者蛋白與蛋白之間的相互作用重塑染色質結構,進而影響轉錄;最常發生磷酸化的氨基酸包括真核生物中的絲氨酸、蘇氨酸、酪氨酸以及原核生物和植物中的組氨酸,這些氨基酸的磷酸化對于信號通路和生物代謝具有重要作用[34-35]。SUMO化修飾也是重要的翻譯后修飾,參與胞核轉運、轉錄調控、細胞凋亡、脅迫應答和細胞周期等多種細胞進程[36]。組蛋白乳酸化修飾是最近鑒定到的一種新型共價修飾,發生在賴氨酸位點,細胞代謝的小分子可以參與調控細胞信號以及基因表達。組蛋白乳酸化和組蛋白乙酰化類似,可以直接激活目標基因的表達。水稻中鑒定的組蛋白乳酸化修飾位點包括一些保守的位點[37],如H2BK114、H2BK60和 H2BK66,這些乳酸化修飾是否與水稻品質形成有關還有待進一步研究。
2 組蛋白修飾對水稻生長發育、逆境響應的作用
組蛋白修飾因子通過改變染色質狀態調控生長發育相關基因的轉錄,從而影響水稻根、莖、葉等營養器官的發育以及抽穗期和開花等生長過程,此外組蛋白修飾還參與逆境脅迫應答(表1)。
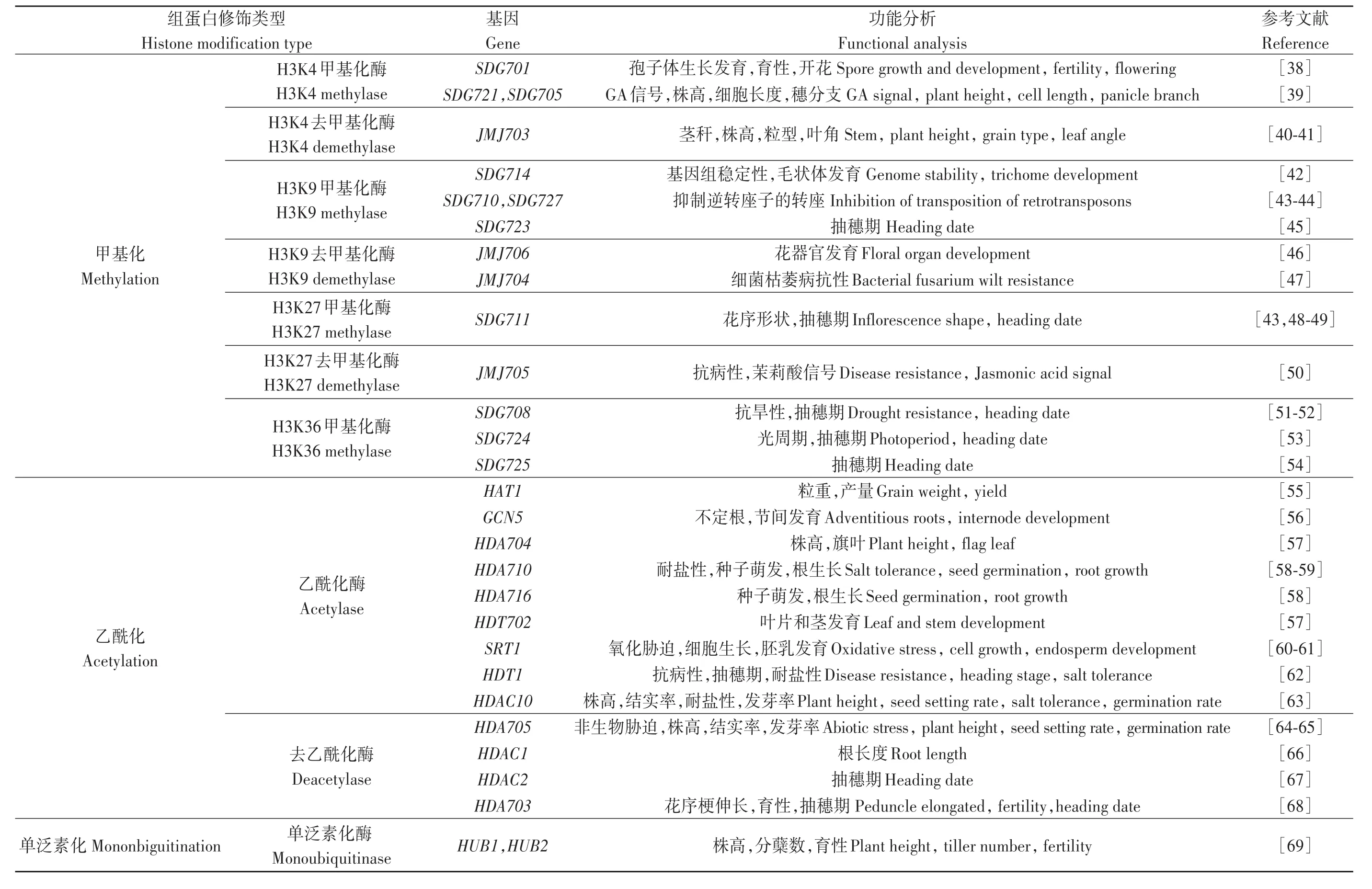
表1 水稻中部分已克隆的組蛋白修飾基因Table1 Part of cloned histone modification genes in rice
2.1 組蛋白修飾與營養器官發育
2.1.1 組蛋白修飾參與調控水稻根的發育 與野生型相比,組蛋白乙酰化酶基因GCN5 RNAi植株的冠根原基形成明顯延遲,7日齡幼苗產生的冠狀根較少,初生根長度、節間長度和幼苗高度也顯著降低,成熟期為半矮稈,表明GCN5影響水稻冠狀根的起始和伸長;進一步分析表明,RNAi植株根細胞數量和細胞層數減少,即GCN5可能在分
生組織細胞的橫向和縱向分裂中起作用[33]。此外,WOX11-ADA2-GCN5三元復合物在水稻冠根分生區細胞分裂中起重要作用[33]。WOX11(WUSCHEL-related homeobox gene 11)與下游靶基因結合后,通過與ADA2(alteration deficiency in activation 2)互作招募乙酰化酶GCN5,GCN5對靶基因位點的組蛋白進行乙酰化修飾,改變靶基因的染色質狀態,最終促進生長素轉運、細胞組分和能量代謝等相關基因的表達[56]。OsHDAC1通過對OsNAC6啟動子區組蛋白H3的K9、K14和K18以及組蛋白H4的K5、K12和K16進行去乙酰化來調控水稻根的生長[66]。由此可見,組蛋白修飾可與其他轉錄因子相互作用,通過改變下游基因的染色質狀態實現對根系生長發育的調控。
2.1.2 組蛋白修飾參與調控種子發育和愈傷組織形成 在種子萌發階段,過表達HDA705導致GA合成基因表達量降低,敲除HDA705后株高降低[64-65]。HDA710及HDA716可促進種子萌發及根的生長。在水稻成熟胚愈傷組織形成過程中,OsHDA710通過組蛋白脫乙酰作用抑制OsARFs表達來調節愈傷組織的形成[58]。SDG711介導的H3K27me3參與水稻種子胚乳發育,SDG711可直接與多個淀粉合成基因結合。此外,H3K4me3、H3K9ac與H3K27me3協同調節胚乳發育[48]。水稻SIR2家族中OsSRT1參與調控全基因組的H3K9ac水平,并與葉片中活性氧的積累、細胞生長以及胚乳的發育有關[60-61]。由此可見,組蛋白甲基化去乙酰化酶和組蛋白甲基化酶在水稻種子生長發育以及愈傷組織形成過程中發揮著重要作用,并且水稻胚乳的發育過程還存在著不同組蛋白修飾之間的協同調控作用。
2.1.3 組蛋白修飾參與調控水稻株高及葉片的發育 H3K4位點的去甲基化酶基因JMJ703參與調控水稻株高,該基因突變后,導致細胞分裂素氧化酶基因CKX啟動子區域H3K4me3水平升高,進而促進了該基因的表達,導致水稻株高降低[40-41]。SDG721和SDG705功能的喪失導致GA缺陷表型,包括半矮化、細胞長度減少等。SDG721和SDG705基因被敲除后,GA生物合成基因和GA信號通路基因的轉錄水平和H3K4me3水平被下調[39]。SDG714編碼組蛋白H3K9特異性甲基轉移酶,SDG714的C末端決定了酶活性和底物特異性,N末端將其定位于細胞核中。SDG714功能喪失突變體由于穎片、葉子和莖稈缺少宏觀毛狀體導致大部分無毛的表型[42]。HDA704沉默則影響株高及旗葉的生長;HDT702低表達則抑制葉片和莖的發育等[57]。由此可見,組蛋白修飾蛋白參與了水稻莖稈以及葉片的發育調控,其中JMJ703、SDG721和SDG705與細胞分裂素和赤霉素信號相關。
2.1.4 組蛋白修飾參與水稻分蘗的調控 NGR5(nitrogen-mediated tiller growth response 5)受氮素誘導表達,對D14、OsSPL14等分蘗抑制基因相應位點進行H3K27me3甲基化修飾抑制其表達,從而實現對水稻分蘗的調控。在半矮桿背景下,可通過超表達NGR5來提高低氮水平下的水稻產量,此外NGR5被發現為赤霉素受體GID1的新靶標,受其負調控,NGR5和PCR2介導的H3K27me3參與了赤霉素信號響應,對新一代“綠色革命”育種實踐具有重要意義[70]。OsVIL2(vernalization insensitive 2-like protein)可與分蘗調控的關鍵基因OsTB1(teosinte branched 1)的啟動子區域結合,介導的H3K27me3也參與對OsTB1的調控,因此OsVIL2通過染色質修飾抑制OsTB1表達,從而誘導分蘗芽生長[71]。H3K27me3參與調控水稻分蘗,并靶向D14和OsSPL14等分蘗抑制基因。
2.2 組蛋白修飾與抽穗期以及穗部發育
2.2.1 組蛋白修飾參與調控水稻抽穗期 抽穗期是水稻重要的農藝性狀,由品種遺傳特性決定,是水稻生長發育過程中由營養生長轉向生殖生長的關鍵時期。抽穗期過短導致基本營養缺乏、植株矮小影響最終產量;抽穗期過長會因氣溫降低影響籽粒成熟,最終減產甚至絕收。
SDG701蛋白直接與成花素基因Hd3a和RFT1相結合,通過建立H3K4me3修飾來促進成花素基因的表達,進而調控水稻開花[38]。OsTrx1編碼SET結構域包含蛋白SDG723,SET結構域具有組蛋白H3甲基轉移酶活性,因此,OsTrx1的PHD基序能與組蛋白H3結合,對來自寡核小體的組蛋白H3K4位點甲基化;OsTrx1位于Ehd1上游,為Ghd7的負調控因子,參與調控水稻開花[45]。SDG711是Zeste增強子,屬于核心的PcG蛋白,其編碼基因的過量表達或下調表達,在長日照下(long day,LD)抑制或促進開花,但在短日照下沒有作用。SDG711在LD條件下抑制OsLF(Hd1抑制因子),促使Hd1高表達,導致開花延遲;在LD條件下,SDG711還會抑制Ehd1表達[49]。SDG708敲除突變體中,Hd3a、RFT1和Ehd1的H3K36me1、H3K36me2和H3K36me3的修飾水平均有降低,導致基因表達量降低,水稻開花延遲[51]。MORF相關蛋白702(MRG702)在體外與三甲基化H3K4和H3K36(H3K4me3和H3K36me3)結合,作為閱讀蛋白來破譯甲基化信息,參與油菜素內酯信號傳導以及調控花期,即呈現出與SDG725功能缺失突變體相似的表型[72]。此外,SDG724調控MADS轉錄因子家族基因MADS50和成花素基因RFT1的啟動子區域H3K36me2/3,從而促進水稻開花[53]。轉錄因子OsSUF4識別特定元件,并招募H3K36甲基轉移酶SDG725,通過調控成花基因RFT1和Hd3a表達來促進水稻開花[54]。植物特有的組蛋白去乙酰化酶HD2亞家族成員OsHDT1介導了長日照條件下水稻Shanyou 63(SY63)開花關鍵基因OsGI和Hd1的組蛋白H4去乙酰化,從而抑制基因的表達,促進開花[62]。OsSFL1(SAP30 functional like 1)可與OsHDAC2互作,靶向水稻開花基因Hd1,通過調控H3乙酰化水平調控該基因表達,進而調控花期[67]。組蛋白去乙酰化酶OsHDA703可與OsBZR1互作調控BR信號和植物生長,通過調控Ghd7的H4去乙酰化水平來調控抽穗期[68]。FRRP1編碼E3連接酶(C3H4型環指結構域蛋白),影響組蛋白H2B單泛素化,調控花期和產量相關基因的表達,最終影響水稻抽穗期和產量[73]。綜上所述,水稻中SET結構域家族蛋白SDG701、SDG723、SDG711、SDG708、SDG725和SDG724等組蛋白甲基化酶參與調控水稻抽穗期,此外組蛋白去乙酰化和組蛋白單泛素化在調控水稻開花時間也發揮了重要作用。
2.2.2 組蛋白修飾參與調控水稻穗部性狀SDG701編碼H3K4甲基轉移酶,對水稻孢子體生長發育和配子傳遞的正常進行具有重要意義,其異常表達直接影響水稻結實[38]。JMJ706編碼與異染色質相關的H3K9脫甲基酶,JMJ706蛋白在體外特異性地去除組蛋白H3第9位賴氨酸位點的二甲基化和三甲基化;該基因的功能喪失突變導致H3K9的二甲基化和三甲基化增加,影響花和小穗發育,如改變花的形態和器官數量等[46]。SDG727和SDG710對組蛋白H3K9去甲基酶JMJ706有拮抗作用,這些基因的下調表達能夠部分互補jmj706的表型,并且降低H3K9的甲基化。SDG711介導的H3K27me3能抑制參與花序分生組織活性的多個重要基因,過量表達SDG711能增加花序分生組織活性,使穗部增大[43-44]。降低HDA703的表達可抑制花序梗的伸長及育性[70]。GW6a編碼組蛋白乙酰轉移酶的類GNAT蛋白OsHAT1,其調控水稻粒重、產量和植株生物量[55]。OsHUB1和OsHUB2在核內存在互作,介導組蛋白H2B單泛素化,調控絨氈層降解相關基因的表達;并且與H3K4me2協同影響水稻花藥發育[69]。由此可見,組蛋白修飾與水稻花序分生組織發育等穗部性狀形成有關,對穗粒數、結實率等水稻產量性狀具有重要作用。
2.3 組蛋白修飾與生物和非生物脅迫
除對植物生長發育有影響外,組蛋白修飾還參與水稻生物和非生物脅迫相關基因的表達調控。
2.3.1 組蛋白修飾參與調控水稻抗病性 jmj704突變體中H3K4me2/3水平顯著升高,表明JMJ704參與調控H3K4me2/3去甲基化,JMJ704通過減少下游靶基因上的激活標記H3K4me2/3,從而下調NRR、OsWRKY62和Os-11N3等水稻防御負調節基因的轉錄水平實現正向調控水稻對細菌枯萎病的抗性[47]。水稻JMJ705為擬南芥REF6的同源蛋白,該蛋白參與H3K27me3修飾的去除,超表達JMJ705基因產生明顯的假病斑表型,而jmj705突變體的感病性增強,表明JMJ705參與水稻H3K27me3修飾的去除和基因表達的激活[50]。OsHDT1影響全基因組H4乙酰化水平,當其被抑制后全基因組H4乙酰化水平上升,從而提高抗病相關基因的表達量,增強水稻對稻瘟病菌的抗性[62]。
2.3.2 組蛋白修飾參與調控水稻非生物脅迫抗性 生物鐘核心轉錄因子OsPRR73能通過組蛋白去乙酰化酶HDAC10在轉錄水平上抑制OsHKT2;1表達,在特定時間內減少鈉離子的吸收,以避免鈉離子過度積累。鹽脅迫耐受性方面,OsHKT2;1位于OsPRR73下游,通過調節鈉離子穩態和活性氧水平調控水稻耐鹽性[63]。HDA705參與ABA和非生物脅迫的響應,過表達HDA705導致GA合成基因的表達量降低,而ABA合成基因的表達量增加[64-65]。組蛋白H3K4me3修飾和轉錄因子OsbZIP23在水稻干旱脅迫條件下調控脫水蛋白基因簇的相互作用。當H3K4me3修飾水平增加時,脫水素基因表達水平增加,OsbZIP23與脫水素基因啟動子的結合水平也增強,轉錄因子和H3K4me3修飾在干旱響應基因調控中具有協同作用[76]。SDG708通過直接靶向和激活關鍵的ABA生物合成基因OsNCED3和OsNCED5來促進ABA生物合成。在正常和干旱脅迫條件下,SDG708的過表達增強了水稻的耐旱性,從而提高水 稻 的 產 量[52]。 HDA710 通 過 改 變 OsLEA3、OsABI5、OsbZIP72和OsNHX1等ABA和鹽脅迫響應基因啟動子中H4乙酰化水平來調控基因表達,從而響應鹽脅迫應答[59]。茉莉酸受體蛋白基因OsCOI1a啟動子區域的DNA甲基化和H3K9me2水平影響該基因的表達,表觀遺傳修飾和茉莉酸信號共同調控水稻對除草劑的抗性[74]。綜上所述,組蛋白修飾對水稻抗除草劑、耐鹽和抗旱性具有重要意義。
2.4 組蛋白修飾的作用機制
組蛋白修飾作為重要的表觀遺傳類型,不同的共價修飾類型對組蛋白與組蛋白、組蛋白與DNA之間的作用具有顯著影響,從而對基因轉錄和表達實現調控作用。在水稻中,組蛋白修飾對生長發育、產量、品質、適應性以及抗性等相關基因的表達進行調控,從而影響水稻生長發育(圖1)。
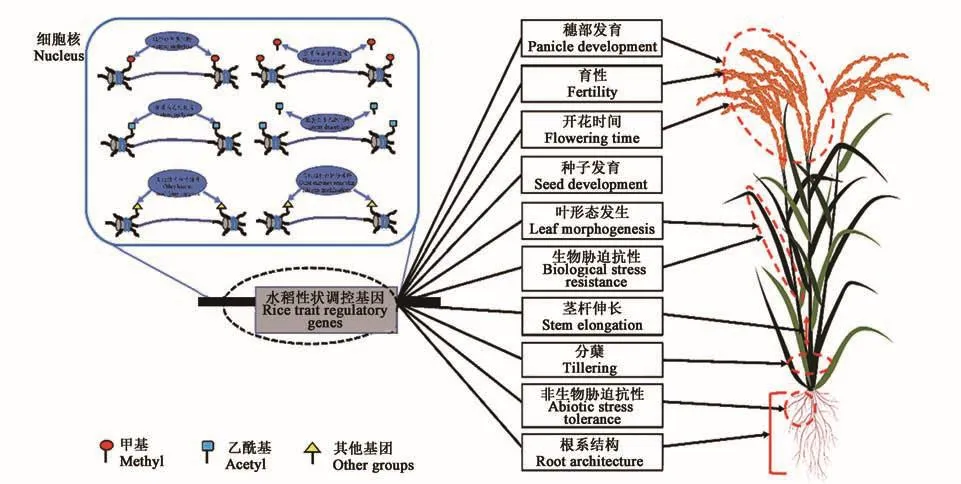
圖1 組蛋白修飾在水稻生長發育、抗逆等過程中的作用機制Fig.1 Role mechanism of histone modification in the process of rice growth,development and stress tolerance
3 展望
表觀遺傳作為一個新興的研究領域,是當前生命科學的研究熱點之一。隨著染色質免疫共沉淀技術及第三代測序技術的不斷發展,水稻組蛋白修飾的研究取得了重大進展。然而,與哺乳動物和模式植物擬南芥相比,水稻組蛋白修飾的研究相對滯后,目前組蛋白修飾的研究多集中在H3K4、H3K27和H3K9等幾個特定位點,且修飾的類型也局限于甲基化、乙酰化等常見類型。借鑒其他物種中組蛋白修飾的研究成果將為水稻組蛋白修飾的研究開創更大的發展空間。隨著生物信息學的不斷發展,研究組蛋白修飾在水稻生長發育以及產量和品質形成的分子機制,利用組蛋白修飾等表觀遺傳效應改良水稻的產量、品質以及抗逆性有著廣泛的應用前景。

