胃癌與慢性萎縮性胃炎的差異基因與中藥治療的生信分析及系統評價
楊 柳, 李 澤, 高云霄, 郭榆西, 郭 彤, 李博林, 楊 倩, 張 彤
(1.河北中醫學院研究生院,河北 石家莊 050011;2.河北中醫學院第一附屬醫院,河北省中醫院脾胃病科,河北 石家莊 050090;3.河北醫科大學第四醫院,河北 石家莊 050035)
慢性萎縮性胃炎(chronic atrophic gastritis,CAG)系指胃黏膜上皮承受反復侵蝕導致固有腺體的減少,伴或不伴腸腺化生和(或)假幽門腺化生的一種慢性胃部疾病[1]。慢性萎縮性胃炎嚴重影響了患者的生存質量,且在1988年就有研究證實,慢性萎縮性胃炎有向胃癌轉變的風險[2]。CAG西醫治療目前缺乏特效藥物[3],故尋找慢性萎縮性胃炎與胃癌的差異基因,探索炎癌轉化的途徑,為特效藥物的開發尋找特異性靶點就有著非常重要的意義。近年來,通過分析二代測序平臺的基因探針廣泛地應用于疾病預后、靶向新藥研發等臨床研究中。中藥治療萎縮性胃炎具有優勢,故而研究萎縮性胃炎向胃癌轉化的關鍵基因、尋找出針對慢性萎縮性胃炎的有效中藥,用以指導臨床的診治具有重要意義。本文將分析萎縮性胃炎與胃癌基因探針產生的數據矩陣,研究慢性萎縮性胃炎與胃癌的差異基因和針對靶點的中藥,通過系統性評價驗證該藥的臨床療效,為慢性萎縮性胃炎的中醫診治提供理論依據。
1 資料與方法
1.1 芯片數據的獲取 在GEO(geneexpressionomnibus)數據庫(https://www.ncbi.nlm.nih.gov/gds)中下載基因芯片數據(GSE116312、GSE55696),2組芯片數據中包含了慢性萎縮性胃炎、胃癌、胃早期癌、濾泡型胃炎等基因表達矩陣,選取其中慢性萎縮性胃炎與胃癌作為研究對象,所有樣本均采自病變胃黏膜。
1.2 數據的處理 Bioconductor包是基于R語言開發的用于生物信息學分析的眾多工具包的集合,可以快速地進行若干生物信息學相關的分析并將結果可視化。首先對所得數據集進行回歸計算,得出其相對標準差(NUSE),并繪制NUSE箱線圖,以檢驗平行試驗的一致性。如計算結果具有一致性,說明芯片質量可信,可以進行進一步研究。通過數據的合并、規范基因名稱、補充缺失值對數據進行預處理,并應用Lmfit、eBayes函數計算出萎縮性胃炎與胃癌的差異基因,調整P(adj.P)<0.05及|log2FC|≥1為篩選差異基因的標準,其中logFC≤-1說明此類基因在萎縮性胃炎中的表達要低于胃癌中的表達, logFC≥1說明此類基因在萎縮性胃炎中的表達要高于胃癌中的表達。得出結果即為萎縮性胃炎與胃癌的差異表達基因(differentiallyex-pressedgenes,DEGs)。運用gplots包對所得結果可視化。
1.3 慢性萎縮性胃炎與胃癌DEGs的生物富集分析和通路富集分析 將上述所得結果導入DAVID 6.8數據庫(https//david.ncifcrf.gov/),設置物種為人類,對慢性萎縮性胃炎的低表達和高表達基因分別進行生物富集分析和通路富集分析。
1.4 慢性萎縮性胃炎與胃癌DEGs蛋白-蛋白相互作用(PPI)網絡構建及關鍵基因分析 將所有差異基因導入STRING數據庫(http://string-db.org/),進行蛋白-蛋白相互作用(protein-proteininteraction,PPI)分析,將交互分數大于0.4的基因輸入Cytoscape 3.7.2軟件繪制蛋白互作圖;應用軟件中的CytoNCA工具計算蛋白互作圖中的節點,得出其在圖中的作用度值(Degree)。Degree值越大,說明該節點在網絡中承擔的生物功能越多,將Dgree值≥2的基因視為慢性萎縮性胃炎向胃癌轉變的關鍵基因。
1.5 治療慢性萎縮性胃炎中藥分析 將基因名輸入HERB數據庫[4],又稱本草組鑒(http://herb.ac.cn/),可得到作用于此基因的中藥,將慢性萎縮性胃炎與胃癌的DEGs輸入本草組鑒,以P<0.05為標準進行中藥篩選[5],將篩選所得的中藥進行頻次統計,得出頻次最高的3味中藥。
1.6 中藥系統性評價 根據文獻的支持程度,再次遴選出1味與該病的治療最為相關的中藥,采用系統評價的方式對以該藥為君藥的方劑治療慢性萎縮性胃炎的效果作進一步的驗證。
1.6.1 文獻檢索 在英文數據庫及中文數據庫中國期刊全文數據庫(CNKI)、萬方數據庫、中文科技期刊全文數據庫(VIP)、中國生物醫學文獻數據庫(CMB),檢索所有以上中藥治療慢性萎縮性胃炎的文獻,選擇以該味中藥為君藥的文獻進行系統評價,所有數據庫檢索時間均為建庫至2020年12月。
1.6.2 納入標準 國內外的盲法與非盲法的隨機對照試驗,語言僅限于中文與英文。研究對象為慢性萎縮性胃炎,診斷標準參照《中國慢性胃炎共識意見(2017年,上海)》[1],臨床表現、內鏡及病理檢查、實驗室檢查均提示為慢性萎縮性胃炎,服藥方式為口服,不限性別、年齡與病程。試驗組給予純中藥湯劑加減口服治療;對照組給予萎縮性胃炎的常規診療手段如嗎丁啉、胃復春、質子泵抑制劑等口服治療。
1.6.3 排除標準 重復文章、經驗類、綜述類文章、無全文文章及因資料不全無法進行數據提取的文章;試驗設計不嚴謹、動物實驗研究。
1.6.4 數據提取與質量評價 由2位研究者分別檢索文獻,并根據錄入排除標準對檢索所得文獻進行納排,使用標準資料對納入文獻的數據進行提取,通過第3位研究者對所產生的分歧確定共識意見。運用Jadad量表對納入臨床試驗的方法學質量進行評估[6],最低1分,最高5分,1~2分視為低質量研究,3~5分視為高質量研究。采用Rstudio軟件的Meta包進行數據分析,分別選取平均差(meandifference,MD)、相對危險度(riskratio,RR)作為連續型變量和二分類變量的療效分析統計量,以95%CI表示。當P>0.10,I2≤50%時,可認為無異質性,采用固定效應模型分析;當P≤0.10,I2>50時,認為有異質性,使用隨機效應模型分析并進行亞組分析或敏感性分析[7]。采用漏斗圖進行發表性偏倚的檢測,如具有偏倚,運用剪補法檢驗偏倚的影響性[8];如納入數據不能進行Meta分析時,則行描述性分析。
2 結果
2.1 數據質量檢驗 下載慢性萎縮性胃炎和胃癌的基因芯片數據(GSE116312、GSE55696)后,運用R語言的fitPLM函數對數據結果進行回歸計算,并繪制GSE116312芯片NUSE箱型圖,見圖1。經過檢驗,可以看出基因芯片數據(GSE116312、GSE55696)質量可靠,可進行進一步的研究。
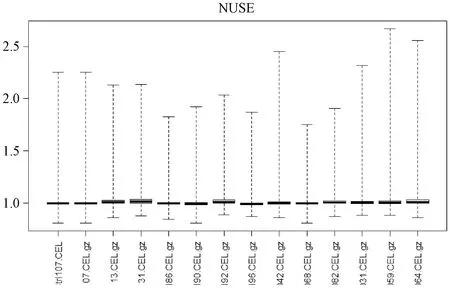
圖1 NUSE箱型圖
2.2 差異基因 經過初步篩選后發現,GSE116312與GSE55696中共有的慢性萎縮性胃炎與胃癌的差異基因有59個,其中36個基因表達在萎縮性胃炎中低表達,23個基因在慢性萎縮性胃炎中高表達,見圖2。
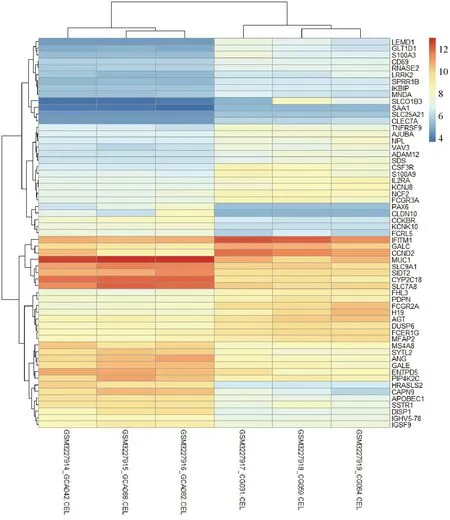
圖2 GSE116312熱圖
2.3 慢性萎縮性胃炎與胃癌DEGs的GO和KEGG分析 運用DAVID數據庫分別對低表達基因及高表達基因進行GO和KEGG富集分析,結果顯示,下調DEGs的GO分析可見其生物過程(biological process,BP)主要集中在中性粒細胞趨化作用、血小板活化、固有免疫應答、整合素介導的信號通路、MAPK活性的激活、炎癥反應的積極調控等方面;細胞組成(cellular component,CC)主要集中在質膜外側、質膜、胞外區、胞外外體、膜的組成部分等;分子功能(molecular function,MF)主要表現在IgG結合。KEGG富集發現主要集中在吞噬作用、自然殺傷細胞介導的細胞毒性,見表1。上調基因GO分析可見BP主要集中在消化;CC主要集中在膜的組成部分、基底外側質膜、質膜的組成部分;其KEGG富集在胃酸分泌,見表2。
2.4 PPI網絡的構建及關鍵基因分析 通過Cytoscape軟件分析得出PPI蛋白互作圖,見圖3,得出慢性萎縮性胃炎與胃癌關鍵的差異基因為免疫球蛋白E高親和蛋白受體1G(Fc epsilon receptor,FCER1G)、免疫球蛋白G高親和力受體蛋白2A(Fc gamma receptors 2A,FCGR2A)、免疫球蛋白G高親和力受體蛋白3A(Fc gamma receptors 3A,FCGR3A)、人髓性細胞核分化抗原(myeloid cell nuclear differentiation antigen,MNDA)、嗜中性粒細胞胞漿因子2(Neutrophil cytoplasmic factor 2,NCF2)鈣結合蛋白A9(S100A9)、血管緊張素原(angiotensinogen,AGT)、血清淀粉樣蛋白A1(serum amyloid A1,SAA1),生長抑素受體1(somatostatin receptor 1,SSTR1)、VAV家族蛋白3(VAVprotein3,VAV3),見表3。

圖3 慢性萎縮性胃炎與胃癌差異基因蛋白互作圖

表1 慢性萎縮性胃炎與胃癌的下調差異基因

表2 慢性萎縮性胃炎與胃癌的上調差異基因

表3 慢性萎縮性胃炎與胃癌差異基因中的關鍵基因
2.5 治療慢性萎縮性胃炎的相關中藥的分析 在本草組鑒(http://herb.ac.cn/)中經過篩選并統計頻次,發現與DEGs作用最密切的前3味中藥是沙苑子、丹參、甘草,其中丹參具有活血祛瘀、通行血脈的功效,在治療脘腹疼痛、癥瘕積聚等疾病時常以此為主藥。久病血瘀是慢性萎縮性胃炎發生發展的重要病機,是胃黏膜萎縮的發生發展乃至惡化的重要因素[9],因而選擇中藥丹參作為研究目標,采用系統評價的方式作進一步的驗證。
2.6 系統評價文獻篩選、質量評價及納入研究的特征 以“丹參”“萎縮性胃炎”“慢性萎縮性胃炎”等關鍵詞在上述數據庫中檢索,共有相關文獻464篇,通過閱讀摘要和題目排除重復文獻96篇,排除經驗類、綜述類等不符合研究目的文獻330篇,最終對38篇文獻進行全文閱讀,其中符合丹參為君藥的方劑為丹參飲和復方丹參滴丸。丹參飲出自《時方歌括》,陳修園稱其“治心痛胃脘諸痛多效”,藥物組成精當,藥簡力專,本方中起主要作用的藥物為丹參,因而以丹參飲做系統評價,最后納入符合納排條件的文獻共7篇[10-16],全部為中文文獻,總計640例患者,文獻篩選流程及結果見圖4。其中5篇文獻質量評分為1分[10,12-13,15-16],1篇文獻為2分[11],僅有1篇為3分[14],見表4。7個隨機對照試驗(RCT)的基本特征見表5。
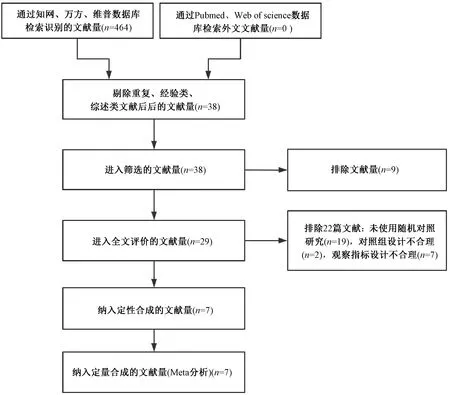
圖4 文獻篩選流程
2.7 Meta分析
2.7.1 臨床總有效率 7個RCT皆對臨床總有效指標進行了比較,共有640例患者,其中實驗組322例,對照組318例。異質性檢驗分析顯示7個研究之間具備統計學同質性(P=0.39,I2=5%),符合使用固定效應模型的條件。Meta分析結果顯示,實驗組與對照組臨床療效差異具有統計學意義(P<0.000 01),合并相對危險度(RR)=1.24,95%置信區間為[1.15,1.33]。Meta分析顯示可認為丹參飲加減在臨床療效上明顯優于對照組,見圖5。

表4 納入文獻質量評分
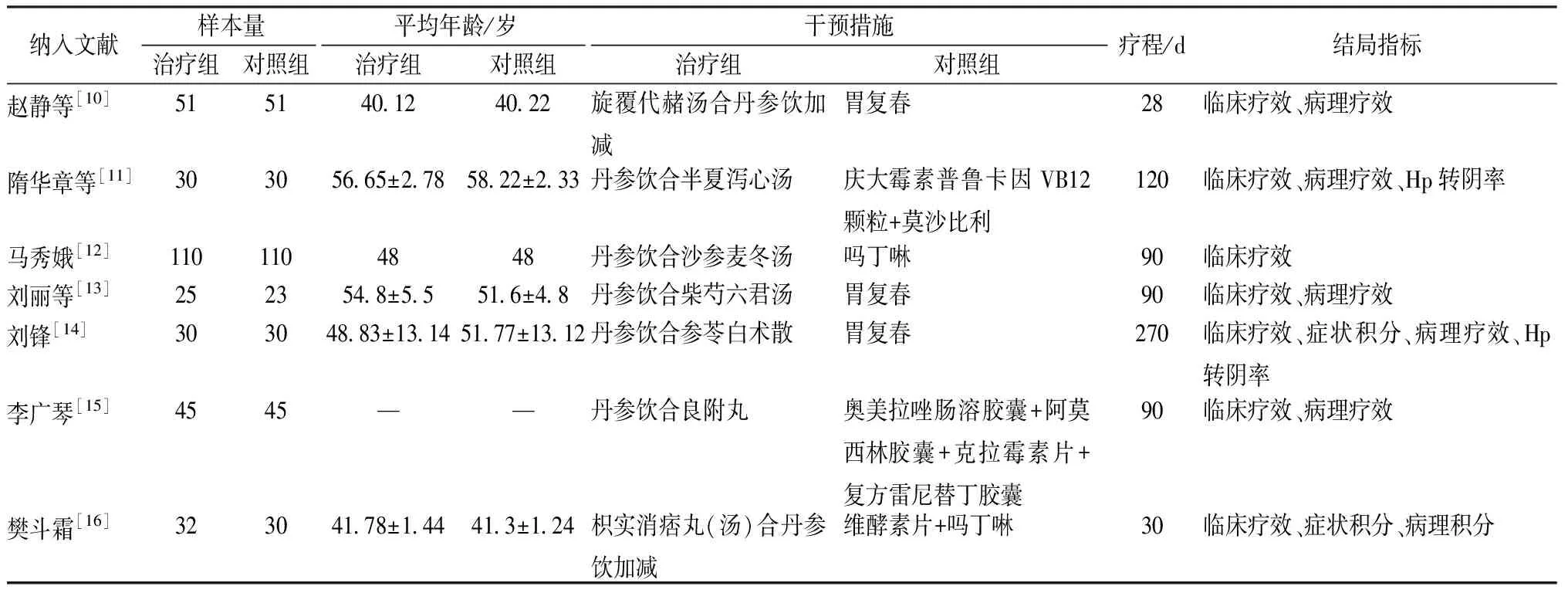
表5 納入文獻的基本特征

圖5 臨床總有效率Meta分析
2.7.2 病理療效 5個RCT對病理療效進行了比較,運用RR、95%置信區間作為效應量的表達方式。統計顯示異質性檢驗顯示,P=0.45,I2=0%,說明5個RCT之間異質性較低,故采用固定效應模型進行分析。Meta分析結果顯示,實驗組與對照組臨床療效差異具有統計學意義(P<0.000 01),合并RR=1.34,95%置信區間為[1.15,1.55]。Meta分析顯示可認為丹參飲加減在病理療效上明顯優于對照組,見圖6。
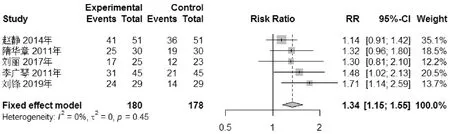
圖6 病理總有效率Meta分析
2.7.3 Hp轉陰率 2個RCT均對Hp轉陰率進行了比較,共有79例患者,其中實驗組39例,對照組40例。異質性檢驗分析顯示2個研究之間具備統計學同質性(P=0.35,I2=5%),因此采用固定效應模型進行分析。Meta分析結果顯示,實驗組與對照組Hp轉陰率差異不具有統計學意義(P=0.157 4),見圖7。

圖7 Hp轉陰率Meta分析
2.8 脫落、失訪及不良反應 1個RCT報道了脫落和失訪情況,但未提及原因;7個RCT均未報道不良反應。
2.9 發表偏倚分析 對臨床總有效率為效應指標的研究進行倒漏斗圖分析,可見2個數據分布在漏斗圖左側,5個數據分布在漏斗圖的右側,說明納入的文獻存在明顯的發表偏倚,見圖8。運用剪補法trimfill函數計算缺失值,將缺失值與原有的結果合并,顯示異質性仍較低(I2=21.7%,P=0.24),采用固定效應模型,RR=1.24,95%置信區間為[1.11,1.25]。數據變化不明顯,說明發表偏倚影響不大,結果真實性好。

圖8 偏倚分析
3 討論
3.1 慢性萎縮性胃炎與胃癌DEGs分析 慢性萎縮性胃炎主要與幽門螺桿菌的感染、膽汁反流、免疫因素有關[17-20]。通過生信分析發現,慢性萎縮性胃炎與胃癌的差異基因有59個,其中36個基因表達下調,23個基因表達上調,關鍵基因為FCER1G、FCGR2A、FCGR3A、MNDA、NCF2、S100A9、AGT、SAA1、SSTR1、VAV3等。
AGT基因編碼的血管緊張素原參與腎素-血管緊張素系統(RAS),可調節和維持人體內環境的相對穩定[21]。Sugimoto等[22]發現幽門螺桿菌會導致RAS成分過度表達,如血管緊張素Ⅱ(AngⅡ)受體。AngⅡ可以誘導VEGF-A的表達,使細胞過度增殖,促使胃黏膜細胞的癌變[23]。血清淀粉樣蛋白A(SAA),可由IL-6、TNF-α刺激肝細胞產生[24],SAA受體包括FPRL-1/ALX、SR-BI、RAGE、TANIS等[25-27],SAA與受體結合可發揮調控白細胞遷移、促進炎癥等作用[26-28]。FCER與FCGR編碼的是免疫球蛋白受體(FcR),免疫球蛋白識別結合抗原后,與先天免疫細胞結合,介導吞噬作用、Ⅰ型超敏反應。故FCER與FCGR與自身免疫性疾病有關,而免疫反應的改變可能使自身免疫性胃炎向胃癌轉變[29]。幽門螺桿菌感染可以促進FcR介導的免疫反應,間接導致胃黏膜癌變[30]。SIPR1編碼的類固醇受體共激活因子相互作用蛋白受體位于類固醇受體共刺激因子上,可以抑制類固醇受體共刺激因子的活性,阻止類固醇受體進入細胞核,進而起到抑制轉錄的作用[31]。S100A9編碼形成鈣衛蛋白[32],鈣衛蛋白可通過介導p38細胞分裂素活化蛋白激酶的磷酸化誘導NF-κB的激活,從而促進胃癌細胞的遷移和侵襲[33]。CCND2屬于細胞周期素,其含量隨細胞有絲分裂的不同時期而變化,可能通過活化周期蛋白依賴激酶調節細胞周期參與細胞的增殖[34],從而導致胃癌的發生。
現有研究成果支持生信分析結果,FCER1G、FCGR2A、FCGR3A、MNDA、NCF2、S100A9、AGT、SAA1、SSTR1、VAV3等基因是慢性萎縮性胃炎向胃癌轉化的關鍵分子。
3.2 慢性萎縮性胃炎與胃癌DEGs富集信號通路分析 自然殺傷細胞(NK)是人體中關鍵的免疫細胞,它具有抑癌、調節免疫的作用[35]。自然殺傷細胞介導的細胞毒性即NK細胞通過定向釋放溶解顆粒或通過誘導相關受體介導的凋亡來殺死癌細胞[36]。在胃炎及胃癌組織中均可見NK細胞表達,但胃癌組NK細胞的表達要高于慢性胃炎組[37],與本文研究結果一致。由于很多治療癌癥的免疫制劑有賴于通過細胞毒性來發揮作用,因此研究此途徑的具體機制具有一定的臨床意義。
3.3 治療慢性萎縮性胃炎相關中藥分析 慢性萎縮性胃炎后期常有氣滯血瘀[38]。通過本草組鑒分析結合專業知識可知以丹參為主藥的方劑可作用于慢性萎縮性胃炎的關鍵基因,故進行丹參飲加減治療慢性萎縮性胃炎的系統評價,發現丹參飲的臨床療效與病理療效均高于常規治療。但也存在諸多問題,①納入文獻的隨機方法未作詳細報告、均未使用盲法、報告存在偏倚風險; ②缺乏對患者的隨訪、病例脫落、臨床不良反應的報告; ③文獻量較少、Jadad評分較低。
綜上所述,慢性萎縮性胃炎向胃癌轉化過程與FCER1G、FCGR2A、FCGR3A、MNDA、NCF2、S100A9、AGT、SAA1、SSTR1、VAV3等基因及自然殺傷細胞介導的細胞毒性關系密切,中藥丹參對治療慢性萎縮性胃炎臨床療效較好。本研究為疾病的診斷提供了潛在標志物,為臨床選藥提供了思路。但由于納入文獻數量較少,質量較低,有待今后出現更多高質量循證醫學證據后再進行系統評價。

