蘑菇醬油的細菌群落及揮發性風味特征
李樹,劉沖,趙國忠,張彥民,王菲,潘志輝,周新運*
1(天津科技大學 食品科學與工程學院,天津,300457)2(山東巧媳婦食品集團有限公司,山東 淄博,255400) 3(廣州致美齋食品有限公司,廣東 廣州,510000)
傳統醬油以大豆或豆粕為底物在米曲霉的作用下經制曲和鹽水發酵兩個階段自然發酵而成。但發酵底物局限性限制了醬油品質的提升。近年來,作為氮源或碳源的酵母抽提物、玉米漿、植物莖葉以及無機鹽通常被添加到發酵的底物中以提高種曲和自然發酵菌群的活性,達到改善醬油發酵微生態并促進特征風味形成的目的[1]。而蘑菇本身是一種富含氨基酸、多糖、碳水化合物、粗纖維、核苷酸、維生素、脂肪酸和酰胺類物質的保健食材,將其應用到醬油的發酵中可以提高醬油的品質并滿足消費者的健康需求。之前研究發現,猴頭菇可以促進醬油中的優勢菌群從Stenotrophomonas向Bacillus轉換,并且酯類、醇類和亞油酸類香氣成分被上調[2]。杏鮑菇醬油以杏鮑菇∶面粉為5∶3的質量比例發酵時,醬油顏色紅亮,并且菇香濃郁[3]。但不同種類蘑菇醬油的風味特征和關鍵香氣成分的代謝菌群溯源未被探究。
醬油發酵時菌群微生態的特點將直接影響醬油風味的產生。Bacillus通常具有淀粉酶、蛋白酶和L-谷氨酰胺酶基因,這可以實現發酵底物向風味組分的轉變。Bacillussubtilis是醬油中4-乙基愈創木酚(辛香、香莢蘭香)和麥芽酚(焦奶油香)的主要貢獻者[4]。Bacillusvelezensis則有助于3-甲基丁醛(蘋果香)的生成[5]。此外,Staphylococcus是驅動醬油發酵的優勢菌屬之一,其具有產生L-谷氨酰胺酶和2-甲基丙醛(甜香)的能力[6]。同樣的,乳酸菌也是醬油發酵中的核心菌群。Weissella和Pediococcusacidilactici與醬油乳酸和乙酸等有機酸的產生密切相關;Lactobacillusplantarum可以提升醬油酮類和酚類物質的含量;Tetragenococcushalophilus則是醛類和酸類風味的優質貢獻者[7]。因此,對蘑菇醬油發酵的微生態進行表征有利于風味組分的溯源和特征風味醬油的開發。
該研究首先以宏觀的微生物多樣性分析和微觀的共發生模型探討了蘑菇醬油發酵的微生態特點,并挖掘了核心發酵菌群。隨后以GC-MS技術表征了各種蘑菇醬油的風味特征。并且將核心發酵菌群和特征香氣組分進行了雙因素正交偏最小二乘法(the two way orthogonal partial least squares, O2PLS)建模以探究二者的相關性。該研究為醬油的改進和新型蘑菇醬油的商品化提供了依據。
1 材料與方法
1.1 試劑
大豆、炒小麥粉,湖北安琪酵母股份有限公司;猴頭菇、滑子菇、草菇、雙孢菇、杏鮑菇、姬松茸、雞腿菇、茶樹菇、香菇,哈爾濱北大荒商貿集團控股公司;米曲霉As3.042,天津科技大學菌種室;16S rRNA的V3~V4引物、TruSeq?DNA PCR-Free Sample Preparation Kit,北京諾禾致源科技股份有限公司;細菌基因組DNA提取試劑盒,貴州天根生物有限公司;C6~C33正構烷烴混合物標準品(≥97%),美國Sigma-Aldrich公司。
1.2 儀器與設備
Illumina NovaSeq 6000高通量測序儀,上海鯨舟基因科技有限公司;DF-101S集熱式恒溫加熱磁力攪拌器,鞏義市予華儀器有限責任公司;7890AGC氣相色譜-質譜聯用儀,美國安捷倫科技公司;Rtx-5色譜柱,上海圣賓儀器科技有限公司;手動頂空固相微萃取進樣器、固定搭載裝置及固相微萃取頭(50/30 μm DVB/CAR),美國Supelco公司。
1.3 實驗方法
1.3.1 蘑菇醬油的發酵
將浸泡6 h的120 g大豆與120 g炒小麥粉和26.7 g鮮蘑菇粉混勻浸潤,121 ℃、0.1 MPa滅菌20 min。冷卻至35 ℃后,接入質量比0.3%的種曲,混勻后于30 ℃恒溫培養箱培養。大曲出現白色菌絲時進行第一次翻曲,表面呈淡黃色時第二次翻曲,培養至大曲黃綠色時收曲。向成熟的大曲拌入曲料質量2倍的180 g/L的鹽水,裝入發酵罐進行升溫式開放發酵。初始發酵溫度16 ℃,每天升高1 ℃,升溫至30 ℃時進入恒溫發酵階段,發酵周期為180 d,并每天進行攪拌[2]。以傳統大豆醬油作為對照組,將浸泡6 h的140 g大豆與120 g炒小麥粉攪拌均勻,發酵流程同實驗組。從發酵起始每隔30 d取樣1次,并對所有發酵階段樣品混樣處理,實驗組、對照組每組樣品取3個平行備用。
1.3.2 蘑菇的營養成分測定
水分測定參照GB 5009.3—2016《食品中水分的測定》;總灰分測定參照GB 5009.4—2016《食品中灰分的測定》;粗蛋白測定參照GB 5009.5—2016 《食品中蛋白質的測定》;粗脂肪測定參照GB 5009.6—2016《食品中脂肪的測定》;粗纖維測定參照GB/T 5009.10—2003《植物類食品中粗纖維的測定》;氨基酸測定參照GB/T 5009.124—2016《食品中氨基酸的測定》。
1.3.3 細菌群落高通量測序
使用細菌基因組DNA提取試劑盒提取發酵醬油細菌DNA,以質控和稀釋后的總的醬油細菌菌群DNA為模板(1 ng/μL),擴增16S rRNA的V3~V4區域。其引物為338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反應體系(50 μL):10×buffer 5 μL,三磷酸脫氧核糖核苷1 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,TaqDNA聚合酶(50 U/μL)0.5 μL,DNA模板100 ng,超純水40 μL。PCR擴增條件為:95 ℃,5 min;95 ℃,30 s;60 ℃,30 s,28個循環;72 ℃,90 s;72 ℃,10 min。將PCR產物以2%的瓊脂糖凝膠電泳進行混樣和純化。回收的產物以TruSeq?DNA PCR-Free Sample Preparation Kit試劑盒構建文庫,并使用NovaSeq 6000進行上機測序。
1.3.4 生物信息學分析
將下機數據截去標記條帶和引物后,對得到的reads進行拼接。將得到的原始數據進行過濾和質控得到最終有效序列。以97%的一致性將有效序列聚類成可操作分類單元(operational taxonomic units, OTU),并進行物種注釋。以MUSCLE軟件(版本3.8.31)進行多序列比對并確立系統發生關系。將均一化的樣本數據以Qiime軟件(版本1.9.1)計算香農和Chao1指數,并計算weight Unifrac距離和構建UPGMA樣本聚類樹。主坐標分析(principal coordinate analysis, PCoA)使用R(版本3.6.3)軟件的WGCNA、stats和ggplot2軟件包。PCoA圖中3個相同的點代表3個平行,PC1和PC2分別是2個解釋度最高的主成分,樣品間的距離表示細菌群落的差異。線性判別分析得分設置為3.5,以篩選出樣品組的生物標記選出相對豐度大于0.05 %的菌屬為節點,計算Spearman相關性以過濾掉關聯性較弱的節點(P>0.7,P<0.01)。以Gephi-0.9.2軟件重構生態共發生網絡,其中重構網絡中的節點為關聯性較高的菌屬,連接節點的邊對應節點之間的相關性,隨后計算了網絡的聚類系數。
1.3.5 揮發性成分檢測
固相微萃取條件:選用50/30 μm DVB/CAR萃取頭,在20 mL頂空瓶中加入4 mL發酵樣品和1.5 g NaCl,60 ℃預熱20 min,插入萃取頭,萃取吸附20 min,GC解吸5 min(250 ℃)。
色譜條件:色譜柱為Rtx-5色譜柱(30 m×0.25 mm,0.25 μm)。升溫程序:35 ℃保持4 min,以5 ℃/min的速度升溫至150 ℃,恒溫保持4 min,然后以3 ℃/min的速度升溫至220 ℃,保持5 min。載氣He,流速1.0 mL/min,不分流進樣。
質譜條件:EI離子源,電子能量70 eV,離子源溫度230 ℃,質量掃描范圍m/z35~500 u。
1.4 數據分析
利用保留指數(retention index, RI),并結合NIST14譜庫檢索進行定性分析。將C6~C30正構烷烴混合物單獨進樣,進樣量1 μL,升溫程序和GC-MS檢測條件一致。保留指數計算如公式(1)所示:
(1)
式中:RI,保留指數;n,未知物流出前正構烷烴的碳原子數;t′(n),具有n個碳原子的正構烷烴調整保留時間,min;t′(n+1),具有n+1個碳原子的正構烷烴調整保留時間,min;t′(i),待測組分的調整保留時間,min。隨后以峰面積比值法對揮發性成分進行定量[8]。
顯著性分析由SPSS 25執行。其中,香農和Chao1指數的顯著性分析由單因素ANOVA檢驗執行,標注的不同的字母代表顯著差異(P<0.05)。揮發性成分的顯著性分析由Kruskal-Wallis秩和檢驗執行,并以FDR進行多重檢驗矯正。風味代謝物與微生物組之間的相關性由SIMCA-14.1構建的O2PLS模型表征。同時,以R軟件(版本 3.6.3)計算了風味成分和核心菌群的Spearman相關性系數。
2 結果與分析
2.1 蘑菇的主要營養物質
從表1可知,每種新鮮蘑菇的含水量都在90 g/100 g以上;總灰分含量最低的是雙孢菇(8.12 g/100 g),最高的是杏鮑菇(14.25 g/100 g)。新鮮蘑菇中蛋白質的含量占約3%,雙孢菇含有最高量的粗蛋白,猴頭菇和草菇其次,在植物中屬于蛋白質含量比較高的食品。蘑菇作為低脂肪食品,其粗脂肪含量僅占1%左右。蘑菇中供能的單糖、雙糖、淀粉類糖含量少,但含有比例較高的功能性多糖和膳食纖維。多糖是蘑菇的重要功能性物質,具有抗氧化、抗腫瘤、降血糖、抑菌等生理活性。猴頭菇較高的多糖含量(4.21 g/100 g)可能更加利于發酵益生菌的利用。
氨基酸是食物風味的主要來源,蘑菇蛋白質含量是植物性食品中比較高的。根據表2可以看出,呈鮮味的氨基酸占比在總氨基酸的30%以上。各個呈味氨基酸濃度均大于其對應閾值,對醬油鮮味有較高貢獻。草菇和猴頭菇鮮味氨基酸占比最高,豐富的鮮味氨基酸是醬油發酵不可或缺的物質。
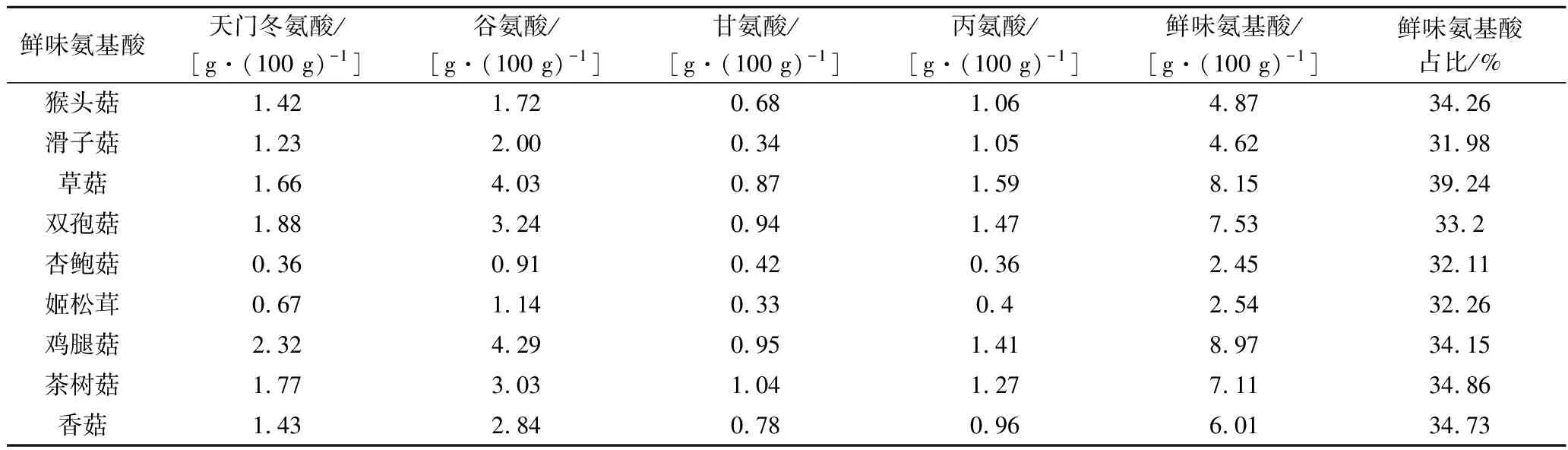
表2 蘑菇中呈鮮味氨基酸的含量Table 2 Content of umami amino acids in mushrooms
2.2 蘑菇醬油的宏觀微生態
分別以香農和Chao1指數表征蘑菇醬油的多樣性和豐富度(圖1-a)。與大豆醬油相比,猴頭菇醬油中細菌的多樣性和豐富度顯著降低(P<0.05)。因為猴頭菇本身特有的cyathane型二萜類次級代謝產物,如猴頭菇素C和猴頭菇素P,具有強烈的抗菌活性[9]。與之相反的是,香菇醬油中細菌的多樣性和豐富度顯著高于對照(P<0.05)。香菇所攜帶的原始菌群,有助于有機質的降解和菌絲的生長,這為其他細菌提供了營養活性物質[10]。其他蘑菇醬油的多樣性和豐富度與大豆醬油相比都出現了一定的變化(P>0.05)。蘑菇的添加為醬油發酵提供了豐富的菌體蛋白和蘑菇多糖,這誘導蘑菇醬油和傳統大豆醬油的菌群出現偏移。

a-多樣性差異;b-組成差異圖1 蘑菇醬油細菌的多樣性和組成差異Fig.1 Diversity and composition difference of bacteria in mushroom soy sauce
細菌群落結構的主坐標分析驗證了蘑菇醬油的菌群特點(圖1-b)。與多樣性和豐富度的分析結果一致,猴頭菇醬油的細菌群落是與其它醬油分離的。基于猴頭菇的抗菌性,可能形成了某一優勢且單一的菌群,并主導了醬油的發酵。其次,草菇、茶樹菇和姬松茸醬油的發酵菌群各不相同,這是蘑菇醬油風味多樣化的前提。而雞腿菇、杏鮑菇、雙孢菇和滑子菇醬油的細菌群落在主坐標PC1(68.02%)上與大豆醬油是相似的,這些蘑菇對細菌群落的干預性較低。香菇雖然顯著提高了細菌的多樣性和豐富度,但香菇醬油的菌群結構依舊與大豆醬油類似。這意味著香菇雖然促進了菌群的繁殖,但這些菌群并不是醬油的核心發酵菌群。
2.3 蘑菇醬油的微觀系統型
如電子出版附件1所示,Firmicutes和Proteobacteria是蘑菇醬油的兩大主導菌門,這與傳統大豆醬油的檢測結果是一致的,蘑菇添加并不會破壞醬油菌群的系統型[11]。滑子菇、雙孢菇和杏鮑菇對醬油菌群的改良作用并不明顯,它們和大豆醬油一樣都被Proteobacteria 占據了主導地位。Proteobacteria 被認為是生物胺合成基因的主要攜帶者,這可能會降低醬油的品質[12]。而這種現象在姬松茸、茶樹菇、香菇和雞腿菇醬油中得到了改善。這些醬油中出現了豐富的Euryarchaeota和Cyanobacteria。Euryarchaeota通常是具有嗜鹽和嗜酸特性的高抗逆細菌并且具有潛在的揮發性烷烴生產能力[13]。此外,Cyanobacteria和乳酸菌的協同發酵為姬松茸醬油提供了降血脂和抗肥胖的保健功能[14]。醬油發酵主要的菌屬Bacillus、Listeria、Lactobacillus、Lactococcus、Staphylococcus、Roseburia等,都屬于Firmicutes菌門,是醬油發酵的風味細菌,即在醬油發酵過程中的次生細菌。乳酸菌可以分解代謝醬醪中的碳水化合物產生乳酸等有機酸,降低醬醪的pH值,不僅能夠抑制致病菌的生長繁殖還可以為后期酵母菌生長創造有利環境。Staphylococcus是肉類發酵食品產生風味物質的主要風味細菌。Bacillus產生的蛋白酶和淀粉酶可以分解蛋白質和淀粉類物質。復雜化合物的分解是影響發酵食品的關鍵步驟。在系統型變化最顯著的草菇和猴頭菇醬油中,Firmicutes取代Proteobacteria成為了主導菌門,而Firmicutes的豐富性通常是高品質發酵食品的必要條件[15]。
菌群共發生網絡展示了各系統型聚類中菌群的協作方式(見電子出版附件1)。草菇和猴頭菇構成的細菌菌群聚類Ⅰ由Stenotrophomonas輔以Staphylococcus和Bacillus維系連通性。但屬于Proteobacteria的各個菌屬和Firmicutes的節點多為負相關,這表明草菇和猴頭菇醬油中的Firmicutes,特別是Staphylococcus和Bacillus對致病菌Stenotrophomonas具有抑制作用。這和Proteobacteria的動態變化通常與Firmicutes呈負相關的結論一致[16]。大豆醬油與杏鮑菇、雙孢菇、滑子菇醬油菌群構成的系統型聚類Ⅱ的聚類系數最低(0.47),遠小于聚類Ⅰ(0.59)和聚類Ⅲ(0.86)。因此,聚類Ⅱ的菌屬協作性較弱。這導致菌群穩態相對較差,并且醬油的發酵進程易被外界環境改變,且醬油品質可控性降低。姬松茸、茶樹菇、香菇和雞腿菇醬油中的優勢菌屬Stenotrophomonas、Staphylococcus、Faecalibacterium和Bacillus在聚類Ⅲ的連通度并不高。核心發酵菌可能在這些醬油的發酵中單獨發揮作用,因而缺乏了對Stenotrophomonas和Staphylococcus中潛在致病菌的抑制作用。然而,聚類Ⅲ中多樣的非優勢菌屬卻連通成了獨特的“小世界”形態[17]。這可能與醬油的特征風味的形成有關。
2.4 蘑菇醬油的細菌菌群
核心的細菌發酵菌屬如圖2-a所示,除了猴頭菇、草菇和雞腿菇醬油,其他醬油都以Stenotrophomonas為主導菌屬。這與Stenotrophomonas在共發生網絡中受多重發酵菌群抑制的現象一致。Stenotrophomonas的β-半乳糖苷酶可以分解大豆和蘑菇產品中的抗營養因子,從而提高機體對營養物質的吸收效率[18]。但是,Stenotrophomonas的賴氨酸脫羧酶可將賴氨酸轉化為1,5-戊二胺,這可能會對醬油的感官評估和安全性產生負面影響。Staphylococcus是草菇和雞腿菇醬油的優勢菌群也是滑子菇醬油的生物標記之一。Staphylococcus分解葡萄糖、麥芽糖和蔗糖并產酸,是醬油發酵的主要驅動者之一[19]。大多數Staphylococcus(Staphylococcusaureus除外)被認為對人類無害,基于其高抗滲透性,醬油發酵時鹽溶液的添加不會抑制Staphylococcus的活性[20]。此外,Staphylococcus可以產生揮發性脂肪酸,促進醬油風味的形成[20-21]。Bacillus主導了猴頭菇醬油的細菌群落。由于其對淀粉和蛋白質的高效酶解作用,Bacillus被認為是醬油發酵中必不可少的細菌群落[22]。Bacillus是淀粉酶,特別是α-淀粉酶的優良生產者。通過水解淀粉分子鏈中的α-1,4-葡糖苷鍵,α-淀粉酶可以將淀粉轉化為短鏈糊精,麥芽糖和葡萄糖[23-24]。特別的,Macellibacteroides和Methanosaeta是香菇醬油的生物標記,并且它們是聚類Ⅲ中“小世界”結構的主要貢獻者(見電子出版附件1)。據報道,Macellibacteroides可以協作Arcobacter、Acinetobacter、Petrimonas和Clostrium起到促游離脂肪酸釋放的作用,這可能是“小世界”結構的潛在功能。此外,Methanosaeta可能是香菇醬油中揮發性烷烴成分的主要貢獻者[25]。Sphingomonas是雙孢菇醬油菌群的生物標記,其可以降解單環芳烴、聯苯、取代芳香化合物及多環芳香烴,并且苯甲酸可以通過Sphingomonas代謝生成乙醛和丙酮酸鹽,這增加了雙孢菇醬油的水果香氣。

a-核心菌屬;b-生物標記圖2 蘑菇醬油的核心菌屬和生物標記Fig.2 Core bacteria and biomarkers of mushroom soy sauce
2.5 蘑菇醬油的風味組分
各種蘑菇醬油間濃度差異顯著的風味成分如圖3所示。與大豆醬油相比,蘑菇醬油主要上調了酯類和醇類香氣組分。蘑菇醬油中的酯類物質,如苯乙酸乙酯、油酸乙酯、α-戊基-γ-丁內酯、棕櫚酸甲酯、亞油酸甲酯和安息香酸乙酯普遍升高,因此蘑菇醬油具有更濃郁的果香和花香風味。特別的,只有雙孢菇和杏鮑菇醬油檢測到了亞麻酸乙酯(酯香)。而豐富的亞油酸乙酯為茶樹菇提供了酯香的同時,也賦予茶樹菇醬油抗動脈粥樣硬化的保健功能。而具有蠟香和奶油香氣的十六碳酸乙酯是雙孢菇和茶樹菇醬油的特征風味成分。

圖3 蘑菇醬油的特征風味成分Fig.3 Characteristic flavor components of mushroom soy sauce
對于醇類香氣,2-甲基-1-丁醇、蘑菇醇和異丁醇是蘑菇醬油普遍上調的風味物質。而具有玫瑰花香的苯乙醇是蘑菇醬油上調最顯著的風味成分,特別是在杏鮑菇醬油中。異戊醇具有蘋果和白蘭地的香氣,這是草菇醬油的特征香氣。2,3丁二醇和乙醇分別在滑子菇和香菇醬油中顯著提升,這為醬油增添了醇香。特別是與大豆醬油相比,乙醇在香菇醬油中提高了31.82倍。
此外,蘑菇的添加對酮、醛、酸和吡嗪類特征風味物質形成的干預性較小。蘑菇醬油對具有風信子香氣的苯乙醛和焦糖味的異戊醛的生成具有普遍的促進作用。有趣的是,添加蘑菇發酵將剝奪醬油中具有橙子香氣的D-檸檬烯成分,這可能是因為微生物的發酵作用將烯烴類成分氧化成了酯類。
2.6 核心細菌菌群對風味的貢獻
如電子出版附件2所示,O2PLS模型(R2=0.966,Q2=0.895)表征了核心細菌菌群和風味成分之間的相互作用。模型預測結果與菌群的系統型聚類分析一致,蘑菇醬油在橫坐標R2X[1]上出現了3種風味醬油的聚類。而作為對照的傳統大豆醬油則位于O2PLS模型的中心,因此與蘑菇醬油相比,大豆醬油是缺乏風味特點的。杏鮑菇、雙孢菇和滑子菇的風味特點主要由酯類成分貢獻,包括9-十六碳烯酸乙酯、油酸乙酯、硬脂酸乙酯、安息香酸乙酯、α-戊基-γ-丁內酯、鄰二甲苯酸二丁酯和9,12-十八碳二烯乙酯。而這些酯類被預測與醬油中生物標記Roseburia和Sphingomonas的代謝有關。茶樹菇和姬松茸醬油雖然有著和雞腿菇和香菇類醬油類似的菌群系統型,它們依舊被O2PLS模型的R2X[2]坐標分開。茶樹菇和姬松茸的風味成分主要與Vibrio、Cyanobacteria和Psychrilyobacter的代謝相關,而這些細菌主要來自于發酵的外界環境。因此,茶樹菇和姬松茸醬油形成的特征酸味成分2-甲基丁酸和異戊酸主要受環境因素的調控。相反,具有相同系統型的雞腿菇和香菇醬油則以包括棕櫚酸異丁酯、棕櫚酸異丙酯、辛酸乙酯和正己酸乙酯在內的酯類香氣為主,因為Faecalibacterium對短鏈脂肪酸的消解具有促進作用,并且是系統型聚類Ⅲ互作網絡的主要維系者。如電子出版附件1所示,Faecalibacterium通過與Lactobacillus、Enterococcus和Streptococcus等多種乳酸菌的直接或間接協作促進了雞腿菇和香菇醬油酯類風味成分的形成。與其他蘑菇相比,系統型Ⅰ中草菇和猴頭菇醬油的菌群與大豆醬油差異最顯著,這直接導致了草菇和猴頭菇醬油的獨特的風味成分構成。豐富的酯類、醇類、醛酮類和芳香雜環類成分共同構成草菇和猴頭菇的風味特征。這種現象一方面歸因于優勢發酵菌Staphylococcus和Bacteroides的發酵驅動作用,另一方面是因為非優勢菌群Methanosaeta和Macellibacteroides通過與其他菌群的協同作用參與了發酵。
Spearman相關性系數(|Ρ| ≥ 0.7)被用于進一步發掘菌群對風味物質形成的驅動作用(電子出版附件2)。Staphylococcus主要促進了酯類和醇類成分的形成。這與Staphylococcus可以促進揮發性脂肪酸的生成并促進其酯化反應的進行的結論一致[19-20]。Enterobacter主要與蘑菇醬油中酮類物質的生成有關。但Enterobacter并非優勢菌群,且協作性也不高,這限制了其作用的發揮,并導致酮類成分并沒有在蘑菇醬油中大幅度上調。Stenotrophomonas對幾種代表性的酯類、醛類、酸類和酮類呈負相關,但草菇和猴頭菇醬油中優勢菌群Staphylococcus和Bacillus與其他非優勢菌群共同參與了對Stenotrophomonas的抑制,因此醬油香氣成分的產生并未受影響。其他優勢菌如Cyanobacteria、Bacillus、Psychrilyobacter和Bacteroides的主要貢獻也是針對于酯類的形成。特別的,Vibrio和Psychrilyobacter可能促進了正癸醛和異丁醛的形成,這可以彌補蘑菇醬油中缺乏的橘皮的清甜氣味。
3 結論與討論
蘑菇醬油發酵的細菌群落區別于傳統大豆醬油,這導致蘑菇醬油的酯類和醇類風味物質更為濃郁。杏鮑菇、雙孢菇和滑子菇醬油的發酵細菌群落與大豆醬油最為接近,但作為生物標記的Roseburia和Sphingomonas可以強化蘑菇醬油中9-十六碳烯酸乙酯、油酸乙酯、硬脂酸乙酯等特征酯類組分的產出。猴頭菇和草菇對醬油菌群的干預性最大,而發酵細菌的遷移是揮發性風味組分多元化的前提。優勢菌Staphylococcus和Bacteroides的發酵驅動作用以及非優勢菌群Methanosaeta和Macellibacteroides的協同發酵模塊造就了猴頭菇和草菇醬油中酯類、醇類、醛酮類和芳香雜環類成分的多元化。茶樹菇、姬松茸、雞腿菇和香菇醬油具有相近的細菌系統發育型。發酵環境中的Vibrio、Cyanobacteria和Psychrilyobacter的代謝與茶樹菇和姬松茸醬油的特征酸味成分2-甲基丁酸和異戊酸密切相關。在雞腿菇和香菇醬油發酵中,Faecalibacterium通過與Lactobacillus、Enterococcus和Streptococcus等多種乳酸菌的協同發酵作用促進了酯類特征風味成分的形成。蘑菇醬油發酵時細菌系統發育型和共發生特點調控了醬油的風味物質的產生,但蘑菇并不會破壞傳統大豆醬油發酵的宏觀菌門Firmicutes和Proteobacteria的主導地位,這是在保證醬油品質基礎上進行特征香氣提升的必要條件。該研究為新型醬油的研發和蘑菇醬油的改進奠定了基礎。

