旱半夏組培苗遺傳穩定性ISSR分析
喻 娜,黃勇盛,黃 旭
(廣安職業技術學院,四川廣安 638000)
旱半夏(Pinellia ternata)也稱為半夏、三步跳、麻芋等,天南星科半夏屬多年生草本植物[1]。旱半夏是一種重要的中藥材,塊莖入藥,塊莖的成分75%左右為淀粉,除此之外還含有β-谷甾醇-D-葡萄糖甙、半夏蛋白、鞣質、生物堿、多種氨基酸、原兒茶醛及18 種微量元素等藥用成分[2-5]。旱半夏具有鎮咳、祛痰、降壓、健脾胃、止嘔吐、降脂、抗心律失常、抗壞血栓、抗腫瘤、抗炎、抗菌、抗癲癇、減輕動脈粥樣硬化等藥理作用,在我國中醫藥史上有著廣闊的前景[6-9]。
已有研究表明,在植物組織培養過程中,體細胞無性系在分子水平或染色體水平的變異是普遍存在的一種現象[10]。近年來,簡單重復序列間區(inter simple sequence repeat,ISSR)標記技術常常應用于動植物的親緣關系和遺傳多樣性進行分析,并在遺傳學研究中發揮著重要的作用。ISSR技術已成為DNA分子標記技術中的一個熱點,由Zietkeiwitcz 等[11]于1994年提出,它是在簡單重復序列(simple sequence repeat,SSR)基礎上發展起來的1 種新型分子標記技術。該技術結合了SSR 和RAPD 技術的優點,具有操作簡單、試驗穩定性好、多態性豐富、重復性強、DNA 模板用量少和實驗成本低等優點[12-15],已廣泛應用于種群間或種群內的遺傳多樣性、遺傳差異性、遺傳穩定性分析,對了解種群遺傳變異的大小、時空分布及其與環境變化和人類活動的關系,了解藥用植物種群起源、進化歷程和現今分布格局,以及開展藥用植物種質資源育種和采取科學有效的保護措施均具有指導意義[16-18]。
此前,已有將分子標記法應用到天南星科植物領域的遺傳學分析中的研究,如鄧瑞寧利用SRAP 技術對10種不同葉形荊半夏的遺傳多樣性及親緣關系進行了分析[19],成玉等應用AFLP 技術探討半夏屬五個種的親緣關系[20],但對旱半夏組培苗遺傳穩定性的研究還未見報道,本項目采用ISSR分子標記法對旱半夏組培苗繼代五代苗、八代苗、十一代苗、五十代混合組培苗、六十代混合組培苗進行遺傳穩定性分析,以期進一步為旱半夏組培苗推廣種植提供理論依據。
1 材料與方法
1.1 試驗材料
本試驗材料采自四川省武勝縣萬民村(經緯度:106.431 56,30.375 21)野生旱半夏,將野生旱半夏移栽至花盆,帶回實驗室,以野生旱半夏葉片為外植體,經組培室誘導愈傷再生并繼代培養,將野生植株、繼代五代、繼代八代、繼代十一代、繼代五十代,繼代六十代組培苗作為供試材料。
1.2 DNA的提取和檢測
取旱半夏嫩葉和莖,利用《BioFastSpin 植物基因組DNA提取試劑盒》分別提取總DNA,電泳結果分析表明,電泳條帶整齊、明亮清晰、無拖尾現象,無蛋白污染,提取的旱半夏基因組DNA 質量較好,樣本適用于ISSR-PCR 檢測(見圖1)。將樣品放置在-20 ℃冰箱保存。

圖1 提取的旱半夏總DNA電泳檢測
1.3 PCR擴增
實驗用Biospin 全能型植物基因組DNA 提取試劑盒購買自杭州博日科技有限公司,其他普通化學試劑則購自南寧國拓生物科技有限公司,采用DL2000 Marker 作為分子量標準。引物是從加拿大哥倫比亞大學公布的100 條UBC-ISSR 引物中篩選出的6 條(見表1),篩選出來的引物由上海生工(San-gon)合成。在(Easy Cycler)梯度PCR 儀(德國,AnalytikJena)上進行PCR 反應,實驗使用20 μL 體系,10 μL Mix,1 μL 引物,1 μL DNA 模板,8 μL ddH2O,94 ℃預變性5 min;94 ℃變性30 s;56 ℃復性45 s;72 ℃延伸90 s;40 個循環:72 ℃延伸10 min,4 ℃保存。通過PAGE 電泳及銀染。在5200 Multi(上海天能)全自動化學發光/熒光圖像分析系統中記錄擴增結果。

表1 UBC引物系列
1.4 數據統計和分析
通過人工識別的方式統計旱半夏不同代數的凝膠電泳圖譜條帶數目。
2 結果與分析
2.1 ISSR-PCR擴增結果
圖2 是利用篩選出來的6 條引物對旱半夏野生苗和組培第五代、第八代、第十一代組培苗進行ISSRPCR 擴增的圖譜,野生型紙質同組培苗的帶型和亮度基本一致,第46條引物擴增出來的條帶中,組培苗出現了一條多態性條帶,組培苗第五代、第八代和第十一代的帶型和亮度完全一致,組培苗之間保持了一致(圖2-A、圖2-B)。ISSR 分子標記的分析結果表明,繼代到第十一代的旱半夏組培苗與野生型旱半夏苗基本沒有差異。
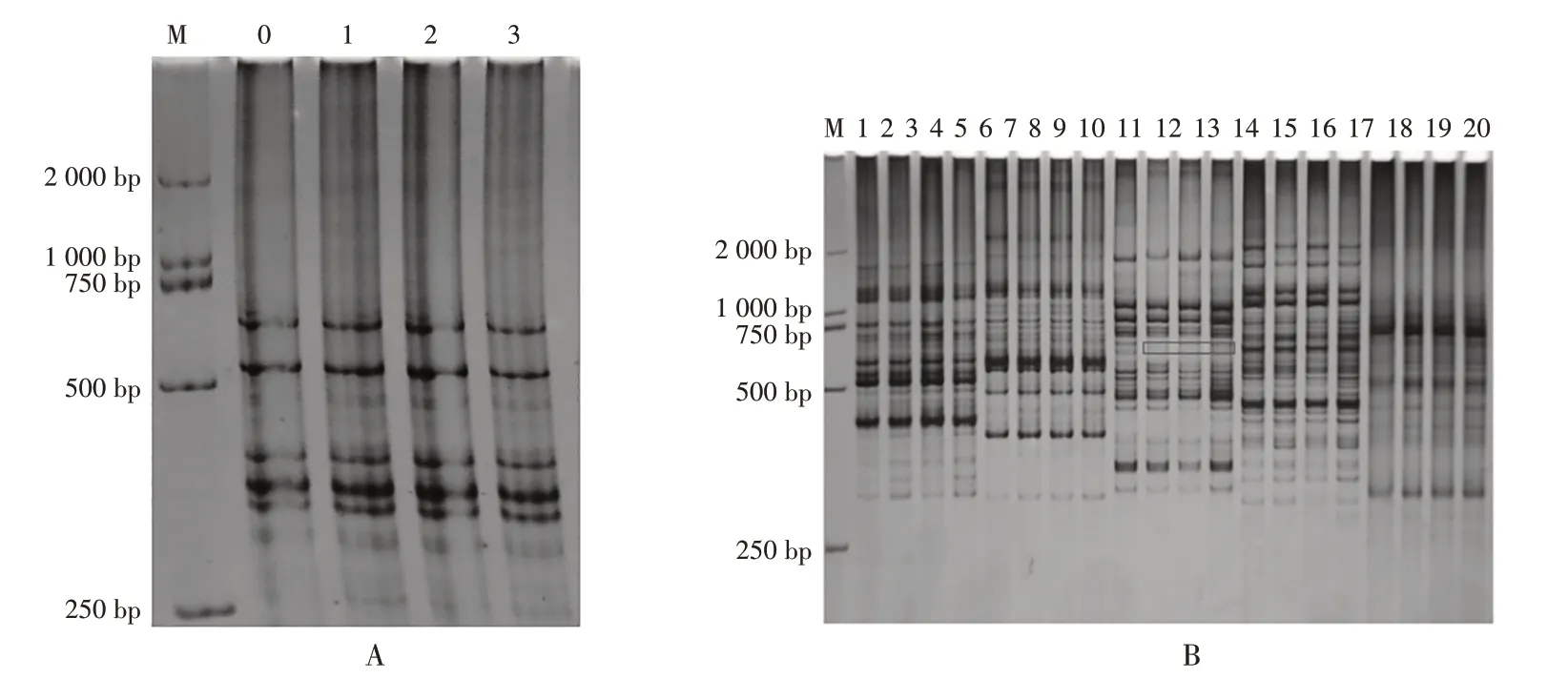
圖2 引物18、25、26、46、55、62在野生植株、第五代、第八代、第十一代組培苗ISSR-PCR擴增的條帶
圖3 是利用篩選出來的6 條引物對旱半夏野生苗和組培第五十代、第六十代組培苗ISSR-PCR 擴增的電泳圖譜。從圖譜中看,在旱半夏繼代的過程中,6條引物擴增出來的電泳圖譜基本和野生苗的帶型保持一致,沒有發生明顯變化。其中25 號引物和46 號引物擴增的第五十代和第六十代組培苗分別出現了一條特異性條帶,第五十代和第六十代組培苗之間完全保持一致(見圖3),因此可以認為旱半夏在六十代的繼代過程中具有較高的遺傳穩定性。

圖3 引物18、25、26、46、55、62在野生植株、第五十代、第六十代組培苗ISSR-PCR擴增的條帶
2.2 旱半夏野生植株與不同組培苗之間的遺傳差異性分析
篩選的6 條引物對旱半夏野生苗和組培第五代、第八代、第十一代的組培苗進行ISSR-PCR 擴增,總共擴增出110 條條帶,組培苗在擴增的幾代過程中電泳條帶帶型基本一致,其中46號引物擴增的條帶中發現,從組培苗第五代出現了一條多態性條帶,多態性比例僅僅只有0.88%(見表2)。
篩選的6條引物對旱半夏野生苗和組培第五十代、第六十代的組培苗ISSR-PCR擴增,總共擴增出116條多態性條帶,其中25 號引物和46 號引物擴增的第五十代和第六十代組培苗分別出現了一條特異性條帶,多態性比例為1.42%(見表3)。

表3 野生植株與第五十代、第六十代組培苗遺傳差異性
3 討論
對于藥用價值極高的旱半夏,采用組培技術進行快繁和生產,關鍵是保持其性狀。旱半夏組培苗一般通過外植體葉片或者莖誘導愈傷組織,然后再從愈傷組織分化出再生植株,整個培養和繼代的過程長期使用植物生長調節劑,使生長點分生組織長期處于活躍的狀態,可能引起變異。
對品種遺傳變異檢測傳統的方法主要是通過植物形態學進行鑒定和分析,但由于植株的很多基因水平的變異不一定表現出性狀,因此僅僅依靠形態學觀察很難準確的檢測。而采用ISSR分子標記技術快速、準確、操作簡單,可以從基因組DNA 的多態性信息分析,并直接從DNA 水平反映堿基序列片段的變化,因此,可以從分子水平上闡明組培苗遺傳穩定性的分子機理。
本研究應用ISSR 分子標記技術對旱半夏組培苗第五代、第八代、第十一代進行DNA 檢測,以及對在實驗室繼代了3 年的第五十代、第六十代苗分別混合批量進行ISSR 分析,得到的DNA 片段帶型基本一致,擴繁到六十代多態性僅僅在1.42%,證明組培苗在DNA 水平上基本保持了遺傳穩定性。這與前人關于草莓[21]、桉樹[17]、葉藝春蘭[22]等植物組培苗遺傳穩定性的研究報道一致。由此可見,將組培技術用于中藥材植物旱半夏的快速繁殖是可行的。

