梨廢渣發酵生產菌體蛋白的研究
柴云雷, 王 鵬, 張 晟, 劉麗美, 郭 麗
(綏化學院食品與制藥工程學院,黑龍江綏化152061)
梨皮含有豐富的礦物質、維生素、脂肪和蛋白質等,營養價值較高。 梨皮具有清心潤肺、降火生津等功效,常用于治療暑熱煩渴、咳嗽、吐血等癥狀。 梨核含有多種維生素,尤其是維生素B 含量較多,此外梨核中還含有蛋白質、糖類、阿拉伯膠和木質纖維等營養物質。 梨核的保健作用更優于梨肉,具有清熱去火、潤腸通便、保護肝臟、降低膽固醇、預防心臟病和防癌抗癌等功效(陳倩穎等,2021;張想等,2021;關玉婷等,2021)。
菌體蛋白又稱單細胞蛋白(SCP)或微生物蛋白,主要是指酵母菌、細菌、放線菌、藻類等單細胞微生物利用工農業廢氣、廢水、農副產品下腳料、有機垃圾等為營養基質, 在人工控制條件下培養得到的菌體蛋白質。菌體蛋白中蛋白質含量豐富,高達40% ~ 80%,且氨基酸種類齊全,因此常作為蛋白飼料的主要來源。 目前, 我國的蛋白飼料基本都是采用微生物發酵所得(王宇靈等,2019;趙彩艷等,2019; 劉雪蓮等,2009;Brahim,2005;Margareth,2001)。果渣中營養物質含量豐富,卻常被當做廢棄物丟掉,這不僅造成資源浪費,還會污染環境。因此為實現廢物的再利用,可將其作為菌體蛋白飼料的生產原料(潘雄等,2021;田志梅等,2019;胡聰等,2017)。為進一步開發菌體蛋白飼料的生產原料提供理論依據,本研究以梨廢渣(包括梨皮和梨核)為原料,釀酒酵母為菌種進行發酵試驗研究, 采用響應面設計法對發酵工藝條件進行優化,以期獲得較高菌體蛋白含量。
1 材料與方法
1.1 材料與試劑 梨:市售,梨皮切絲、梨核切塊后,65 ℃烘干24 h,粉碎過40 目篩,干燥保存備用;釀酒酵母(Saccharomyces cerevisiae):中國普通微生物菌種保藏管理中心; 酵母膏胨葡萄糖瓊脂(YPD)的液體培養基:青島高科園海博生物技術有限公司; 尿素: 天津市致遠化學試劑有限公司;硫酸銅:天津市天力化學試劑有限公司。
1.2 儀器與設備 101-2HSB 電熱鼓風干燥箱:北京科偉永興儀器有限公司;RHP-400 型高速多功能粉碎機: 浙江永康市榮昊工貿有限公司;ZWY-100H 恒溫培養振蕩器:上海智城分析儀器制造有限公司;XFH-30L 高壓蒸汽滅菌鍋: 浙江新豐醫療器械有限公司;Kjeltec2300 全自動凱氏定氮儀:丹麥FOSS。
1.3 試驗方法
1.3.1 發酵種子液的制備 YPD 液體培養基的制備:稱取培養基樣品50 g,加熱溶解于1000 mL蒸餾水中,121 ℃高壓滅菌15 min,備用。
在無菌操作環境下,從釀酒酵母菌斜面上挑取一環,接種于YPD 液體培養基中,28 ℃、180 r/min搖床培養24 h, 采用血細胞計數法測定細胞數,將細胞濃度調整為1×108cfu/mL (劉倩男,2016;劉壯壯,2014)。
1.3.2 梨廢渣固態發酵 稱取10 g 梨廢渣,20 mL蒸餾水于錐形瓶中, 并按試驗設計加入一定量的尿素, 攪拌至分散均勻,121 ℃高壓滅菌30 min后,備用。
取一定量的發酵種子液接種于梨廢渣固態發酵培養基中,28 ℃恒溫培養一定時間, 培養過程中適當攪拌,待發酵結束后將樣品在45 ℃下鼓風烘干,粉碎后測定其粗蛋白質含量(寇慧等,2021;Dey,2016;Leite,2016)。
1.3.3 粗蛋白質含量的測定 凱氏定氮法: 準確稱取1 g 烘干粉碎后的樣品,置于消化管內,加入CuSO40.4 g、K2SO46 g、濃H2SO420 mL 后,將消化管置于紅外線消化爐中,調節溫度400 ℃,至消化液完全澄清并呈綠色。消化結束后,用蒸餾水將消化液轉入100 mL 容量瓶并定容, 然后用移液管量取10 mL 稀釋后的消化液至干凈的消化管中, 放入凱氏定氮儀上進行蒸餾和吸收。 硼酸吸收后的樣液用0.1 mol/L 的HCl 標準溶液進行滴定,當樣液顏色由藍色變為微紅色時,即為滴定終點,記錄HCl 消耗的體積。 同時做一試劑空白試驗(除不加樣品外,從消化開始操作完全相同),記錄空白試驗消耗HCl 標準溶液的體積。
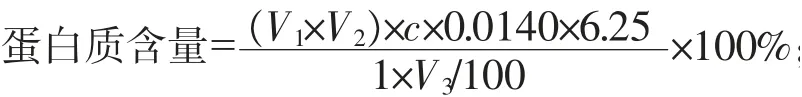
式中:V1為試液消耗鹽酸標準溶液的體積,mL;V2為試劑空白消耗鹽酸標準溶液的體積,mL;V3為吸取消化液的體積,mL;c為鹽酸標準滴定溶液濃度,mol/L;0.0140 為1.0 mL 鹽酸標準滴定溶液相當于氮的質量,g;6.25 為氮換算為蛋白質的系數。 菌體蛋白含量的計算:
菌體蛋白含量/%=X×X1;
式中:X為發酵后梨廢渣培養基中的蛋白質含量,%;X1為發酵前梨廢渣培養基中蛋白質含量,%。
1.3.4 單因素試驗設計(孫東立等,2021;懷寶東等,2020;黃裴,2017)。
1.3.4.1 尿素添加量對菌體蛋白含量的影響 梨廢渣培養基中尿素添加量分別為5%、6%、7%、8%、9%,釀酒酵母接種量為5%(V/m),28 ℃恒溫發酵3 d,攪拌3 次,發酵結束后測定粗蛋白質含量。
1.3.4.2 接種量對菌體蛋白含量的影響 梨廢渣培養基中尿素添加量為7%, 釀酒酵母的接種量分別為1%、3%、5%、7%、9%,28 ℃恒溫發酵3 d,攪拌次數為3 次,發酵結束后測定粗蛋白質含量。1.3.4.3 攪拌次數對菌體蛋白含量的影響 梨廢渣培養基中尿素添加量為7%, 釀酒酵母接種量為5%,28 ℃恒溫發酵3 d,攪拌次數分別為1、2、3、4、5 次,發酵結束后測定粗蛋白質含量。
1.3.4.4 發酵時間對菌體蛋白含量的影響 梨廢渣培養基中尿素添加量為7%, 釀酒酵母接種量為5%,28 ℃恒溫發酵時間分別為1、2、3、4、5 d,攪拌次數為3 次,發酵結束后測定粗蛋白質含量。
1.3.5 響應面優化試驗設計 在單因素試驗的基礎上,以菌體蛋白含量為響應值,對影響菌體蛋白含量的尿素添加量、接種量、攪拌次數和發酵時間4 個因素的3 個水平進行響應面優化試驗, 確定最佳發酵工藝條件,因素水平編碼見表1。

表1 響應面試驗因素水平及編碼
1.4 數據處理 采用響應面分析軟件Design-Expert 12.0 的Box-Behnken 中心組和原理進行試驗設計和數據分析。 采用OriginPro 8.5.1 軟件進行數據統計分析,每次試驗重復3 次,數據表示為“平均值±標準差”形式。
2 結果與分析
2.1 單因素試驗結果
2.1.1 尿素添加量對菌體蛋白含量的影響 氮源在酵母菌的生長中是不可或缺的, 試驗中采用尿素這一常用氮源。由圖1 可知,隨著尿素添加量的增加,菌體蛋白含量逐漸增加。原因可能是適量的氮源供給有利于微生物的生長繁殖, 也有利于微生物在細胞內合成氨基酸和堿基, 進而合成蛋白質。 當尿素添加量為8%時,菌體蛋白含量最高為5.49%。 當繼續增大尿素添加量時,菌體蛋白含量呈下降趨勢, 原因可能是發酵后期可利用碳源逐漸減少,造成碳氮比不合理,使微生物的生長受到抑制, 也可能是未被利用的尿素水解釋放出NH4+,使得發酵環境的pH 改變,菌體生長受到影響,從而使菌體蛋白含量下降。故選擇尿素添加量為8%為宜。
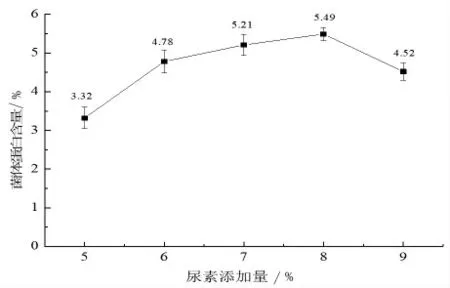
圖1 尿素添加量對菌體蛋白含量的影響
2.1.2 接種量對菌體蛋白含量的影響 適當的接種量有利于菌體的生長, 培養基營養成分的合理利用及產物的生成。 由圖2 可知,菌體蛋白含量隨接種量的增大呈先上升后下降的趨勢,當菌體接種量為5%時, 菌體蛋白含量最大,為5.03%。 分析原因可能是接種量較低時,發酵底物充足,但利用營養物質的微生物數量有限,使發酵底物得不到充分有效地利用, 因而菌體蛋白含量較低。 另外接種量較小,發酵菌種不能成為優勢菌種,還會導致雜菌的生長繁殖,也會對發酵不利;接種量較大時,營養物質消耗迅速,使微生物生長過于旺盛, 釋放大量的代謝熱導致周圍環境溫度升高,使菌體失活甚至死亡,同時代謝廢物也會大量積累, 這都不利于微生物的生長及蛋白的積累,導致菌體蛋白含量下降。故選擇接種量為5%為宜。
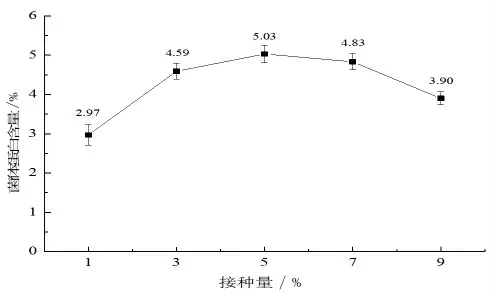
圖2 接種量對菌體蛋白含量的影響
2.1.3 攪拌次數對菌體蛋白含量的影響 攪拌次數的多少會影響錐形瓶中氧氣的多少, 即影響到培養基中溶氧的大小。由圖3 可知,菌體蛋白含量隨攪拌次數的增大呈先上升后下降的趨勢。 當攪拌次數為3, 產生的菌體蛋白含量最大,為5.42%。 分析原因可能是攪拌次數的增大會提高發酵過程的溶氧量。 釀酒酵母為兼性厭氧菌,但厭氧菌在有氧氣的條件下會生長更好, 因為在厭氧條件下,所產生的乙醇不能進一步代謝,而在好氧條件下,一旦糖已全被耗盡,酵母菌就重新利用它們所產生的的乙醇并把它氧化成二氧化碳和水。 即好氧條件下利用一定量的糖比厭氧條件下獲得更高的酵母菌量。但若攪拌次數過多,會對菌體細胞產生損傷,不利于菌體生長繁殖。因此選擇最適的攪拌次數為3 次。
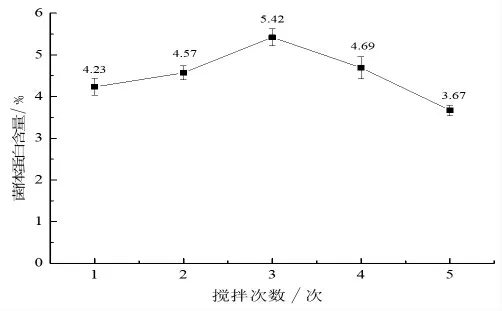
圖3 攪拌次數對菌體蛋白含量的影響
2.1.4 發酵時間對菌體蛋白含量的影響 發酵時間是影響菌體蛋白含量的重要因素, 發酵時間過短, 使培養基中的營養物質得不到有效充分的利用, 菌體生物量累積不足, 達不到理想的發酵目的;而發酵時間過長,營養物質會被大量消耗,造成營養不足,引起微生物的內源消耗,從而導致菌體自溶死亡,降低發酵產量,還容易滋生雜菌。 另外,發酵周期過長還會增加設備等運行維護成本。由圖4 可知,隨發酵時間的延長,菌體蛋白含量呈先增長后下降的趨勢。當發酵時間為3 d 時,菌體蛋白含量最大,為5.30%,且此時培養基無不良氣味及孢子的產生,所以發酵時間選擇3 d 為宜。
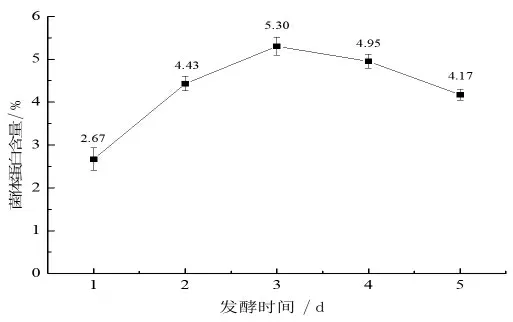
圖4 發酵時間對菌體蛋白含量的影響
2.2 響應面優化試驗結果
2.2.1 響應面試驗設計與結果 以尿素添加量、接種量、攪拌次數、發酵時間為自變量,菌體蛋白含量為響應值, 進行梨廢渣發酵菌體蛋白響應面方案設計, 試驗結果見表2。 將所得數據采用Design Expert 12.0 軟件進行多元擬合回歸分析,得到二次回歸方程:Y=5.65+0.2408A+0.2242B+0.1317C+0.1217D+0.16AB+0.0425AC+0.035AD-0.1325BC-0.06BD-0.195CD-0.4674A2-0.3349B2-0.3812C2-0.2162D2,相關系數R2=0.9668,說明有96.68%的數據可用此模型來進行表示,模型擬合度較好。
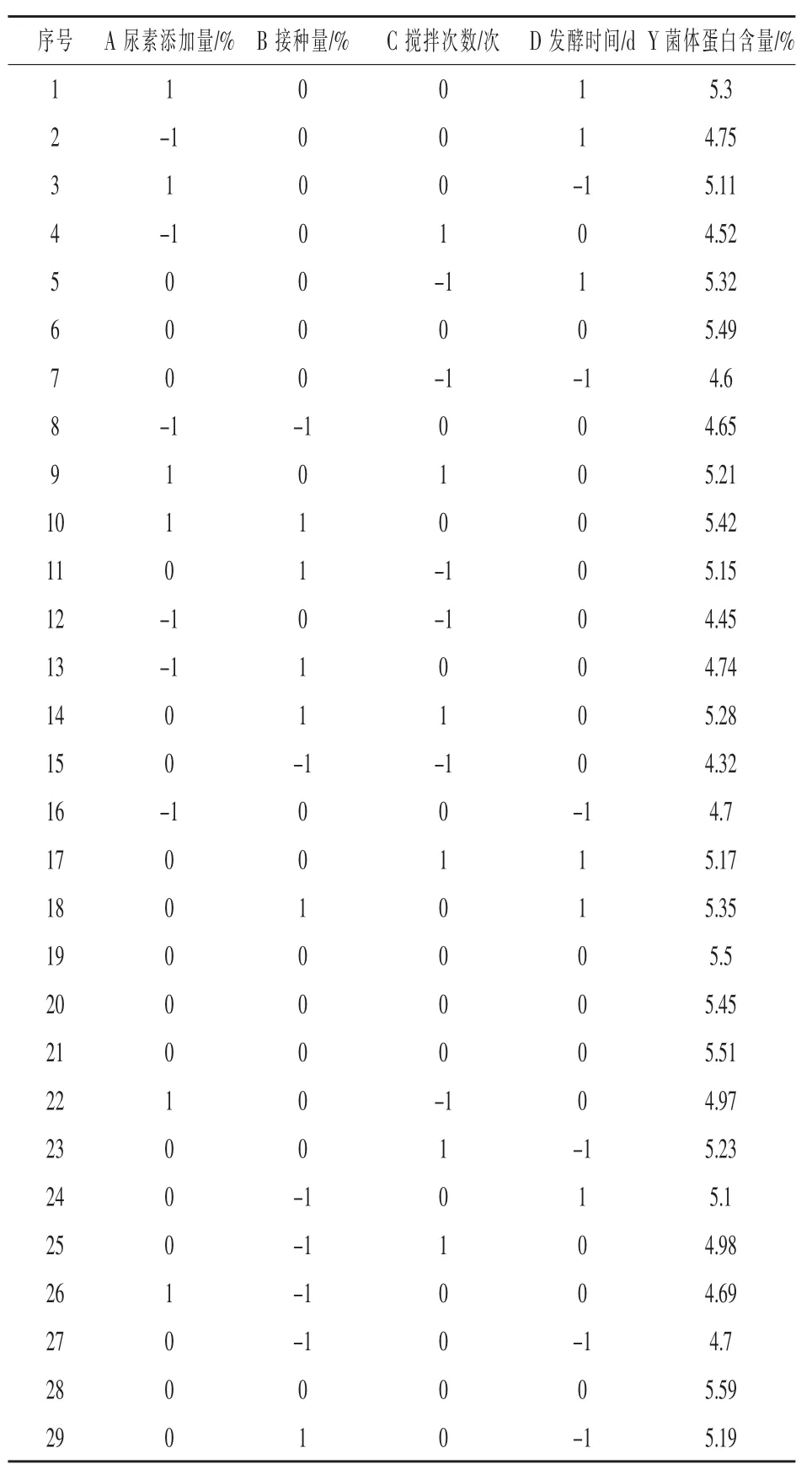
表2 響應面試驗設計及結果
根據表3 回歸模型方差分析可知,模型的P<0.0001,為極顯著,說明該方程能夠準確反映菌體蛋白含量與各因素之間的關系。 失擬項的P>0.05, 為不顯著, 說明模型與試驗的擬合程度良好,差異值較小。 根據F 值和P值大小可知,各因素對菌體蛋白含量的影響順序依次為A>B>C>D,即尿素添加量>接種量>攪拌次數>發酵時間。
2.2.2 雙因素交互分析 由表3 方差分析可知,尿素添加量和接種量以及攪拌次數和發酵時間的交互作用達到極顯著水平(P<0.01),說明其交互作用對菌體蛋白含量影響極顯著。 接種量和攪拌次數的交互作用對菌體蛋白含量影響顯著 (P<0.05)。 為更直觀形象的說明因素間的交互作用對響應值的影響,利用Design-Expert 12.0 軟件做交互項的響應面圖和等高線圖,如圖5 所示。
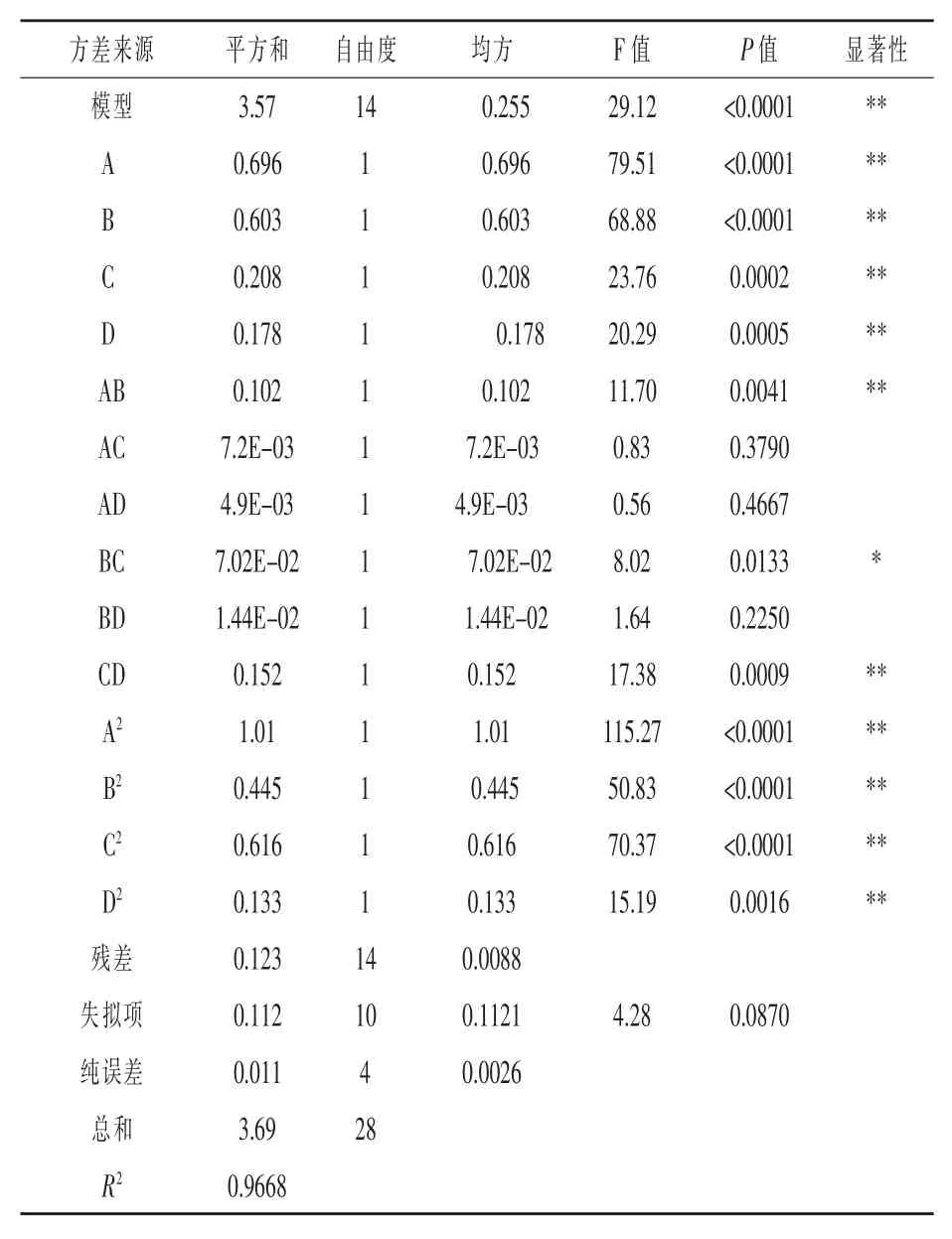
表3 回歸模型方差分析
響應面圖越陡峭、弧度越大,說明該因素對響應值的影響越明顯,反之亦然。 從圖5 可知,尿素添加量和接種量的曲線相對于攪拌次數和發酵時間的曲線較陡, 說明尿素添加量和接種量對菌體蛋白含量影響顯著。 接種量曲線比攪拌次數的曲線陡峭,且沿著接種量變化,等高線相對密集,說明接種量的影響比攪拌次數的影響大。 等高線圖可以依據其圖形的形狀來判斷其交互影響的程度,圖形為橢圓則說明交互現象明顯,反之亦然。從圖5 可知,三組圖形均呈扁平橢圓狀,說明它們對菌體蛋白含量的影響均顯著。 其中攪拌次數和發酵時間的交互作用最強, 其次是尿素添加量和接種量以及接種量和攪拌次數, 這些都與回歸方程的方差分析結果一致。
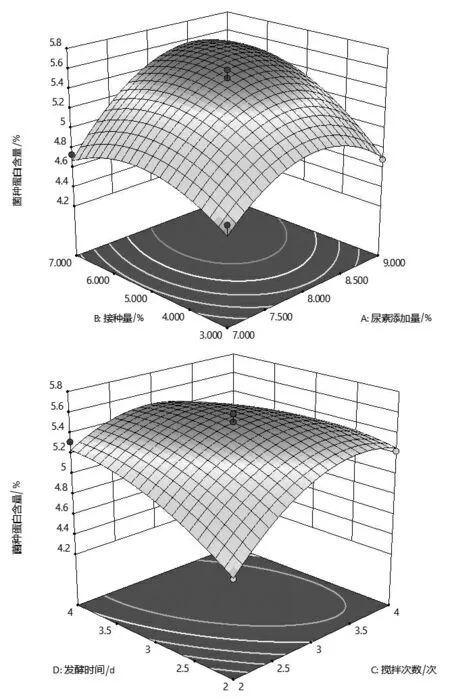
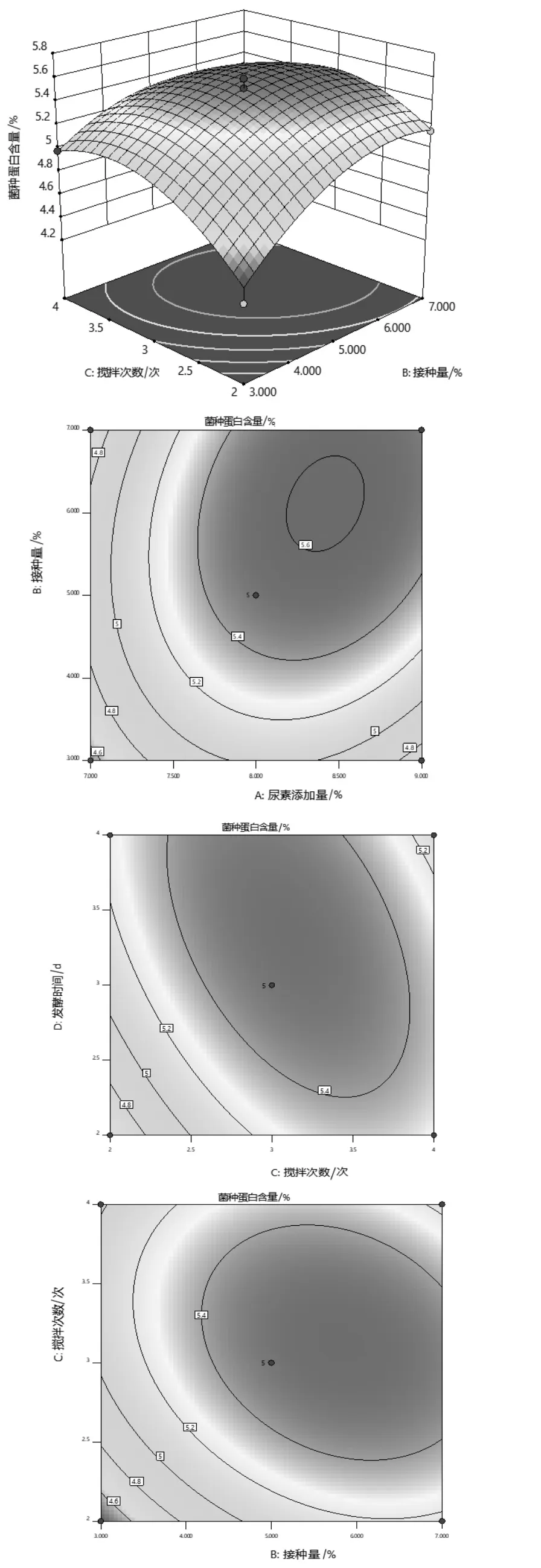
圖5 不同影響因素交互作用的響應面圖和等高線圖
2.2.3 最佳發酵工藝條件的確定 通過軟件進一步分析得出菌體蛋白的最佳發酵條件為:尿素添加量8.426%,接種量6.025%,攪拌次數3.021 次,發酵時間3.356 d,此時菌體蛋白含量為5.64%。 考慮到實際情況,將最終的發酵工藝條件修正為:尿素添加量8.4%,接種量6%,攪拌次數3 次,發酵時間3.35d,并在此條件下進行試驗驗證,重復試驗3 次取平均值,得到實際的菌體蛋白含量為5.62%。 該實際值與預測值相近,相對誤差僅為0.35%,說明由Box-Behnken 試驗設計所得的菌體蛋白的最佳發酵工藝條件準確可靠,具有可行性。
3 結論
本研究以梨廢渣為原料,釀酒酵母為菌種生產菌體蛋白,通過采用響應面分析法對發酵工藝進行優化。 在單因素試驗基礎上,以菌體蛋白含量為響應值,對尿素添加量、接種量、攪拌次數和發酵時間4 個因素進行Box-Behnken 試驗設計及優化。研究表明, 各因素對菌體蛋白含量的影響均極顯著,影響順序依次為尿素添加量>接種量>攪拌次數>發酵時間。 通過雙因素交互分析,得出尿素添加量和接種量以及攪拌次數和發酵時間的交互作用達到極顯著水平,對菌體蛋白含量影響極顯著。 優化得出的最佳發酵條件為: 尿素添加量8.4%, 接種量6%,攪拌次數3 次,發酵時間3.35 d,在此條件下產生的菌體蛋白含量為5.62%。 該研究為進一步開發菌體蛋白飼料生產原料提供理論基礎。

