利用生物信息學探討IL-8在慢性阻塞性肺疾病中異常表達及其相關基因的功能
張平安,高娜,陳明哲,李瀟寧,紀國超,吳建軍*
(1.北京中醫藥大學第三附屬醫院,北京 100029;2.河南中醫藥大學,河南 鄭州 450046)
慢性阻塞性肺疾病(chronic obstructive pulmo‐nary disease,COPD)簡稱慢阻肺,是以持續呼吸道癥狀和氣流受限為特征的慢性氣道炎癥疾病,發病過程中外周氣道、肺實質和肺血管中巨噬細胞、中性粒細胞以及包括Tc1、Th1、Th17和ILC3淋巴細胞等炎性細胞明顯增加,并釋放多種炎癥介質[1]。COPD 因其逐年升高的發病率,正逐漸成為影響人們健康的慢性疾病。2017 年全球疾病負擔研究指出,全球慢阻肺患者數約3 億人,從2007 年到2017年增長了24.9%[2]。研究證明COPD 存在持續的氣道與全身炎癥反應,炎性介質、免疫細胞以及趨化因子的水平可以預測COPD 的急性加重及預后[3]。而白介素8(IL-8)和腫瘤壞死因子受體(TNF-α),在AECOPD(acute exacerbation of COPD)和COPD 患者血清中的表達升高并且與COPD的嚴重程度呈正相關[4]。通過分析COPD 患者連續3 年每年發生≥1次AECOPD 的個體相關因素發現,COPD 頻繁急性加重表型與CT 表現的小氣道異常和白細胞介素8(IL-8)有關[5]。由此可知,IL-8可能通過參與炎癥反應而誘導慢阻肺的急性加重,而調控IL-8 則可能成為治療COPD的潛在或有效途徑之一。
2011年,有研究提出競爭性內源RNA(ceRNA)可以通過其miRNA反應元件作為miRNA海綿以調節其表達的假設[6]。近年有研究證明lncRNAs 具有ceRNAs 作用,并且在惡性和慢性疾病中發揮重要作用[7]。經研究發現miR-122-5p-A2M-LINC00987相互作用可能在COPD 中發揮重要作用[8],而miR-122-5p 又可能通過調節人血漿蛋白酶抑制劑(A2Mα2-巨球蛋白)以調節肺蛋白酶活性[9]。研究發現作為miRNA 調控的下游基因,白細胞介素(IL-8)可以通過調控ROCH 炎癥通路誘導氣道高反應性和促進氣道平滑肌痙攣,加重肺功能損害[10]。
但是目前IL-8在COPD的發病中其調控機制仍舊不明,因此本文擬通過GEO數據庫篩選與IL-8表達相關的轉錄組數據,探究IL-8表達調控相關的作用機制。
1 材料與方法
1.1 數據來源與預處理
本研究所采用的基因表達數據來源于GEO 基因表達綜合數據庫(https://www.ncbi.nlm.nih.gov/geo/)。慢阻肺患者和正常對照組mRNA 數據來源于GSE5058、GSE38974,miRNA 數 據 來 源 于GSE24709,lncRNA數據來源于GSE107426。
1.2 獨立秩和檢驗比較IL-8的表達差異
利 用R3.5.2 軟 件 的limma 包 對GSE5058、GSE38974 數據的IL-8 表達量進行獨立樣本秩和檢驗,而Wilcoxon 秩和檢驗是一種流行的非參數檢驗,用于比較2 個獨立的總體的差異以篩選差異基因,數據格式為慢阻肺患者和正常對照組模式[11-12]。
1.3 基因富集分析
將GSE5058、GSE38974 數據中的慢阻肺患者按照IL-8 的表達量進行從高到低排序。按照IL-8表達量的中位數將患者分IL-8 高表達組和低表達組。本研究用GSEA(version 3.0)軟件對表達矩陣進行分析,采用c5.all.v7.2.symbols.gmt 數據集,按照缺省參數設置進行GSEA,設定隨機組合次數為1000,|NES|>1,P<0.05 的基因集被認為是顯著富集的。
1.4 篩選IL-8 高表達的正負相關的差異基因,篩選差異miRNA、lncRNA,繪制IL-8環狀網絡圖
利用微生信在線數據平臺(http://www.bioin‐formatics.com.cn)繪制upset 圖,對GSEA 基因富集分析的GSE5058、GSE38974 數據中與IL-8 高表達呈正、負相關的基因取交集;利用R3.5.2軟件的相關limma 包對miRNA 數據集GSE24709 數據進行差異miRNA 的分析,利用lncRNA 數據集GSE107426 篩選差異lncRNA,篩選條件為log2foldchange<-1,P<0.05 的miRNA 被認為是顯著低表達;并利用miRWalk(http://mirwalk.umm.uni?heidelberg.de/)篩選與IL-8 相互作用的miRNA;利用StarBase3 平臺(http://starbase.sysu.edu.cn/)篩選與miRNA 互相作用的lncRNA,然后利用Cytoscape3.7.1 軟件繪制IL-8-miRNA-lncRNA網絡圖。
1.5 利用String 平臺篩選IL-8 高表達呈正負相關的關鍵基因
將IL-8 高表達呈正、負相關的基因輸入String平臺(https://string-db.org/)構建蛋白互作網絡(pro‐tein-protein interaction,PPI),選取“Homo sapiens”為蛋白屬種,最低相互作用閾值“medium confidence”(>0.15),其他參數設置為默認參數,獲取PPI蛋白互作網絡,利用Cytoscape3.7.1 軟件中MOCDE 插件進行關鍵基因的篩選,篩選條件為Node Score Cutff:0.2,K-Core:2,Max Depth:100。
1.6 關鍵基因進行GO和KEGG富集分析
利用R3.5.2軟件中的clusterProfiler包對篩選出的IL-8 高表達呈正、負相關的關鍵基因進行GO 和KEGG富集分析,篩選條件為矯正后的P值<0.05。
2 結果
2.1 GEO樣本數據統計
通過GEO 數據庫篩選出符合慢阻肺患者和正常對照組對比的mRNA 數據GSE5058 數據包含慢阻肺患者15 例,正常對照組患者24 例,GSE38974數據包含慢阻肺患者23 例,正常對照組患者9 例;miRNA 數據集GSE49881 數據包含慢阻肺患者41 例,正 常 對 照 組 患 者16 例;lncRNA 數 據 集GSE107426 包含慢阻肺患者1 例,正常對照組患者1例。如表1所示。

表1 數據集及分布情況Table 1 Data set and distribution
2.2 慢阻肺患者和正常對照組IL-8表達差異
通過對慢阻肺患者和正常對照組IL-8 表達的水平發現,IL-8 在慢阻肺患者中顯著高表達。其中GSE5058 數據中IL-8 的P值為0.000331,log2fold‐change=1.3084674,如圖1A 所示;GSE38974 數據 中IL-8 的P值 為0.000418,log2foldchange=2.2547985,如圖1B所示。
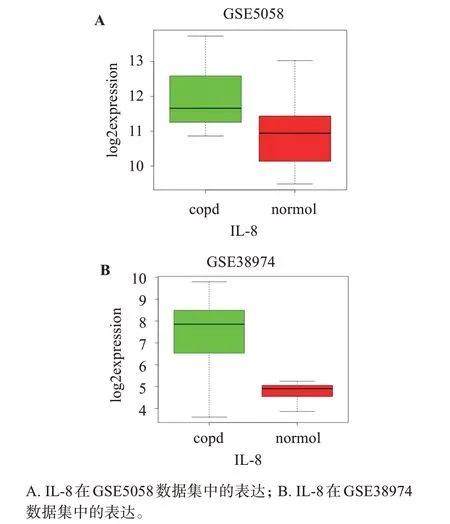
圖1 IL-8在GEO數據集中的表達Figure 1 Expression of IL-8 in GEO dataset
2.3 GSEA基因富集分析結果
利用GSE5058 和GSE38974 這2 個數據集中的慢阻肺患者基因表達矩陣,分別計算IL-8 與其他基因表達的相關性。GSEA 分析發現有47 條通路顯著富集在IL-8 高表達患者中。如表2 所示,高IL-8患者富集的通路主要涉及細胞轉化和一些受體信號通路。對排名為前2 的通路進行了展示(圖2 A、B)。其中GSE5058 數據集 篩選到314 個顯著與IL-8 表達相關的基因(147 個正相關,167 個負相關)。GSE38974 數據集篩選到2239 個顯著與IL-8 表達相關的基因(692個正相關,1547個負相關)。
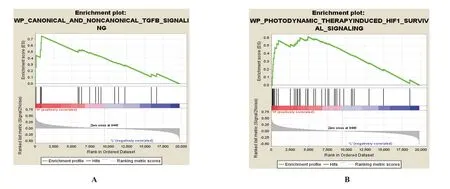
圖2 GSEA基因富集分析IL-8高表達顯著相關通路top2展示Figure 2 Top 2 pathways related to high expression of IL-8 by GSEA gene enrichment analysis
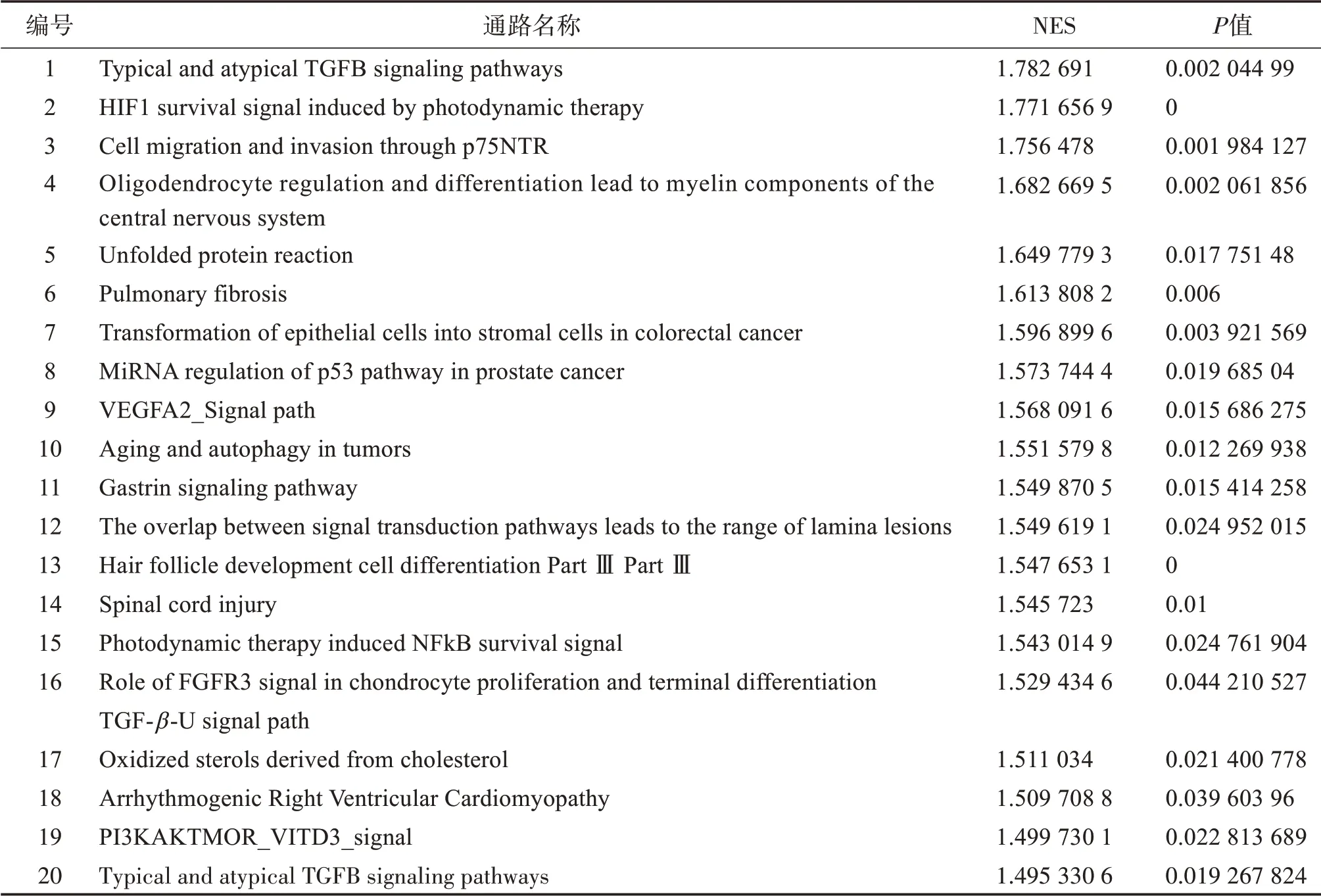
表2 IL-8高表達相關的前20條通路Table 2 Top 20 pathways related to high expression of IL-8
2.4 篩選IL-8 高表達呈正、負相關的基因,篩選差異miRNA,繪制相關網絡圖
通過微生信在線數據平臺(http://www.bioin‐formatics.com.cn)繪制upset 圖,對GSEA 基因富集分析的GSE5058、GSE38974 數據集中IL-8 高表達呈正、負相關的基因取交集,一共得到111 個相關基因(36 個正相關,75 個負相關,如圖3 A、B 所示);利用篩選得到的與IL-8相關的miRNA和miRNA相關的lncRNA 在Cytoscape3.7.1 軟件中繪制網狀圖,如圖3 C、表3所示,其中miRNA與mRNA呈負調控的關系;mRNA與lncRNA可競爭性作用于miRNA。

表3 差異miRNA和差異lncRNA表達結果Table 3 Differential miRNA and lncRNA expression results
2.5 利用String 平臺篩選差異基因蛋白互作網絡中的關鍵基因
通過String 平臺將IL-8 高表達呈正、負相關的基因的PPI 蛋白互作網絡并根據篩選條件得到IL-8表達相關的正相關基因有PTGS2、STAT3、IL1B、TNF、VEGFA等20 個;與IL-8 表達相關的負相關基因有PRKCZ、JUN、TGFB1、TP53、MAPK1等17 個,如圖3D、E所示
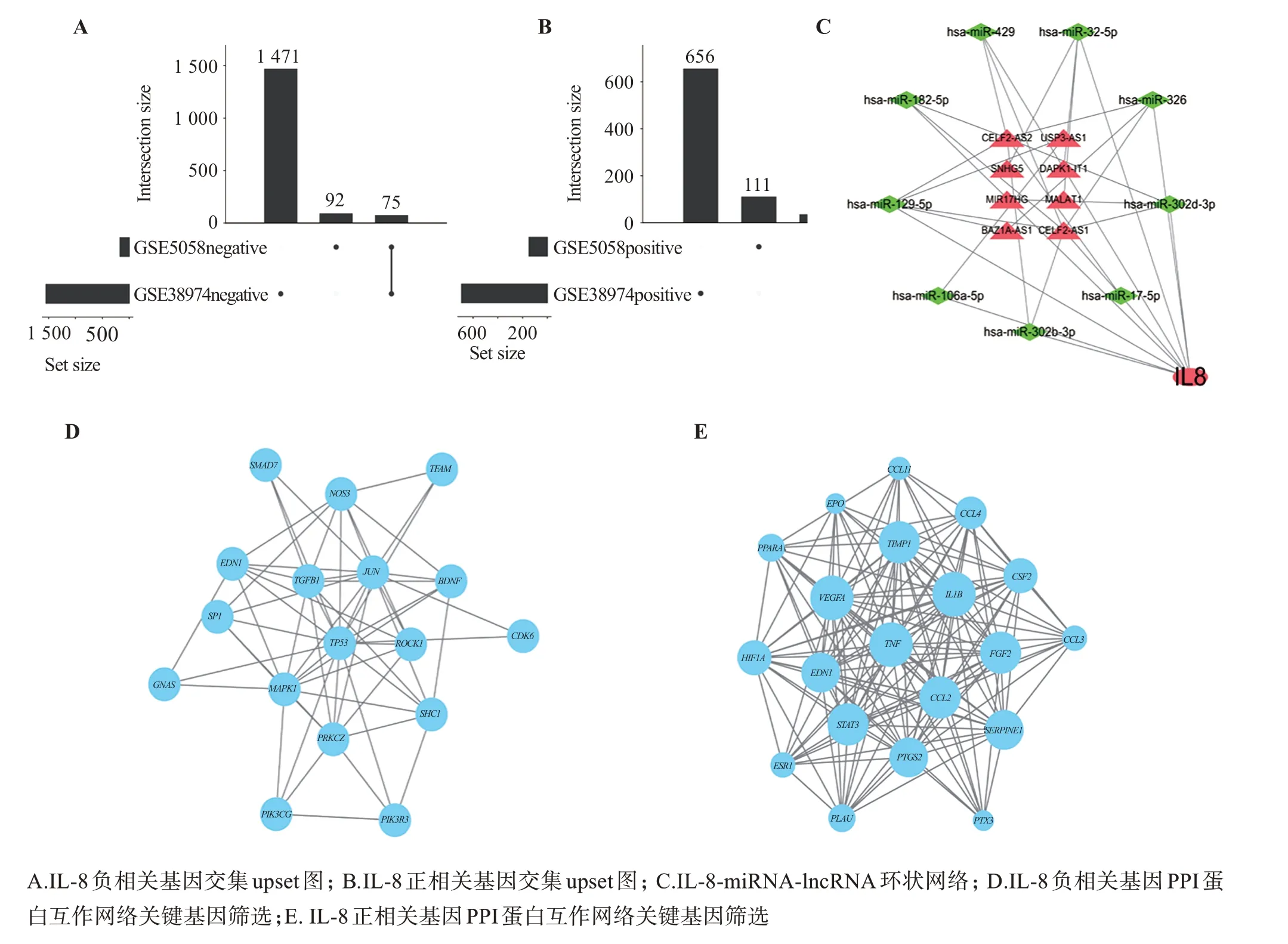
圖3 IL-8正負相關基因、IL-8-miRNA-lncRNA環狀網絡、IL-8正負相關基因PPI網絡關鍵基因篩選Figure 3 IL-8 positive and negative related genes,IL-8-miRNA-lncRNA ring network,and screening of key genes in PPI network of IL-8 positive and negative related genes
2.6 差異基因進行GO和KEGG富集分析
選取IL-8 表達正相關的基因進行GO 和KEGG富集分析,以分析IL-8 表達促進的功能(如圖4 C 所示)或通路(如圖4 D所示)。在GO功能方面上主要涉及細胞因子活性(cytokine activity)、G 蛋白偶聯受體結合(G protein-coupled receptor binding)、激素活性(hormone activity)、激素受體結合(hormone receptor binding)、趨化因子受體結合(chemokine receptor binding)等通路的調控;KEGG 富集分析集中在IL-17信號通路(IL-17 signaling pathway)、腫瘤壞死因子信號通路(TNF signaling pathway)、NF-κB信號通路(NF-kappa B signaling pathway)、細胞因子-細胞因子受體相互作用(cytokine-cytokine recep‐tor interaction)等通路上。選取IL-8 表達負相關的基因進行GO 和Kegg 富集分析,以分析IL-8 表達抑制的功能(如圖4 A所示)或通路(如圖4B所示)。在GO功能方面上主要涉及細胞因子受體結合(cyto‐kine receptor binding)、轉化生長因子β受體結合(transforming growth factor beta receptor binding)、組蛋白乙酰轉移酶結合(histone acetyltransferase binding)、組蛋白脫乙酰酶結合(histone deacetylase binding)、磷脂酰肌醇3-激酶活性(phosphatidylinosi‐tol 3-kinase activity)等功能;KEGG 富集分析集中在非小細胞肺癌(non-small cell lung cancer)、HIF-1信號通路(HIF-1 signaling pathway)、PI3K-Akt 信號通路(PI3K-Akt signaling pathway)等通路中。
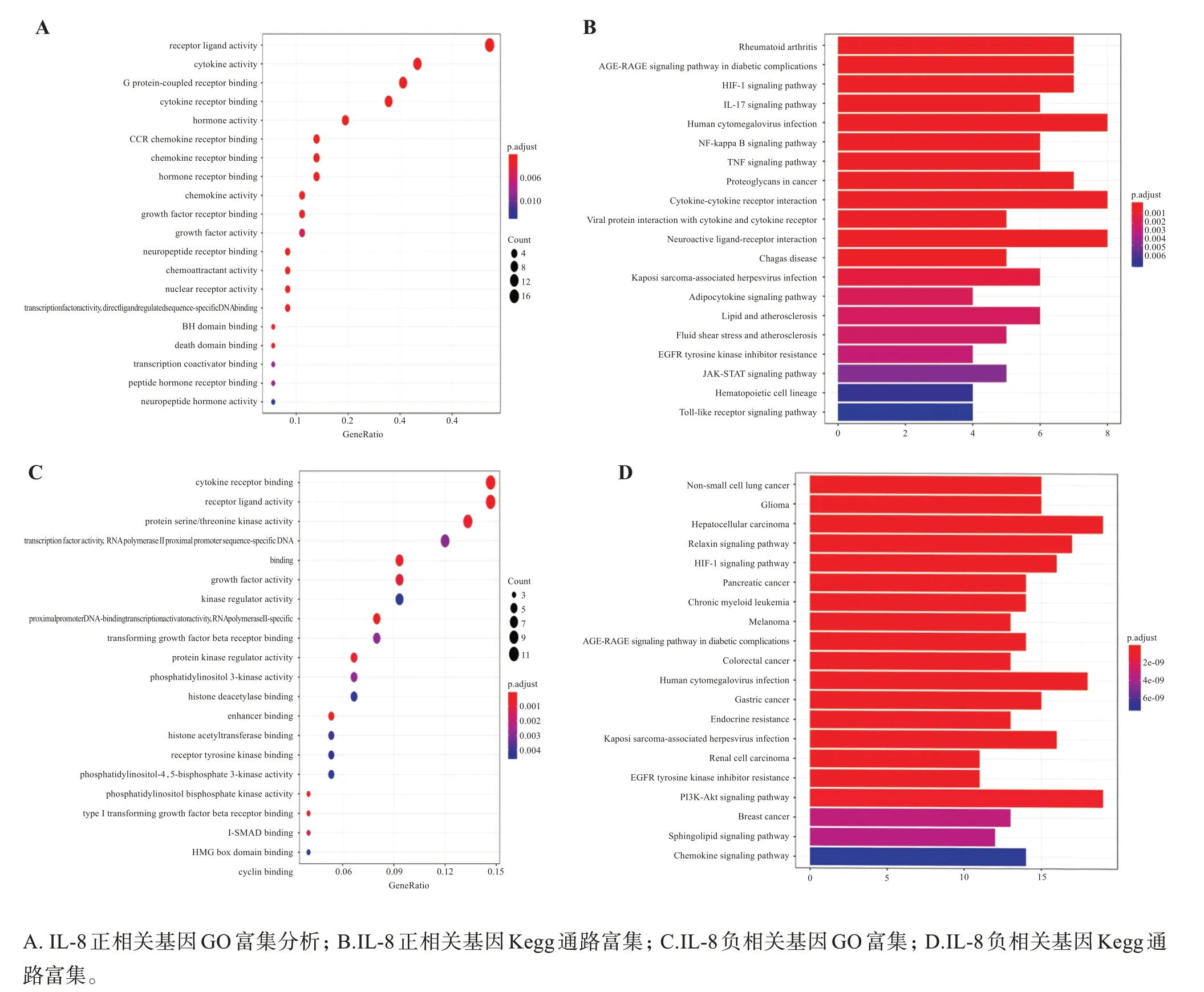
圖4 IL-8正負相關基因GO富集和Kegg通路富集結果Figure 4 GO enrichment and KEGG pathway enrichment of IL-8 positive and negative related genes
3 討論
IL-8 是一種有效的中性粒細胞募集和激活因子,與許多炎性肺病(急性呼吸窘迫綜合征、慢性阻塞性肺疾病、哮喘)的發病機制有關,其機制通過釋放彈性蛋白酶而損傷肺功能[13],且有研究通過酶聯免疫吸附試驗發現COPD 患者獲得的痰液標本中IL-8 水平升高[14]。而通過對比COPD 和正常人之間的轉錄組表達數據發現,IL-8 在COPD 患者中顯著高表達,說明IL-8的高表達與COPD發病相關。
目前許多研究已經證明lncRNA 可以與mRNA競爭性結合miRNA,以調控mRNA 的表達[15]。本研究發現環狀通路中hsa-miR-106a-5p、hsa-miR429、hsa-miR-32-5p 等可以調控IL-8 的表達,而這一過程可 以 被USPS-AS1、CELF2-AS1、CELF2-AS2、SN‐HG5、DAPK1-1T1、MALAT1等lncRNA 競爭性抑制。研究表明miR-32-5p 可能通過上調NFIL3 及抑制炎性因子TNF-α、IL-6 的表達以抑制脂多糖誘導的肺上皮細胞凋亡和炎性反應[16]。在MicroRNAs 作為COPD 分級標志物的篩選、驗證及功能分析中通過實時熒光PCR 方法檢測COPD 患者和正常人外周血中miR-106a-5p 的表達,發現miR-106a-5p 在COPD 患者中顯著高表達,在COPD 的發生發展中起重要作用,與COPD 的嚴重程度相關[17]。有研究證明lncRNA SNHG5 可以通過SNHG5-miR-132-PTFN 軸調控miR-132 下游靶標PTEN 蛋白的表達,以減輕香煙煙霧刺激對COPD人支氣管上皮細胞的增殖、凋亡和炎癥(IL-1β、IL-6 和TNFα)反應[18]。還有研究表明lncRNA-MALAT1 可以通過調節MALAT1/miR-146a/COX2 軸,延緩COPD 肺功能的減低,并且可以減輕COPD 的慢性炎癥,有望成為預測COPD 嚴重程度的新型生物標志物[19]。結合IL-8-miRNA-lncRNA 環狀網絡可以得知,lncRNA中SNHG5、MALAT1可以通過競爭性結合miR-32-5p,發揮內源性競爭IL-8 以調節IL-8 在COPD 中的作用,因此推測lncRNA 中SNHG5、MALAT1 可以通過SNHG5/MALAT1-miR-32-5p-IL-8 軸調控IL-8在COPD中的炎癥過程。
通過PPI蛋白互作網絡分析得知,與IL-8高表達呈正相關的基因為TNF、VEGFA、PTGS2、STAT3、IL1B等蛋白,與IL-8高表達呈負相關的基因為PRK‐CZ、JUN、TGFB1、TP53、MAPK1等蛋白;其中腫瘤壞死因子(TNF-α)作為COPD中的促黏附細胞因子,在COPD患者的血漿和痰液中明顯升高[20],并且經研究發現TNF-α多態性基因表型可以影響慢性阻塞性肺疾病的臨床表型(增加發病率,使EV1下降增快、體重指數降低),此過程與肺分泌過表達TNF-α有關,并伴有IL-8等炎癥因子的過表達和增加的中性粒細胞遷移[21]。研究表明血管內皮生長因子(VEGFA)在COPD 中顯著高表達并參與人肺微血管細胞的凋亡過程,miRNA-206可以誘導VEGFA的過表達,這一過程被miRNA-206 敲低顯著逆轉[22]。TP53 是一種應激反應基因,通過激活下游基因的轉錄發揮基因毒性應激、致癌信號、細胞損傷。研究發現TP53 持續下調及其下游CDKNIA通路可能是通過COPD向鱗狀細胞癌(SQCC)發展,與抑制細胞周期停滯和細胞凋亡有關[23],因此推測高表達的IL-8 可能通過調節與其正負相關基因的表達來調控COPD 疾病的發生。
通過IL-8 表達正相關的基因進行GO 和Kegg富集分析發現,調控正相關基因表達的通路也有如下功能:如GC 發揮作用需要與GC 受體結合,形成GC-GR 復合物,而炎性通路的激活則會降低受體的表達,減輕受體的活性,導致糖皮質激素的不敏感[24],而通過對慢阻肺疾病激素不敏感與糖皮質激素受體核內移的相關性研究中發現,COPD 患者外周血中GRα的核內轉移與GC 的敏感性呈正相關,而糖皮質激素的減弱可能與GRα的核內轉移受抑制/核內GRα的降解有關[25]。還有研究表明,TNF-α/IL-17 信號通路可以靶向調控IL1B的表達,進而促進CSE 刺激引起的慢阻肺支氣管上皮細胞的增殖,并抑制其凋亡以干預COPD 的發展[26]。此外通過研究發現核因子(NF)κB 可以調節細胞因子、趨化因子、生長因子、細胞黏附因子等多種靶基因的表達,進而調控各種組織細胞的炎癥與免疫反應、細胞凋亡及增殖分化等生理過程[27],而NF-κB 信號通路的異常激活可以誘導TNF-α、IL-1β、IL-6 以及黏附分子等炎癥介質的釋放,從而加重COPD的發生,通過抑制其通路可以阻斷COPD的進展[28]。
通過IL-8 表達負相關的基因進行GO 和Kegg富集分析發現,調控負相關基因表達的通路有如下功能:慢性阻塞性肺疾病中持續存在的氧化應激反應可以降低肺組蛋白乙酰酶活性,打破組蛋白乙酰轉移酶/組蛋白脫乙酰酶的平衡,進而導致組蛋白分子過乙酰化、增強炎癥蛋白基因的轉錄和炎癥蛋白的合成,最終能夠阻斷糖皮質激素的抗感染效應[29]。另有研究發現,PI3K-Akt 通路可干預HDAC2 的表達或活性,其機制為氧化應激反應激活PI3K/Akt 通路,使得該通路下游的信號蛋白Akt發生磷酸化,進一步影響其下游的HDAC2,引起HDAC2 活性下降或失活,導致炎癥基因的轉錄和炎癥因子的合成加強[30-32]。還有研究發現小青龍湯中槲皮素等成分可以通過HIF-1 信號通路調控IL-6 等炎癥因子的釋放以干預COPD 發生發展中的氧化應激、炎癥反應過程[33]。結合IL-8 表達正負相關基因的GO 和KEGG的研究發現,與IL-8 表達正負相關的基因可能通過調控組蛋白乙酰轉移酶結合、組蛋白脫乙酰酶結合、激素活性和激素受體等生物過程,以及PI3KAkt 通路、HIF-1 信號通路、TNF-α/IL-17 信號通路、NF-kB 信號通路等信號通路在COPD 的發生過程中抑制糖皮質激素敏感性、參與炎癥反應。
本研究利用生物信息學的研究方法,發現IL-8在COPD 疾病中顯著高表達,并且通過篩選miRNA和lncRNA 得到了IL-8-miRNA-lncRNA 環狀網絡,采用GSEA 軟件篩選出與高表達相關的正負相關mRNA,采用R 軟件發現部分GO 生物學過程和KEGG 通路涉及糖皮質激素抵抗和炎癥反應的機制。本研究顯示,IL-8 有望成為治療COPD 的新靶點。

