miR-562下調LncRNA-TRIM52-AS1抑制肝癌細胞惡性增殖
蔡瑜 燕普 常小偉 李武軍 汪海平
(1西安醫學院第一附屬醫院普通外科,陜西 西安 710077;2安徽醫科大學第二附屬醫院)
肝細胞癌(HCC)是常見的原發性肝癌,也是全球范圍內與癌癥相關導致死亡的最常見原因之一〔1〕。乙型肝炎病毒(HBV)感染,慢性丙型肝炎病毒(HCV)感染、酗酒、黃曲霉毒素B1攝入和代謝綜合征都是導致HCC的高危因素。HBV感染發生率在亞洲最高〔2〕。慢性HBV感染仍無法治愈〔3〕。盡管HCC治療取得了巨大進展,但仍缺乏有效治療HCC的措施〔4〕。正如在許多其他癌癥中觀察到的那樣,HCC腫瘤發生和發展是一個復雜過程,包括關鍵生長調節基因的遺傳和表觀遺傳轉化〔5〕。因此,需要清楚地闡明HCC發生的分子機制,并為HCC患者的早期診斷和治療開發新的策略。長鏈非編碼RNA(LncRNA)是長度大于200 bp的轉錄本,沒有蛋白質編碼功能〔6〕,代表一類非編碼RNA,在研究中受到的關注較少。研究表明,LncRNA對染色質結構,基因表達和翻譯控制的調控至關重要〔7,8〕。有證據表明,LncRNAs可能在轉錄、轉錄后和表觀遺傳水平上調節關鍵的癌癥途徑〔9〕。有報道稱,人類LncRNA的數量可與蛋白質編碼基因的數量相匹敵〔10〕,但只有少數LncRNA被研究。在過去的幾年中,由于各種新方法的成功應用,包括全基因組范圍內的基因表達篩選,全基因組范圍內的關聯研究,區域性關聯分析和常規連鎖篩選,設計的LncRNA陣列,RIP-RNA測序,轉基因表達及基因敲除,LncRNA在癌癥中的功能正在日益被發掘。已鑒定出多種LncRNA在組織癌變、侵襲和轉移中至關重要〔11~15〕。本研究前期通過高通量測序檢測發現,TRIM52-AS1在HCC中高表達且與臨床預后有顯著相關性,然其在HCC中的作用研究尚不明確,本研究探討TRIM52-AS1在HCC發展進程中的重要作用。
1 材料與方法
1.1研究組織及細胞培養 人HCC細胞HepG2購自美國ATCC細胞庫,培養在含10%胎牛血清的DMEM培養基中,并加入100 μg/ml鏈霉素和100 IU/ml青霉素;細胞培養瓶置于含 5%CO2和 95%濕度的37℃培養箱中。另選取2019年4~7月在西安醫學院第一附屬醫院接受手術治療的30例HCC患者癌組織及癌旁正常組織樣本,均由術中獲取經病理確認后制成石蠟組織標本,低溫液氮留存。
1.2臨床數據篩選 在臨床數據庫GEPIA〔16〕中,通過腫瘤組織/正常組織>2找到在HCC高表達的基因,通過進一步分析,篩選出在HCC中有臨床意義的LncRNA。
1.3實時熒光定量-聚合酶鏈反應(qRT-PCR) 使用primer3(http://frodo.wi.mit.edu/primer3/)設計特異性qPCR引物;cDNA用滅菌純水稀釋適當的濃度,按照qPCR mix 5 μl,primer 1 μl,cDNA 4 μl的配方加入96孔PCR板中;貼膜,以2 500 r/min離心1 min,將樣品放入qPCR儀器中進行實驗,反應完成后,拷貝數據,進行分析。
1.4細胞轉染及分組 細胞轉染:以6孔板轉染siRNA為例,將1 μl siRNA與250 μl Opti-MEM混勻,1 μl lipo2000與250 μl Opti-MEM混勻,室溫放置5 min,然后將兩部分合并,混勻,靜置15 min,之后逐滴、均勻加入6孔板中的1個孔中。
分組:HepG2細胞,轉染TRIM52-AS1無意義序列siCTL記為敲低TRIM52-AS1表達檢測的對照組(siCTL組),轉染2條干擾siRNA序列分別記為TRIM52-AS1表達敲低siTRIM52-AS1#1組和siTRIM52-AS1#2組;轉染miR-562 mimic模擬物記為miR-562過表達組(miR-562組),轉染miR-562-NC記為陰性對照組(NC組);轉染miR-562反義核酸ASO記為敲低miR-562表達組(miR-562-ASO組),轉染NC-ASO記為陰性對照組(NC-ASO組);miR-562-ASO組中共轉染無意義siCTL序列記為miR-562-ASO+siCTL組,miR-562-ASO組中共轉染干擾siTRIM52-AS1序列記為miR-562-ASO+siTRIM52-AS1組。
1.5細胞增殖實驗 消化長滿10 cm盤的細胞,重懸于1 ml新鮮培養基中,用20 μl可鋪1個96孔板的密度鋪細胞,每個實驗組需3個生物重復,鋪好所需的實驗孔數。在5%CO2,37℃條件下孵育。細胞貼壁后即可轉染siRNA。48 h后開始測量吸光度。配制MTS反應液,按照MTS:培養液=1∶20的比例配制反應液。每孔加入100 μl MTS反應溶液,37℃繼續培養。每隔30 min檢測1次吸光度。將培養皿置搖床上低速振蕩10 s以充分溶解結晶物。在490 nm處測量各孔的吸光值(OD值)。將每天的吸光值轉換成代表每日細胞生長的參數,并繪制細胞增殖曲線。
1.6克隆形成實驗 以6孔板細胞為例:每孔鋪2 000個細胞,細胞貼壁后即可轉染siRNA。每個樣品做3個生物重復,待6~14 d后出現肉眼可見克隆,收集細胞,用常溫磷酸鹽緩沖液(PBS)洗滌2次,用甲醇、乙酸比為3∶1的固定液常溫固定5 min,用含0.5%結晶紫的甲醇溶液常溫固定15 min,水洗,直至背景紫色洗掉,室溫晾干進行掃描,用10%醋酸溶液溶解結晶紫,并在OD590 nm測吸光度,繪制數據柱狀圖。
1.7劃痕遷移實驗 10 cm盤的1/4鋪整個6孔板,待細胞貼壁后分別轉染siRNA,待細胞長到90%用槍頭在盤中央劃痕,并用PBS洗1遍,拍攝0 h圖片作為對照,24 h后拍攝實驗組照片。
1.8LncRNA靶標預測 通過網站進行預測LncRNA結合的microRNA及具體位點,從而進行進一步研究。
1.9雙熒光素酶報告基因實驗 將HCC細胞接種到6孔培養板中,使其密度為90%。含有海腎熒光素酶的報道質粒被用作標準參考。將質粒轉染到HepG2細胞中。使用雙重熒光素酶測定系統(普洛麥格,北京,中國)測量熒光素酶活性,根據生產商說明將其轉染48 h后根據海腎熒光素酶活性進行標準化。該測定一式三份進行3個獨立實驗。
1.10統計學方法 采用SPSS20.0軟件進行t檢驗、單因素方差分析、K-M生存曲線。
2 結 果
2.1篩選HCC中具有臨床意義的靶基因 研究首先通過GEPIA數據庫篩選出在HCC中相比鄰近正常組織顯著高表達的基因(腫瘤組織/正常組織>2)共1 315個,其中mRNA 1 284個,LncRNA 19個,misc_RNA 12個。研究主要關注LncRNA功能,因此將LncRNA按照表達差異進行排序,同時結合高表達預后差原則,篩選出關鍵基因TRIM52-AS1(圖1)。
2.2TRIM52-AS1在HCC中的表達特征 研究通過GEPIA數據庫探究TRIM52-AS1在HCC中的表達情況,發現369例HCC組織中TRIM52-AS1表達顯著高于160例正常組織(3.32±0.53 vs 2.13±0.41,t=25.302,P<0.001),同時具有明顯的TRIM52-AS1高表達預后差臨床特征(HR=1.5,P=0.047,圖2);在30組HCC組織中TRIM52-AS1表達顯著高于癌旁正常組織(26.12±4.36 vs 20.01±2.04,t=6.952,P<0.001),說明TRIM52-AS1在HCC發生發展中有重要作用。

TPM:每百萬單位的轉錄數圖1 將篩選出的HCC中高表達的LncRNA按表達 差異倍數利用熱圖進行排序

TPM:每萬單位的轉錄數圖2 GEPIA數據庫分析TRIM52-AS1表達與 HCC臨床預后相關性
2.3敲低TRIM52-AS1表達顯著抑制HCC細胞增殖、克隆形成和遷移速率 siTRIM52-AS1#1組(0.23±0.04)和siTRIM52-AS1#2組(0.24±0.03)細胞中TRIM52-AS1相對表達均明顯低于siCTL對照組(1.01±0.01),差異有統計學意義(F=621.414,P<0.001),表明敲低TRIM52-AS1表達轉染成功。細胞實驗檢測顯示,敲低TRIM52-AS1表達后HCC細胞增殖速率、克隆形成速率及劃痕遷移速率均顯著減慢(P<0.05,圖3、表1、圖4)。初步證明TRIM52-AS1在HCC中的重要作用。

圖3 敲低TRIM52-AS1表達后HCC細胞克隆形成速率變化
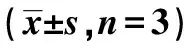
表1 敲低TRIM52-AS1對HCC細胞增殖OD值、克隆形成速率及劃痕遷移速率的影響

圖4 敲低TRIM52-AS1表達后HCC 細胞遷移速率變化(×100)
2.4miR-562可與TRIM52-AS1結合并負向調控其表達 TRIM52-AS1與miR-562存在結合位點(圖5);通過將TRIM52-AS1野生型和突變型熒光質粒與miR-562過表達載體共轉染至HepG2細胞中,熒光素酶基因報告實驗顯示,過表達miR-562組TRIM52-AS1野生型熒光素酶活性明顯降低(P<0.001),而對TRIM52-AS1突變型熒光素酶活性無明顯影響(P>0.05),說明TRIM52-AS1與miR-562靶向結合。與NC組比較,過表達miR-562細胞中,TRIM52-AS1 mRNA表達顯著降低(P<0.05,表2)。表明miR-562是TRIM52-AS1的靶基因,miR-562過表達可顯著抑制TRIM52-AS1表達。
2.5miR-562在HCC中的表達特征,其高表達可顯著促進HCC細胞增殖 研究miR-562在HCC中的特征,發現30組HCC臨床樣本中miR-562表達顯著低于對應癌旁正常組織(20.05±2.34 vs 29.53±3.54,t=12.236,P<0.001),并有明顯的低表達預后差臨床特征(HR=0.53,Log-rankP=0.026),且與TRIM52-AS1在HCC中的表達呈現顯著負相關性(r=-0.572,P=0.000,圖6)。進一步發現,miR-562-ASO敲低組HCC細胞增殖速率顯著高于NC-ASO對照組(0.82±0.06 vs 0.45±0.03,t=9.553,P<0.001),由此證實miR-562在HCC中與TRIM52-AS1存在負向調控關系。

圖5 網站預測TRIM52-AS1的結合靶標以及具體結合位點
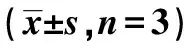
表2 TRIM52-AS1與miR-562的結合及調控 關系驗證

圖6 TRIM52-AS1與miR-562在30組臨床樣品中的 表達相關性
2.6miR-562調控TRIM52-AS1 在敲低miR-562表達的細胞中進一步敲低TRIM52-AS1表達后,細胞增殖速率回歸到正常水平(表3),表明miR-562通過調控TRIM52-AS1表達從而參與HCC的發生發展過程。
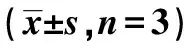
表3 miR-562調控TRIM52-AS1對HCC細胞增殖OD值的影響
3 討 論
LncRNA是>200個核苷酸的RNA轉錄物,沒有蛋白質編碼功能。研究表明癌變的分子機制不僅與蛋白質編碼基因有關,而且與非編碼調節性RNA有關〔17〕。研究表明,多種LncRNA在各種類型的實體瘤中均被失調,并且多個LncRNA可通過直接靶向染色質修飾復合物來調節癌癥轉移,這表明LncRNA的異常表達增加了腫瘤發生和癌癥發展的機會〔18~20〕。例如,LncRNA HOTAIR過表達與乳腺癌有關〔21〕;MALAT1的上調與膀胱癌有關〔22〕;LncRNA XIST的下調與膠質母細胞瘤有關〔23〕;PCAT-1的上調與前列腺癌有關〔24〕。研究〔25〕主要探究了TRIM52-AS1在腎癌中的腫瘤抑制作用,與此作用相反的是,本研究發現TRIM52-AS1在HCC中扮演促癌基因角色。
本研究表明,敲低TRIM52-AS1導致HCC細胞增殖、克隆形成和遷移速率顯著減慢說明TRIM52-AS1在HCC發展進程中的促癌作用。為進一步探究TRIM52-AS1在HCC中發揮功能的作用方式,結合數據庫預測分析發現,TRIM52-AS1可與miR-562結合,同時miR-562可顯著負調控其表達,而miR-562在HCC中的表達特征恰巧與TRIM52-AS1相反,miR-562在HCC中顯著低表達且具有明顯的低表達預后差的臨床相關性,敲低miR-562表達也可顯著促進HCC細胞增殖,這些都顯示了TRIM52-AS1與miR-562的負相關性;細胞增殖實驗驗證了TRIM52-AS1促進HCC細胞增殖主要是由miR-562調控所致。
綜上,HCC中TRIM52-AS1高表達,敲低其表達能抑制HCC細胞的增殖、克隆形成和遷移,其發揮作用可能與miR-562低表達有關。

