泊沙康唑原料藥細菌內毒素檢查方法研究*
張 輝,黃有興,王美娜
(1.海南省藥品和醫療器械審評服務中心,海南 海口 570216; 2.海南海靈化學制藥有限公司,海南 海口 570311)
泊沙康唑是伊曲康唑的衍生物,為第2代三唑類抗真菌藥物[1],抗菌譜更廣,抗菌作用更強,對念珠菌、各種曲霉菌及其他致病真菌均有較強活性[2-3],適用于因免疫功能嚴重低下而具有高風險感染侵襲性曲霉菌和念珠菌的患者。建立相應細菌內毒素檢測方法,從源頭上減少內毒素污染風險,對于泊沙康唑注射劑成品的質量控制及臨床用藥安全具有重要意義。目前尚未見泊沙康唑原料細菌內毒素檢查方法學研究的相關報道。為此,本研究中參考國內其他藥物相應研究[4-9],并依據2020 年版《中國藥典(四部)》通則1143 細菌內毒素檢查法相應規定[10]和其他國內標準[11-12],并參考2021年版《英國藥典》(BP2021)和2020年版《美國藥典-國家處方集》(USP-NF2020),建立了泊沙康唑細菌內毒素的檢查方法。現報道如下。
1 儀器與試藥
1.1 儀器
DK-98-Ⅱ型電熱恒溫水浴鍋(天津市泰斯特儀器有限公司);漩渦混勻器(德國IKA公司);XS205DU型電子分析天平(瑞士Mettler Toledo公司)。
1.2 試藥
泊沙康唑原料藥(博瑞制藥<蘇州>有限公司,批號分別為SPO-I-210401、SPO-I-200305、SPO-I-200306);鱟試劑(湛江安度斯生物有限公司,批號為2007203;福州新北生化工業有限公司,批號為21030112;規格均為每支0.1 mL,靈敏度均為0.125 EU/mL);細菌內毒素工作標準品(中國食品藥品檢定研究院,批號為150601-202089,規格為每支90 EU);細菌內毒素檢查用水(BET 用水,湛江安度斯生物有限公司,批號為2010210,規格為每瓶100 mL);N,N- 二甲基甲酰胺(國藥集團化學試劑有限公司,批號為20200422,規格為每瓶500 mL)。
2 方法與結果
2.1 限值確定
泊沙康唑臨床1次最大劑量為800 mg/kg,則成人每千克體質量每小時的最大劑量(M)為13.33 mg/(kg·h),注射劑成人每千克體質量每小時最大可接受的內毒素劑量(K)= 5 EU/(kg·h),根據公式內毒素限值(L)=K/M,計算,則L= 0.37 EU/ mg,從嚴控制,限值定為0.3 EU/mg。根據公式MVC=λ/L[7,9-10]計算供試品最小有效稀釋質量濃度(λ 為在凝膠法中鱟試劑的標示靈敏度),得C0.50= 1.666 mg/ mL、C0.25= 0.833 mg/ mL、C0.125=0.416mg/mL、C0.06=0.2mg/mL、C0.03=0.1mg/mL;在不低于對應最小有效稀釋質量濃度條件下進行細菌內毒素檢查。
2.2 鱟試劑靈敏度復核試驗
取細菌內毒素工作標準品適量,加BET用水分別制備成2λ、λ、0.5λ、0.25λ的溶液,以BET用水為陰性對照(NC),依照2020年版《中國藥典(四部)》通則1143細菌內毒素檢查法規定[10],對使用的2批鱟試劑進行復核試驗,結果實測靈敏度(λc)與標示靈敏度一致,詳見表1。
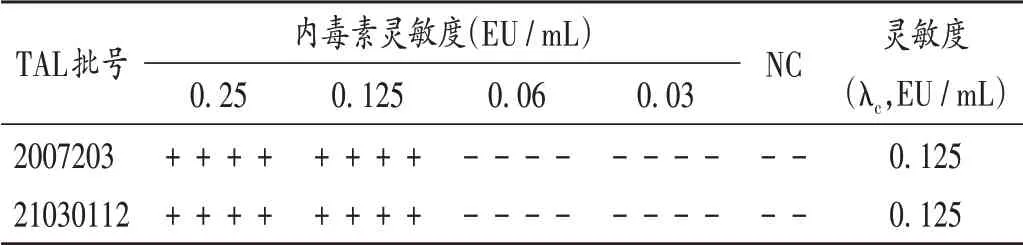
表1 鱟試劑靈敏度復核結果Tab.1 The verification results of tachypleus amebocyte lysate(TAL)sensitivity test
2.3 預干擾試驗Ⅰ
泊沙康唑不溶于水,需用N,N- 二甲基甲酰胺溶解制成供試品溶液,用0.125 EU/mL 鱟試劑進行預干擾試驗。泊沙康唑溶解后制成質量濃度為5 mg/mL 的供試品溶液,加BET 用水分別稀釋,制得質量濃度為3.332,1.666,0.833,0.417,0.2,0.1 mg/mL 的系列陰性對照(NPC)溶液;取除0.1 mg/mL質量濃度外的上述溶液,對半稀釋加入4λ的內毒素標準品溶液,制得質量濃度分別為1.666,0.833,0.417,0.2,0.1 mg/mL 的系列陽性對照(PPC)溶液。取上述兩組溶液進行干擾預試驗,并設陽性對照(PC)和陰性對照(NC)各2管。結果見表2。
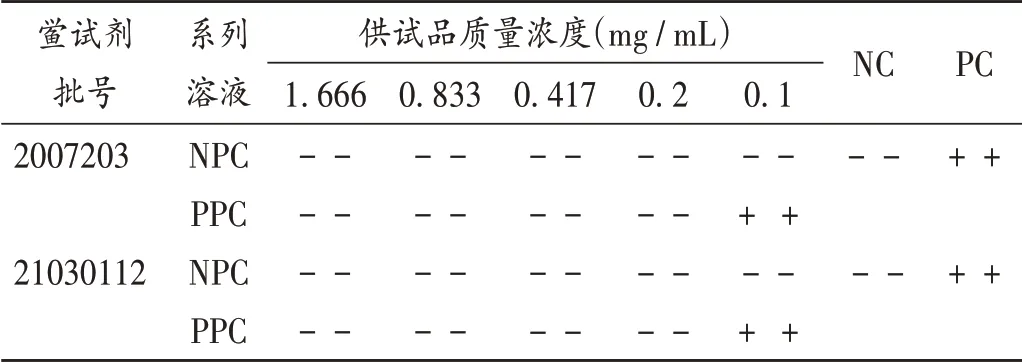
表2 供試品干擾預試驗Ⅰ結果Tab.2 Results of the pre-interference test Ⅰ
可見,泊沙康唑溶液僅在質量濃度為0.1 mg/ mL時,對內毒素與鱟試劑反應無干擾。考慮N,N-二甲基甲酰胺本身濃度過高,對內毒素檢查有一定的干擾作用。故需考察該溶劑不對內毒素與鱟試劑反應產生干擾的濃度,再重新進行預干擾試驗。
2.4 溶劑對細菌內毒素的干擾試驗
溶劑預干擾試驗:取N,N-二甲基甲酰胺適量,加BET 用水分別稀釋至4%,2%,1%,0.5%,0.25%體積分數,作為NPC。同時制備含有2λ 內毒素的相同濃度N,N-二甲基甲酰胺溶液,作為PPC,均采用0.125 EU/mL鱟試劑,依照藥典方法進行干擾試驗,并設PC 和NC管。結果見表3。可知,N,N-二甲基甲酰胺體積分數在0.25%~2%時,對內毒素與鱟試劑反應無干擾作用,故正式干擾試驗中選擇其體積分數為0.25%~2%。

表3 溶劑對細菌內毒素與鱟試劑反應的影響Tab.3 Effect of solvent on the reaction of bacterial endotoxin with TAL
正式干擾試驗:取內毒素標準品適量,加BET 用水稀釋分別配成2λ、λ、0.5λ、0.25λ 的溶液,同時制備含相同內毒素的2%N,N-二甲基甲酰胺溶液,進行干擾試驗。結果顯示,在N,N-二甲基甲酰胺體積分數≤2%時對內毒素與鱟試劑反應均無明顯干擾。詳見表4。

表4 溶劑干擾試驗結果Tab.4 Results of the interference test
2.5 干擾預試驗Ⅱ
取泊沙康唑0.5 g,精密稱定,加5 mLN,N- 二甲基甲酰胺溶解,配成100 mg/mL 的溶液,用BET 用水分別稀釋,即得泊沙康唑質量濃度分別為1.666,0.833,0.417,0.2,0.1 mg/ mL 的系列NPC 溶液,另外制備上述質量濃度溶液中含有2λ 細菌內毒素的PPC 溶液,進行預干擾試驗。并設PC 和NC,結果見表5。可見,泊沙康唑質量濃度不超過0.833 mg/mL 時不影響內毒素與鱟試劑反應。
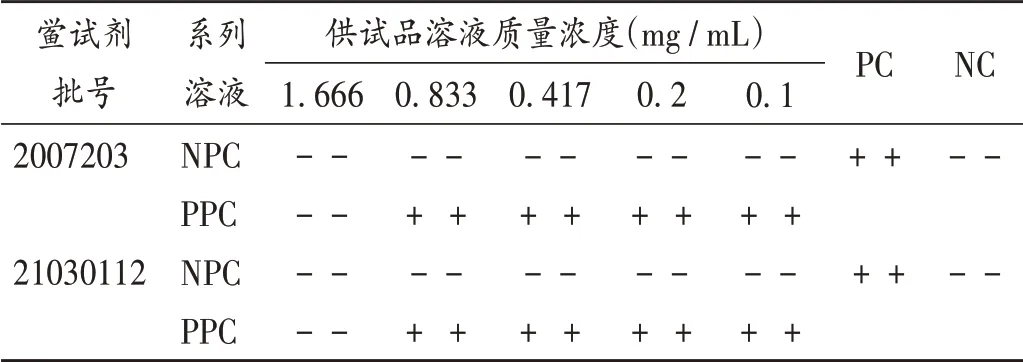
表5 供試品干擾預試驗Ⅱ結果Tab.5 Results of the pre-interference test Ⅱ
2.6 溶劑處理供試品的內毒素回收干擾驗證試驗
取泊沙康唑0.5 g,精密稱定,加入5.0 mLN,N-二甲基甲酰胺溶解配制成100 mg/ mL 的溶液,加BET用水逐步稀釋成質量濃度為0.833 mg/mL 的泊沙康唑溶液;另取100 mg/mL 的泊沙康唑N,N- 二甲基甲酰胺溶液1 mL,加入30 EU/mL 內毒素溶液,用BET 用水稀釋制成內毒素濃度為0.25 EU/mL,泊沙康唑質量濃度為0.833 mg/mL的溶液(2λ),后用同濃度的泊沙康唑溶液逐級稀釋為分別含0.125,0.06,0.03 EU/mL 細菌內毒素的泊沙康唑溶液,同時配制含相同濃度內毒素的水溶液進行試驗,試驗時N,N-二甲基甲酰胺濃度控制在2%及以下。結果顯示,N,N-二甲基甲酰胺在該濃度下對供試品中細菌內毒素無干擾作用。結果見表6。

表6 細菌內毒素回收干擾驗證試驗結果Tab.6 Results of the verification test of bacterial endotoxin recovery interference test
2.7 正式干擾試驗[10-12]
取3 個批次的泊沙康唑適量,制得0.833 mg/ mL供試品溶液,并進行正式干擾試驗。結果見表7。可知,該濃度下供試品對2 個廠家的鱟試劑與細菌內毒素的反應均無明顯干擾,可進行細菌內毒素檢查。
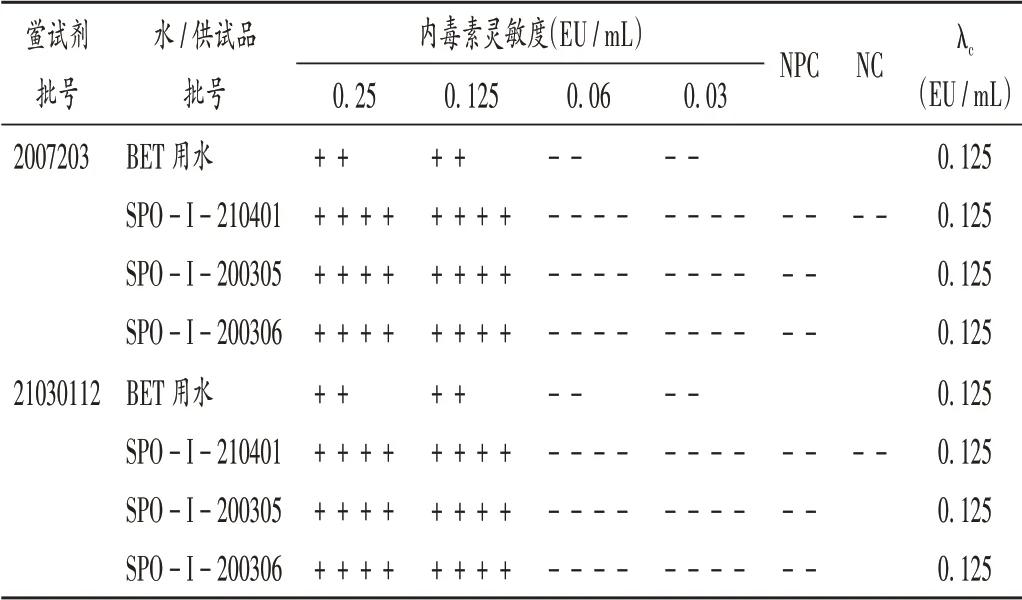
表7 供試品干擾試驗結果Tab.7 Results of the interference test of samples
2.8 細菌內毒素檢查
將3個批次的泊沙康唑稀釋后,進行細菌內毒素檢查。結果均符合內控標準規定,見表8。

表8 供試品細菌內毒素檢查結果Tab.8 Results of BET of the samples
3 討論
細菌內毒素屬外源性熱原,具有致熱性,普遍存在于自然界中。人和動物對內毒素有一定耐受力,但當過量內毒素進入血液后會引起機體嚴重的病理反應,輕則致發熱、休克、心率過快,重則引起致命性敗血癥,并伴有多器官功能衰竭,甚至死亡。細菌內毒素是制藥工業中最普遍和最主要的外源性熱原,制藥過程中細菌內毒素超標提示產品在生產過程中可能存在某些風險因素,控制了細菌內毒素,相當于控制了熱原污染。細菌內毒素檢查在制藥領域具有重要意義;如泊沙康唑注射液生產過程中,一般采用除菌過濾加終端滅菌的方式控制生產中的細菌內毒素,而控制泊沙康唑原料內毒素含量,有利于制劑生產工藝和質量的過程控制。
由于泊沙康唑不溶于水,本研究中考察了采用N,N-二甲基甲酰胺溶解泊沙康唑原料藥后,用BET用水稀釋至一定質量濃度,以建立細菌內毒素檢查法。進行濃度預干擾試驗時,發現0.5%~2%N,N-二甲基甲酰胺對細菌內毒素檢查無干擾。同時考察了供試品的N,N-二甲基甲酰胺溶液中添加細菌內毒素的回收驗證試驗,確認用N,N-二甲基甲酰胺溶解供試品,對供試品的細菌內毒素檢查無干擾作用。根據驗證結果,重新進行了泊沙康唑的預干擾試驗和正式干擾試驗,并對供試品進行了細菌內毒素檢查。
本研究結果表明,泊沙康唑宜先用2%的N,N-二甲基甲酰胺溶解,再用BET用水制備質量濃度≤0.833 mg/mL的供試品溶液,最后依照2020 年版《中國藥典(四部)》通則1143方法進行細菌內毒素檢查。
綜上所述,本研究中建立的細菌內毒素檢查方法可行,可用于制劑生產中泊沙康唑原料藥細菌內毒素的控制。

