circPDE4B調控miR-7對骨關節炎中軟骨ECM降解和細胞凋亡的影響
范金柱,任小宇,從飛,宋濤,郭云山,馬強
(1.西安交通大學附屬紅會醫院骨顯微修復外科,陜西 西安 710054;2.西安交通大學附屬紅會醫院脊柱外科,陜西 西安 710054;3.西安交通大學附屬紅會醫院足踝外科,陜西 西安 710054)
骨關節炎(osteoarthritis,OA)是一種慢性疼痛性關節炎,是患者殘疾的主要原因,全球至少有2.42億人患有髖/膝OA[1]。此外,隨著人口老齡化和肥胖等危險因素的增加,OA的發病率也呈上升趨勢[2]。OA的發病機制復雜,主要由機械、遺傳、代謝和炎癥等途徑參與的慢性演變過程[3]。目前,OA的治療主要通過藥物治療,部分患者需要考慮進行關節置換手術。藥物治療主要采用非甾體抗炎藥和阿片類藥物等,通過藥物控制疼痛和改善患者的癥狀[4],然而OA患者的預后并不理想[5]。circRNAs是ncRNA的一個特殊子集,具有共價閉環結構,既沒有5′-3′極性也沒有多聚腺苷酸尾[6]。研究顯示circRNAs參與了真核生物的多種生理和病理過程,如癌癥進展、炎癥、衰老和感染等[7]。近年來,OA與circRNAs之間的關系得到了部分闡明,circRNAs可能通過干擾軟骨細胞增殖和凋亡、調節細胞外基質(extra cellular matrix,ECM)降解和炎癥等途徑參與OA的發生及發展[8]。研究顯示circPDE4B在OA患者軟骨組織中顯著低表達,并能夠通過調控RIC8A和MID1參與OA的進展,然而其進一步的生物學功能未完全明確[9]。因此,本研究選取2019年3月至2020年10月在西安交通大學附屬紅會醫院住院治療的28例OA患者,檢測circPDE4B的表達水平,并在細胞水平驗證circPDE4B對OA軟骨細胞ECM降解和凋亡的影響及機制。
1 材料和方法
1.1 組織標本 選取2019年3月至2020年10月在西安交通大學附屬紅會醫院住院治療的28例OA患者和28例半月板損傷患者。OA患者男性16例,女性12例;年齡30~80歲,平均年齡(64.1±13.7)歲。半月板損傷患者男性18例,女性10例;年齡18~80歲,平均年齡(35.5±11.8)歲。OA患者行全膝關節置換術;半月板損傷患者行膝關節鏡下半月板成形術,切除損傷部分半月板。采用美國風濕學院標準診斷OA,所有患者均未患有痛風性關節炎、風濕性關節炎、類風濕性關節炎和繼發性骨關節炎等。在術中切除軟骨組織,標本分成相同大小并保存于液氮中。所有患者術前簽署知情同意書。
1.2 主要試劑 DMEM/F12培養基和胎牛血清購自美國Gibco公司;細胞凋亡試劑盒購自上海弗元生物科技有限公司;RT-qPCR試劑盒和TRIZol試劑購自日本TaKaRa公司;Cleaved-caspase-3、SOX9、COL2A1、基質金屬蛋白酶(matrix metalloproteinase,MMP)3、MMP13和甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體購自美國Sigma-Aldrich公司;lipofectamine2000購自美國Invitrogen公司;轉染所需質粒由中國上海吉凱基因有限公司合成。
1.3 方法
1.3.1 細胞培養與轉染 人軟骨細胞通過兩步酶消化法進行分離,傳代至第3代用于后續實驗。采用含10%胎牛血清的DMEM/F12細胞培養基在37 ℃、5% CO2平衡濕度培養箱中培養。采用Lipofectamine 2000轉染質粒至OA軟骨細胞。
1.3.2 RT-qPCR 按照Trizol試劑說明書提取組織和細胞中總RNA,采用Nano-Drop2000檢測RNA濃度。逆轉錄合成cDNA后,采用SYBR Green RT-qPCR檢測circPDE4B、miR-7、SOX9、COL2A1、MMP3、MMP13的表達水平。以GAPDH或U6作為內參,采用2-△△Ct法計算相對表達量。
1.3.3 流式細胞術檢測細胞凋亡 收集轉染48h后的OA軟骨細胞,磷酸鹽緩沖液(phosphate buffered solution,PBS)清洗2次后重懸,按照說明加入Annexin V-FITC細胞凋亡檢測試劑和染色液碘化丙啶(propidium iodide,PI)在室溫下避光10min,采用流式細胞儀檢測各組細胞的凋亡率。
1.3.4 免疫蛋白印跡(western blot,WB) 采用ripa裂解液提取細胞中總的蛋白,使用聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)試劑盒測定蛋白濃度。十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分離蛋白后轉移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,在室溫條件下5%脫脂奶粉封閉,加入一抗Cleaved-caspase-3、SOX9、COL2A1、MMP3、MMP13和GAPDH后,在4℃下孵育過夜,次日加入二抗孵育2h,電化學發光(electro-chemi luminescence,ECL)顯影并檢測灰度值。
1.3.5 熒光素酶報告基因檢測 將野生型(WT)或突變型(MUT)circPDE4B克隆到pmirGLO質粒受體中,同時將miR-NC或miR-7 mimics導入OA軟骨細胞中,共培養48 h后采用雙熒光素酶受體分析系統測量雙熒光素活性。
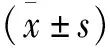
2 結 果
2.1 OA軟骨組織和軟骨細胞中circPDE4B的表達水平 半月板損傷患者和OA患者軟骨組織的番紅O染色顯示在OA患者中軟骨組織存在明顯病變(見圖1a~b)。進一步檢測OA軟骨組織和軟骨細胞中circPDE4B的表達水平,結果顯示circPDE4B的表達水平在OA軟骨組織中明顯低于半月板損傷患者軟骨組織(見圖2a,P<0.05)。進一步分離軟骨細胞,OA軟骨細胞中circPDE4B的表達水平明顯低于正常軟骨細胞(見圖2b,P<0.05)。細胞功能驗證中,在OA軟骨細胞中分別轉染oe-NC和oe-circPDE4B,結果顯示轉染oe-circPDE4B后,circPDE4B的表達水平明顯高于轉染oe-NC(見圖2c,P<0.05)。

a 半月板損傷患者軟骨組織完整 b OA患者軟骨組織明顯破壞
2.2 過表達circPDE4B對OA軟骨細胞凋亡的影響 在circPDE4B對OA軟骨細胞生物學功能的研究中,流式結果顯示過表達circPDE4B能夠明顯抑制OA軟骨細胞的凋亡(見圖3a,P<0.05),同時抑制凋亡相關分子Cleaved-caspase-3蛋白的表達水平(見圖3b,P<0.05)。
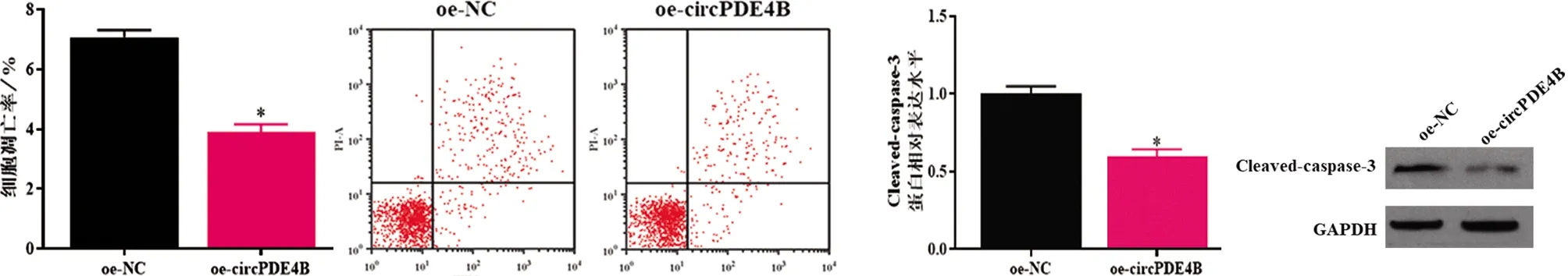
a 流式細胞術檢測細胞凋亡情況 b WB檢測Cleaved-caspase-3蛋白的表達水平
2.3 過表達circPDE4B對OA軟骨ECM降解的影響 為分析circPDE4B對OA軟骨ECM降解的影響,在OA軟骨細胞中分別轉染oe-NC和oe-circPDE4B后檢測ECM相關分子SOX9、COL2A1、MMP3和MMP13的表達水平。RT-qPCR結果顯示,過表達circPDE4B明顯促進SOX9和COL2A1 mRNA的表達水平,抑制MMP3和MMP13 mRNA的表達水平(圖4a,P<0.05)。WB結果顯示,過表達circPDE4B明顯促進SOX9和COL2A1蛋白的表達水平,抑制MMP3和MMP13蛋白的表達水平(圖4b,P<0.05)。

a RT-qPCR檢測ECM相關分子mRNA的表達水平 b WB檢測ECM相關分子蛋白的表達水平
2.4 circPDE4B能夠靶向結合miR-7 在機制研究中,雙熒光素酶基因報告結果顯示circPDE4B-WT組中轉染miR-7 mimics后雙熒光素活性明顯下降(見圖5a,P<0.05),在circPDE4B-MUT組中轉染miR-7 mimics后雙熒光素活性未見明顯改變(見圖5a,P>0.05)。過表達circPDE4B能夠明顯抑制OA軟骨細胞中miR-7的表達水平(見圖5b,P<0.05)。miR-7的表達水平在OA軟骨組織中明顯高于半月板損傷患者軟骨組織(見圖5c,P<0.05),Pearson相關性分析顯示circPDE4B和miR-7在OA患者軟骨組織中的表達水平呈負相關(見圖5d,P<0.05)。

a 雙熒光素酶基因報告 b RT-qPCR檢測miR-7的表達水平 c OA軟骨組織和半月板損傷軟骨組織 d circPDE4B和miR-7的表達相關性
2.5 circPDE4B調控miR-7對OA軟骨細胞凋亡的影響 在回復實驗中,OA軟骨細胞中分別轉染si-NC、si-circPDE4B和共轉染si-circPDE4B+miR-7 inhibitors,結果顯示低表達circPDE4B能夠明顯促進OA軟骨細胞的凋亡(見圖6a,P<0.05),同時促進凋亡相關分子Cleaved-caspase-3蛋白的表達水平(見圖6b,P<0.05)。共轉染si-circPDE4B和miR-7 inhibitors能夠反轉單獨轉染si-circPDE4B對OA軟骨細胞凋亡的影響(見圖6,P>0.05)。

a 流式細胞術檢測細胞凋亡情況
2.6 circPDE4B調控miR-7對OA軟骨細胞ECM降解的影響 低表達circPDE4B能夠明顯抑制SOX9和COL2A1 mRNA的表達水平,促進MMP3和MMP13 mRNA的表達水平(見圖7a,P<0.05)。WB結果顯示低表達circPDE4B能夠明顯抑制SOX9和COL2A1蛋白的表達水平,促進MMP3和MMP13蛋白的表達水平(見圖7b,P<0.05)。共轉染si-circPDE4B和miR-7inhibitors能夠反轉單獨轉染si-circPDE4B對OA軟骨細胞ECM降解的影響(見圖7,P>0.05)。

a RT-qPCR檢測ECM相關分子mRNA的表達水平 b WB檢測ECM相關分子蛋白的表達水平
3 討 論
OA的典型病理改變包括軟骨破壞、骨贅形成和滑膜增生[10]。OA主要特征是基質降解酶的上調,包括屬于金屬蛋白酶家族、含有血小板反應蛋白基序的去整合素和金屬蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTS)以及細胞外間質的丟失[11]。研究顯示circRNA-UBE2G1能夠通過調控miR-373/低氧誘導因子(hypoxia inducible factor,HIF)-1α軸抑制OA軟骨細胞活性和促進軟骨細胞凋亡[12]。circRNA-CER能夠調控miR-136/MMP-13軸抑制OA軟骨細胞增殖和促進軟骨細胞凋亡[12]。circRNA-CER能夠調控miR-136/MMP-13軸促進OA軟骨ECM降解[13]。circ9119在OA軟骨細胞中明顯低表達,過表達circ9119能夠通過miR-26a/人第10號染色體缺失的磷酸酶(phosphatase and tensin homolog deleted on chromosome ten,PTEN)軸抑制OA軟骨細胞的凋亡[14]。然而,circRNAs在OA中的作用還有待進一步研究。
本研究結果顯示circPDE4B的表達水平在OA軟骨組織和軟骨細胞中明顯低表達。細胞功能驗證中,在OA軟骨細胞中分別轉染oe-NC和oe-circPDE4B,轉染oe-circPDE4B后能夠明顯提高circPDE4B在軟骨細胞中的表達水平。過表達circPDE4B能夠明顯抑制OA軟骨細胞的凋亡和凋亡相關分子Cleaved-caspase-3蛋白的表達水平。ECM主要由膠原蛋白(例如Ⅱ、IX和XI型膠原)、糖蛋白和大量蛋白聚糖組成。ECM的降解和OA的發病密切相關,在OA中可表現出ECM相關分子SOX9和COL2A1的下調以及MMP3和MMP13的上調[15]。本研究結果顯示過表達circPDE4B能夠明顯促進SOX9和COL2A1的表達水平,抑制MMP3和MMP13的表達水平,這提示circPDE4B能夠抑制OA軟骨細胞的凋亡和ECM降解。研究顯示多種非編碼RNA能夠通過調控ECM降解參與心肺纖維化、心肌病、心力衰竭、哮喘、OA和癌癥等疾病[16]。
在機制研究中,circRNA最常見的功能為miRNA海綿吸附作用。研究顯示circSERPINE2在OA中明顯下調,低表達circSERPINE2能夠促進OA軟骨細胞凋亡和ECM的降解[17]。本研究結果顯示circPDE4B能夠靶向結合miR-7,過表達circPDE4B能夠明顯抑制OA軟骨細胞中miR-7的表達水平。同時miR-7的表達水平在OA軟骨組織中明顯高于半月板損傷患者軟骨組織,Pearson相關系分析顯示circPDE4B和miR-7在OA患者軟骨組織中的表達水平呈負相關。這提示circPDE4B可能通過靶向調控miR-7參與OA的進展。研究顯示miR-7在OA中明顯高表達,低表達miR-7能夠抑制OA軟骨細胞的凋亡和炎癥,促進OA軟骨細胞的增殖[18]。同時circPDE4B還能夠通過調控miR-181c/HIF-1α軸抑制視網膜病理性血管生成[19]。
在回復實驗中,OA軟骨細胞中分別轉染si-NC、si-circPDE4B和共轉染si-circPDE4B+miR-7 inhibitors,結果顯示低表達circPDE4B能夠明顯促進OA軟骨細胞的凋亡和軟骨ECM的降解,在共轉染si-circPDE4B和miR-7 inhibitors能夠反轉單獨轉染si-circPDE4B對OA軟骨細胞凋亡和軟骨ECM降解的促進作用。研究顯示circPDE4B還能通過調控miR-103a-3p/成纖維細胞生長因子(fibroblast growth factor,FGF)18軸抑制OA軟骨ECM降解[20]。
綜上所述,circPDE4B在OA軟骨組織和軟骨細胞中明顯低表達,circPDE4B能夠通過靶向結合miR-7抑制OA軟骨細胞凋亡和軟骨ECM降解。circPDE4B可能成為治療OA的重要干預靶點。

