miRNA-1305 靶向硫氧還蛋白還原酶1 對三陰性乳腺癌MDA-MB-231 細胞凋亡的影響△
王雨珂,田程,許新華
三峽大學第一臨床醫學院(宜昌市中心人民醫院)腫瘤科,湖北 宜昌 443000
三陰性乳腺癌(triple negative breast cancer,TNBC)是一種特殊類型的乳腺癌,雌激素受體、孕激素受體和人表皮生長因子受體2 表達皆為陰性。TNBC 是目前唯一一類無法行靶向治療的乳腺癌亞型,預后差。TNBC 多發于40 歲以下未絕經年輕女性,占乳腺癌患者的15%~20%[1]。與其他亞型相比,TNBC 患者生存時間更短,確診后前5年的病死率達40%。TNBC 侵襲性高,約46%的患者出現遠處轉移,轉移后中位生存時間僅為13.3個月,術后復發率高達25%。非TNBC 患者平均復發時間為35~67個月,而TNBC患者則為19~40個月。TNBC 患者在復發后3 個月內病死率達到75%[2]。由于TNBC 對內分泌治療和靶向治療均不敏感,所以化療是其主要系統治療方法,但術后輔助放化療效果并不好。貝伐珠單抗在一些國家與化療藥物聯合治療TNBC,患者的生存時間未顯著延長[3]。因此,研究TNBC 的發生、發展及轉移機制,有助于發現更多治療TNBC的有效方法。miRNA是具有19~25個核苷酸的單鏈非編碼RNA,可以改變基因的表達豐度,包括降低基因的表達,少數miRNA 可以誘導基因的表達。研究發現miRNA-1305 在肺癌、肝癌及TNBC 中表達下調[4-6]。但是miRNA-1305 在TNBC發生、發展中的作用及對硫氧還蛋白還原酶1(thioredoxin reductase 1,TXNRD1)表達的影響未見報道。TXNRD1 是吡啶核苷酸-二硫化物氧化還原酶家族成員,與硫氧還蛋白及NADPH組成了硫氧還蛋白系統,在氧化還原平衡中發揮重要作用。研究發現TXNRD1 在TNBC 中表達顯著上調[7]。本研究主要探究miRNA-1305 在TNBC 細胞MDAMB-231 中的表達水平及其上調后對TXNRD1 表達水平及細胞凋亡的影響,現報道如下。
1 材料與方法
1.1 材料與試劑
人乳腺癌細胞MDA-MB-231 購自協和細胞資源中心。DMEM/F12 培養基購自美國Hyclone 公司,馬血清購自北京索萊寶科技有限公司,胎牛血清購自美國Gibco 公司,miRNA-1305 mimic 購自上海瑞基生物科技有限公司,B 細胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)鼠單克隆抗體、Bcl-2 相關X 蛋白(Bcl-2-associated X protein,BAX)鼠單克隆抗體、cleaved caspase 3 鼠單克隆抗體、TXNRD1 兔單克隆抗體、GAPDH 鼠單克隆抗體、辣根過氧化物酶(horseradish peroxidase,HRP)標記抗鼠抗兔抗體均購自美國Cell Signaling Technology 公司。胰蛋白酶、二喹啉甲酸(bicinchoninic acid,BCA)蛋白濃度測定試劑盒、RIPA 裂解液、5×loading buffer、SYBR Green Ⅰ及電化學發光(electrochemiluminescence,ECL)超敏發光液均購自北京索萊寶科技有限公司,CCK8 試劑盒、膜聯蛋白V(Annexin V)-異硫氰酸熒光素(fluorescein isothiocyanate,FITC)細胞凋亡檢測試劑盒均購自上海碧云天生物技術有限公司,Lipofectamine 2000試劑盒購自美國Thermo Fisher Scientific 公司,miRcute miRNA cDNA 第一鏈合成試劑盒購自天根生化科技(北京)有限公司,其余試劑均為國產分析純試劑。
1.2 方法
1.2.1 細胞轉染及分組 將MDA-MB-231 細胞隨機分為3 組:Con 組(對照組)、miRNA NC 組(陰性對照組)和miRNA-1305 mimic 組。使用Lipofectamine 2000 將miRNA-1305 mimic 和NC 轉 染至MDA-MB-231 細胞,Con 組細胞不進行轉染。MDA-MB-231 細胞轉染48 h 后進行處理。
1.2.2 CCK8 檢測細胞活力 MDA-MB-231 細胞按上述方法轉染處理后以104/孔密度接種到96 孔板。放至孵育箱培養24 h 后,加入CCK8 溶液,繼續培養1 h 后,在450 nm 處測定光密度(optical density,OD)值。細胞活力=(OD實驗-OD對照)/OD對照×100%。實驗重復3 次,取均值。
1.2.3 流式細胞儀檢測細胞凋亡 將MDA-MB-231 細胞接種至6 孔板,105/孔,然后按1.2.1 中的方法進行轉染,收集各組細胞。細胞用0.01 mol/L 磷酸鹽緩沖液(phosphate buffered solution,PBS)漂洗,然后加入1×binding buffer 重懸細胞。加入Annexin V-FITC 和碘化丙啶(propidium iodide,PI)染色液各5 μl 混勻,室溫避光孵育10 min。細胞在1 h 內使用BD Accuri C6 流式細胞儀采集數據。
1.2.4 Western blot 檢測凋亡相關蛋白 收集Con組、miRNA NC 組和miRNA-1305 mimic 組的MDAMB-231細胞,使用加入蛋白酶抑制劑混合物的RIPA裂解液冰上裂解細胞提取蛋白,使用BCA 法測定提取的蛋白濃度,提取蛋白液加入loading buffer 后95 ℃處理變性。取30 μg 蛋白樣本進行10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecylsulfate- polyacrylamide gel electrophoresis,SDSPAGE)后,轉印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,使用5%脫脂牛奶(1×TBST)室溫封閉1 h,加入Bcl-2、cleaved caspase 3、BAX、TXNRD1、β-actin 抗體4 ℃孵育過夜。用1×TBST洗滌3 次后再加入二抗室溫孵育2 h,加入ECL 超敏發光液后用凝膠成像系統采集圖像。
1.2.5 實時定量聚合酶鏈反應(real-time quantitative-polymerase chain reaction,qRT-PCR)檢測miRNA-1305 基因表達 使用miRcute miRNA 提取分離試劑盒提取miRNA-1305,然后使用miRcute miRNA cDNA第一鏈合成試劑盒合成cDNA第一鏈。用SYBR Green ⅠPCR 試劑在ABI Stepone Plus Real-time PCR 儀器中進行qRT-PCR 實驗。以U6為內參,采用2-△△Ct法計算miRNA-1305在細胞中的相對表達量。引物序列:miRNA-1305正向,5′-ACAGGCCGGGACAAGTGCAATA-3′,反向,5′-GCTGTCAACGATACGCTACGTAACG-3′;U6正向,5′-AACGCTTCACGAATTTGCGT-3′,反向,5′-CTCGCTTCGGCAGCACA-3′。
1.2.6 Kaplan-Meier 生存分析 采用KM Plot 數據 庫(https://kmplot.com/analysis/index.php?p=service)收集203 例TNBC 患者基因表達譜及預后生存信息,輸入目的基因miRNA-1305,dataset 選擇METABRIC(n=1262),依據cut-off=6.54 將其分為高表達組和低表達組,輸出與目的基因相關的總生存期及統計學分析。
1.3 統計學分析
采用GraphPad Prism 3 統計分析軟件進行統計分析。計量資料以均數±標準差(±s)表示,組間比較采用t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 miRNA-1305 相對表達量的比較及對TNBC患者總生存期的影響
TNBC 細 胞MDA-MB-231 轉 染 后,miRNA-1305 mimic 組miRNA-1305 相對表達量明顯高于Con 組和miRNA NC 組,差異均有統計學意義(P<0.01)(表1)。利用KM Plot 數據庫對203 例TNBC患者進行預后分析發現,miRNA-1305 低表達的TNBC 患者總生存期短于miRNA-1305 高表達患者(HR=0.59,95%CI:0.37~0.96,P=0.032)(圖1)。
表1 3組MDA-MB-231細胞中miRNA-1305相對表達量的比較(±s)
注:*與miRNA-1305 mimic組比較,P<0.01
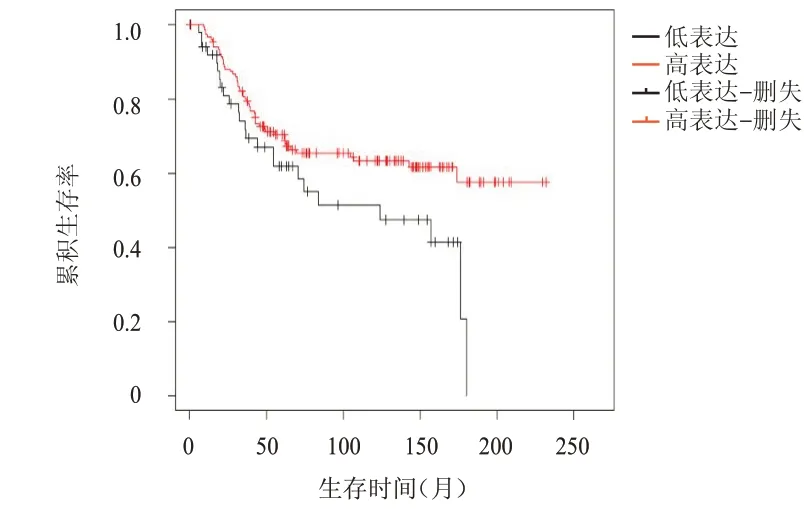
圖1 miRNA-1305低表達(n=51)與高表達(n=152)TNBC患者的生存曲線
2.2 MDA-MB-231 細胞活力的比較
miRNA-1305 mimic 組MDA-MB-231 細 胞 的OD 值明顯低于miRNA NC 組和Con 組,差異均有統計學意義(P<0.01)。(表2)
表2 3 組MDA-MB-231 細胞OD 值的比較(±s)
注:*與miRNA-1305 mimic組比較,P<0.01
組別Con組miRNA NC組miRNA-1305 mimic組OD值100.00±4.36*100.00±4.00*53.00±7.56
2.3 MDA-MB-231 細胞凋亡的比較
miRNA-1305 mimic 組MDA-MB-231 細胞凋亡率 高 于Con 組 和miRNA NC 組,miRNA NC 組MDA-MB-231 細胞凋亡率與Con 組相比,無顯著差異。(圖2)
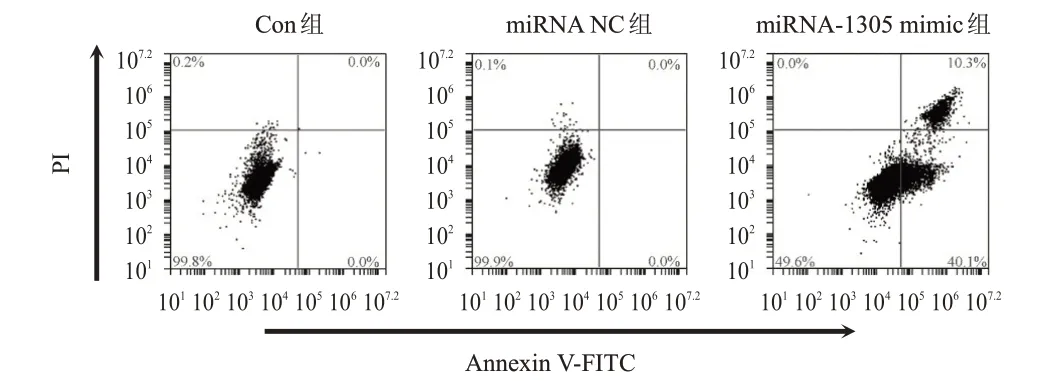
圖2 流式細胞術檢測3組MDA-MB-231細胞凋亡情況
2.4 Bcl-2、BAX、cleaved caspase 3 和TXNRD1蛋白表達的比較
miRNA-1305 mimic 組細胞中Bcl-2、TXNRD1蛋白相對表達量明顯低于Con 組和miRNA NC 組,BAX 和cleaved caspase 3 蛋白相對表達量明顯高于Con組和miRNA NC組,差異均有統計學意義(P<0.01);miRNA NC 組與Con 組細胞中Bcl-2、BAX、cleaved caspase 3 和TXNRD1 蛋白相對表達量比較,差異均無統計學意義(P>0.05)。(圖3、表3)
表3 3 組MDA-MB-231 細胞中Bcl-2、BAX、cleaved caspase 3 和TXNRD1 蛋白表達的比較(±s)
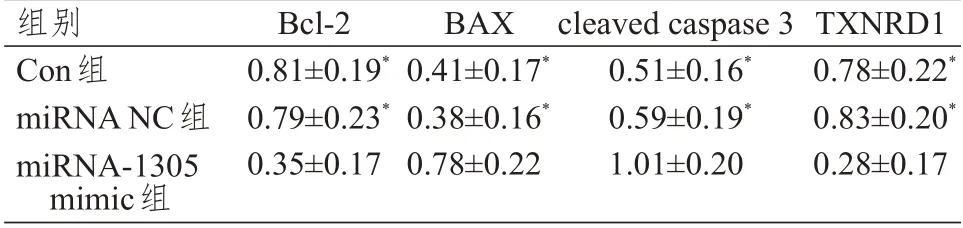
表3 3 組MDA-MB-231 細胞中Bcl-2、BAX、cleaved caspase 3 和TXNRD1 蛋白表達的比較(±s)
注:*與miRNA-1305 mimic組比較,P<0.01
組別Con組miRNA NC組miRNA-1305 mimic組Bcl-2 0.81±0.19*0.79±0.23*0.35±0.17 BAX 0.41±0.17*0.38±0.16*0.78±0.22 cleaved caspase 3 0.51±0.16*0.59±0.19*1.01±0.20 TXNRD1 0.78±0.22*0.83±0.20*0.28±0.17
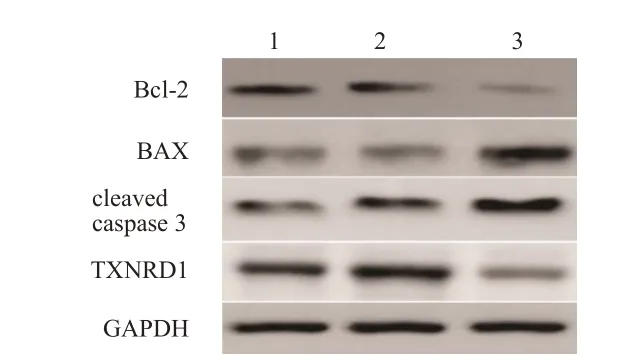
圖3 Western blot法檢測3組MDA-MB-231細胞中Bcl-2、BAX、cleaved caspase 3和TXNRD1蛋白表達情況
3 討論
2015 年miRNA-1305 首次被報道能破壞吸煙者的牙周膜干細胞[8]。在非小細胞肺癌中miRNA-1305 下調后加快腫瘤的轉移,患者的預后更差[8]。此外,miRNA-1305 通過競爭性結合泛素結合酶E2T 抑制蛋白激酶B(protein kinase B,PKB,又稱AKT)通路激活進而抑制肝癌細胞增殖[5]。這說明miRNA-1305 具有抑癌作用。本研究發現,miRNA-1305 可以抑制TNBC 細胞MDA-MB-231 活力,促進細胞凋亡,延長TNBC患者生存期。
硫氧還蛋白系統是一個重要的抗氧化系統,調控腫瘤細胞的細胞內氧化還原穩態和放療敏感性。該系統包括硫氧還蛋白、TXNRD1、NADPH、內源性硫氧還蛋白抑制劑和硫氧還蛋白相關蛋白[9]。TXNRD1 是細胞主要的氧化還原調節因子,腫瘤細胞通常高表達硫氧還蛋白和TXNRD1 以應對活性氧的升高,抑制TXNRD1能夠使活性氧升高從而增加乳腺癌細胞對放療的敏感性[10]。硫氧還蛋白水平升高促進腫瘤細胞的生長及對化療藥物的抗性[11]。TNBC 患者TXNRD1 表達水平顯著上調,抑制TXNRD1 促進了TNBC 細胞的凋亡[12]。沉默TXNRD1及TXNRD1 抑制劑auranofin 均能引起活性氧升高,增強賴氨酰氧化酶對MDA-MB-231 細胞的殺傷作用[13]。TXNRD1 是miRNA-1305 的靶蛋白之一[4]。本研究發現,上調miRNA-1305 表達抑制了TXNRD1 蛋白的表達。
細胞凋亡主要受死亡受體和線粒體通路調控,二者均可激活起始caspase 并激活效應caspase(caspase 3)。Bcl-2 家族蛋白通過線粒體通路介導細胞色素C 等物質的釋放而導致細胞凋亡。本研究結果顯示,miRNA-1305 通過下調Bcl-2,上調BAX、cleaved caspase 3 蛋白的表達,發揮促進MDA-MB-231 細胞凋亡的作用。
綜上所述,miRNA-1305 通過調節TXNRD1的表達影響MDA-MB-231 細胞的凋亡,這為以miRNA-1305 為靶點治療TNBC 提供了新的依據和方向。

