COPD肺組織中MAL、IL-10、TNF-α的表達
鄭鑫鎣 夏之 肖琳琳 彭果然 彭光耀 劉鑫
多數氣道疾病會出現持續反復性炎癥和氣道上皮發生結構性破壞的現象,而COPD 最主要的病理特征是氣道炎癥和氣道重構。T—lymphocyte maturation associated protein(MAL)是一種膜蛋白,在頂端運輸機理中具有關鍵作用,對維持上皮細胞內環境的穩定性具有重要意義。IL-10(白細胞介素-10)常作為抗炎因子,腫瘤壞死因子-α(TNF-α)則被視為促炎因子,二者是COPD中公認的經典因子。本研究通過檢測人肺組織中MAL及COPD大鼠肺組織中MAL、IL-10、TNF-α的表達變化,初步探討三者的相關性,以冀為防治COPD的研究提供依據。
資料與方法
一、材料
1 人肺組織標本
收集2012年1月至2015年7月在南華大學第一附屬醫院行肺葉切除術患者的病歷。納入標準:(1)符合 COPD 的診斷標準(2)通過倫理審查委員會審核(3)病歷資料完整;排除標準: ①除肺癌外合并其他嚴重器官、系統病變。分別選取5例符合標準的COPD及肺功能正常的病例,收集用以與腫瘤組織作對照的癌旁肺組織,所選擇的肺組織遠離肺癌病變5cm以上,病理證實無腫瘤侵襲,肺組織已經完成包埋。
2 大鼠標本和試劑
選取16只健康雄性SD大鼠(250±10g),雄獅香煙(浙江煙草工業有限公司),MAL抗體、LPS脂多糖(Sigma, USA)、DAS染色試劑盒、TNF-α ELISA試劑盒(博奧森公司)、IL-10 ELISA試劑盒、MAL ELISA試劑盒。
二、方法
1 人肺組織
人肺組織已經完成包埋,取肺組織,經過HE染色處理,觀察病理變化。利用免疫組化法檢測MAL 蛋白表達,使用圖像采集系統,測量5個支氣管上皮細胞的整體光密度(IODs),取其平均值,即為MAL 蛋白表達(主體為支氣管上皮細胞)的相對水平。
2 大鼠肺組織
用隨機數表法將購于南華大學動物部的健康SD大鼠體重(250±10)g分為正常組和COPD模型組,每組8只。在實驗的首日和第14日,分別向COPD組大鼠經氣管滴注LPS 溶液(1g/L)200ul,并每天熏吸雄獅牌香煙(焦油15mg,煙堿1.0mg),每只大鼠每天2次,每次1支,每次半小時,共28天。正常對照組在1天和14天時向氣道內滴加等量生理鹽水。COPD模型成功建立后水含氯醛腹腔麻醉,腹主動脈放血處死大鼠。對肺組織進行固定(選用福爾馬林-中性,濃度為10%),石蠟包埋、切片,采用HE染色觀察肺組織損傷和炎性浸潤;免疫組化方法檢測MAL蛋白的表達;ELISA檢測肺組織勻漿上清液中MAL、TNF-α和IL-10的表達。
三、統計分析
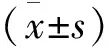
結 果
一、HE染色觀察肺組織損傷和炎性浸潤
正常肺組織結構無異常,肺泡和細支氣管未出現結構性變化,只發現少量的炎癥細胞;COPD組中則出現損傷的上皮黏膜,被破壞的肺泡和窄化后的細支氣管,炎癥細胞浸潤范圍更大(圖1)。

圖1 COPD肺組織病理學變化(HE 染色,200×)
二、免疫組化檢測MAL蛋白的表達
棕黃色顆粒代表MAL蛋白,主要分布于氣道上皮細胞,正常組MAL蛋白的表達明顯高于COPD組,差異有統計學意義(見表1,圖2、3)。

圖2 COPD肺組織中MAL的表達(免疫組化,200×)
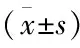
表1 氣道上皮 MAL 蛋白的光密度OD值

圖3 氣道上皮MAL蛋白平均光密度(AOD)
三、ELISA檢測大鼠肺組織勻漿上清液中 MAL、IL-10、TNF-α
表達與正常組相比,COPD組IL-10和MAL水平顯著升高(P<0.05),COPD組肺組織中TNF-α水平顯著高于正常組(P<0.05)(表2,圖4)。

圖4 兩組大鼠肺組織中MAL、IL-10、TNF-α的表達

表2 兩組大鼠肺組織中MAL、IL-10、TNF-α的表達
四、大鼠BALF的細胞計數
與正常組相比,COPD組相關炎性細胞計數明顯增多,差異有統計學意義(表3,圖5)。

表3 大鼠BALF白細胞計數及分類個/L)

圖5 大鼠BALF白細胞計數及分類個/L)
五、采用相關性分析方法探討MAL、IL-10與TNF-α 之間的關系
IL-10與MAL表達水平呈正相關(r=0.749,P<0.001),且關系顯著;TNF-α分別與IL-10、MAL呈負相關(r=-0.840,P<0.001;r=-0.665,P<0.001),且關系顯著(表4,圖6,圖7,圖8)。

表4 MAL、IL-10與TNF-α三者間的兩兩相關性

圖6 MAL與IL-10呈正相關

圖7 MAL與TNF-α 呈負相關

圖8 IL-10與TNF-α 呈負相關
討 論
COPD的發病機制尚未完全明了,其特征是肺彈性組織破壞和(或)炎癥黏性分泌物,且炎癥免疫細胞的相互作用會導致組織的破壞及彈性蛋白、膠原蛋白的改變,最終出現氣道重塑[1]。
本實驗結果顯示,與正常組對比,COPD大鼠中TNF-α表達明顯升高(P<0.05),IL-10表達明顯降低(P<0.05),與文獻一致[2]。TNF-α 已被確定為NF-κB的一種強大激活劑,可放大炎癥過程[3],能誘導其他介質發生瀑布式聚集反應。肺組織內炎癥介質的長期聚集會形成慢性黏液高分泌狀態,同時小氣道炎癥加劇,會使纖維組織形成從而導致氣道重塑,最終發展為慢阻肺。EurlingsI.M.等發現在COPD大鼠肺泡壁和氣道肺泡表面活性蛋白 C 生成細胞中表現出 TNF-α 的過表達[4],提示TNF-α不僅參與了氣道炎癥狀態的形成,其表達會隨氣道炎癥狀態加重而增加。部分學者認為IL-10調控功能的潛在機制是與特定的細胞表面受體(IL-10R)結合,抑制NF-κb的核易位及其dna結合活性,阻斷TNF-α等促炎因子[5]。我們推測,IL-10降低及其調控分泌的促炎因子,如TNF-α的增加可能是氣道上皮結構失去完整性的結果之一。
MAL分布于細胞表面,是一種典型狀態的頂端膜蛋白,可以對于上皮細胞的生理性分泌與吸收功能產生關鍵性調節。在哮喘小鼠肺組織及哮喘血清刺激氣道上皮細胞中的MAL表達均下調[6-7]。可以推測MAL對于炎癥的抑制與延緩效應,對于氣道重塑和高反應性的影響,都是借助上皮細胞的結構形態與功能的維持作用來實現的。COPD的特征之一是持續的氣道慢性炎癥狀態,在COPD肺組織內,是否也存在MAL表達水平的下降呢?本實驗發現正常人及大鼠肺組織中 MAL 表達顯著,此外,在人體內,肺泡與氣道組織的上皮細胞是MAL存在的主要部位,以人和大鼠為研究對象,罹患COPD 的個體均會出現MAL表達水平顯著降低的現象,對比正常組差異顯著(P<0.05),說明 MAL 參與了 COPD 的發病過程。相關性分析顯示MAL水平與IL-10呈顯著正相關(P<0.001);IL-10、MAL顯著負相關于TNF-α(P<0.001),根據實驗結果推斷,MAL表達水平降低后,會對纖維化因子和促炎因子的分泌(主要為氣道內的上皮細胞)產生促進作用,對抗炎因子產生抑制作用,進而加速氣道炎癥的發生,促進氣道重塑進程,最終導致COPD病程發展。本研究僅初步探討了人肺組織中MAL及COPD大鼠模型中MAL、IL-10、TNF-α 的表達和相關性,具體調節機制仍不明確,需深入的研究,以期為 COPD 的防治提供新的思路。

