間質性肺疾病合并糖尿病患者發生認知功能障礙的危險因素分析
新圖葉 劉暉 張瑩 米合熱古力·司馬義
間質性肺疾病(Interstitial pulmonary disease,ILD)是一種慢性、進行性、實質肺疾病,其特征在于肺實質中不同程度的炎癥和纖維化,具有高發病率和死亡率,并且長期ILD患者常伴有一定程度的認知功能障礙[1]。隨著深入研究,糖尿病(diabetes mellitus,DM)相關肺損傷和認知功能障礙,已經得到證實,肺也被認為是糖尿病的靶器官之一,主要表現為肺纖維化[2]。并且DM也被認為是影響ILD治療和不良預后的危險因素[3]。因此本研究擬尋找ILD合并DM患者發生認知功能的危險因素。
資料與方法
一、一般資料
選取2017年6月至2021年6月期間我院接受治療的ILD患者72例,其中包括特發性ILD5例,結締組織病相關ILD 41例,過敏性肺炎相關ILD 7例,急性間質性肺炎13例,血管炎相關ILD 6例,其中合并糖尿病29例。根據蒙特利爾認知評估(Montreal cognitive assessment,MoCA)量表判定有無合并認知功能障礙,39例為認知障礙組,33例為非認知障礙組,其中男46例,女26例;年齡34~73歲,平均年齡(49.85±4.25)歲;體質指數(Body mass index,BMI)21.3~25.6 kg/m2,平均BMI(22.32±2.41)kg/m2;病程0.5~21.0年,>5.0年31例。所有患者家屬均簽署了臨床研究治療知情同意書。并通過我院醫學倫理委員會審查(批號:D210929-01)。
1 納入標準
(1)根據2002年美國胸科學會/歐洲呼吸病學會診斷標準和2013年對ILD的分類和診斷共識明確診斷為ILD[4-5];(2)不伴隨軀體惡性腫瘤,急性感染或肺動脈高壓等疾病;(3)年齡≥18歲。
2 排除標準
(1)伴隨有嚴重的心功能不全,肝腎功能不全等危及生命的疾病,如心力衰竭,腎衰竭等;(2)合并顱腦創傷,顱內腫瘤或精神類疾病;(3)長期飲酒或精神類藥物濫用者;(4)已經接受正壓通氣治療的患者。
3 剔除標準
患者死亡、自動出院、中途退出則停止研究。
二、方法
收集患者的一般臨床資料,包括者性別,年齡,BMI,合并癥,血氧飽和度(Oxygen saturation SpO2),心率,呼吸頻率,肺功能及影像學結果等。所有患者入院后次日清晨抽取空腹狀態下肘靜脈血10mL,用于測定白細胞計數(White blood cell count,WBC),C反應蛋白(C-reactive protein,CRP)、降鈣素原(Preprocalciton,PCT)、低密度脂蛋白(Low density lipoprotein,LDL-C),肌酐(Cr),空腹血糖,糖化血紅蛋白(hemoglobin A1c,HbA1c)水平等指標。認知功能評估采用蒙特利爾認知評估(Montreal cognitive assessment,MoCA)量表,該量表包括視空間與執行功能、注意力、定向力等7個項目,總分0~30分,評分越低表明認知功能越差,MoCA量表>26分為認知功能正常,≤26分為認知功能障礙[6]。
患者入院后一周內完成肺功能檢查,同時記錄第1秒用力呼氣容積(1 second forced expiratory volume,FEV1)、用力肺活量(Forced vital capacity,FVC),肺一氧化碳彌散量(diffusion capacity for carbon monoxide of lung,DLCO), 數據均用實測值占預計值百分比表示。
患者取仰臥位,高分辨CT參數設置為層厚1mm。根據病變累及的范圍及程度計算 Warick評分:磨玻璃影 1分,不規則胸膜邊緣2分,小葉間隔增厚或胸膜下線征3分,蜂窩狀影4分,胸膜下囊腫5分。累及1~3個肺段1 分,4~9個肺段2分,>9個肺段3分,最高30分[7]。
三、統計學方法
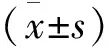
結 果
一、一般臨床資料
合并DM的ILD患者的MoCA量表各維度評分除語言和定向力外,均顯著低于單無DM的ILD患者,差異均具有統計學意義,P<0.05(見表1)。與非認知障礙組相比,認知障礙組的糖尿病的比例,Warrick評分、空腹血糖、HbA1c均顯著升高,FEV1,FVC和DLCO均顯著降低,差異均具有統計學意義,P<0.05(見表2)。

表1 有無合并糖尿病的ILD患者MoCA量表各維度評分比較

表2 患者一般臨床資料比較
二、ILD患者發生認知功能障礙的多因素回歸分析
以是否發生認知功能障礙為因變量,將表1中的具有統計學差異的因素作為自變量進行賦值,多因素Logistic回歸分析結果顯示DLCO,HbA1c均為ILD患者發生認知功能障礙的危險因素,均P<0.05(見表3)。

表3 ILD患者認知功能障礙的多因素Logistic回歸分析
三、不同危險因素預測ILD發生認知功能障礙的ROC曲線分析
ROC分析結果顯示HbA1c、DLCO的AUC分別為0.752,0.768。敏感度分別為69.2%,64.1%。特異度分別為63.7%,63.6%。(見表4,圖1)。HbA1c和DLCO的聯合檢測結果顯示AUC為0.805,敏感度和特異度分別為76.9%,72.7%。

表4 ILD患者發生認知功能障礙的ROC曲線分析

圖1 不同危險因素預測認知功能障礙的ROC曲線分析
討 論
肺部疾病對神經認知障礙影響的研究表明,多種肺部疾病患者的認知過程受損,繼發于肺部疾病的神經認知功能受損,可能對患者的整體生活質量,尤其是治療依從性產生負面影響[8]。ILD包括影響肺間質的各種肺部疾病,它可能由吸入物質、藥物、感染、結締組織病或特發性原因等多種因素引起,對患者的生活質量有明顯的負面影響[9]。盡管既往研究認為認知功能障礙主要與呼吸衰竭的持續時間和缺氧程度有關[10],但由于ILD的異質性,在非缺氧患者中也存在一定的認知功能障礙,如伴隨糖尿病等全身性疾病,也可能對中樞神經系統產生直接不利影響[3,10]。因此本研究擬尋找合并DM的ILD患者發生認知功能障礙的危險因素,為后續的機制研究提供方向。
本研究結果顯示合并DM的ILD患者的MoCA量表各維度評分除語言和定向力外均顯著低于無DM的ILD患者,多因素分析結果也顯示HbA1c升高是ILD患者發生認知功能障礙發生的危險因素,表明合并有DM會加重ILD患者的認知功能損害。盡管目前尚無直接針對ILD和糖尿病的共同發病機制的研究,但ILD和DM的肺部并發癥在臨床特征,HRCT成像和組織病理學變化上均有共同特征,如FVC、FEV1和 DLCO均顯著降低[11],肺基底層毛細血管增厚、肺泡壁中膠原蛋白含量增加等[12]。伴隨著研究的深入,還發現ILD和DM之間的作用是相互的,均會加重患者的認知功能障礙[13],并且DM會導致ILD肺纖維化癥狀逐漸加重,二者之間可能還存在共同的作用基因和易感位點,并且作用機制高度復雜性和多樣性[14]。高血糖會導致氧化應激和細胞趨化,并導致自由基生成和抗氧化活性之間的不平衡[15],導致肺中的微血管損傷,肺泡上皮和肺毛細血管基底層增厚,肺毛細血管血容量減少,肺泡壁增厚和灌注減少的結合,導致通氣灌注不匹配,從而導致擴散能力受損[16]。而氧化應激、內皮微損傷和血小板活化伴隨細胞因子趨化,被認為是ILD起始和發展的重要機制[17]。此外伴隨著胰島素敏感性下降,海馬、下丘腦、紋狀體和額葉等富含胰島素受體的大腦區域極易發生神經變性[18],這種神經元生成以及潛在的生化改變,可能會進一步加重患者的認知障礙。
本研究單因素分析結果顯示合并認知功能障礙的ILD患者肺功能檢查結果均顯著低于認知功能正常的ILD患者,ILD患者主要表現為限制性通氣功能障礙,由于肺泡間隔增生和胸膜纖維化加重,導致胸膜粘連,肺擴張受限,因此FVC和FEV1均明顯降低,而呼吸膜伴隨著纖維增生增加了氣體的彌散距離, 導致彌散功能障礙,即DLCO顯著降低[19]。當通氣功能障礙加重時伴隨患者腦氧供減少,可能導致繼發于缺氧導致的腦小血管病的解剖結構和功能變化,進而發生認知功能障礙[20]。有關腦彌散張量成像研究顯示限制性通氣功能障礙患者的腦組織中彌散模式顯著異常,與認知功能的強烈相關,表明腦組織微觀結構廣泛惡化[21]。但多因素分析結果顯示僅DLCO是ILD患者發生認知功能障礙的獨立危險因素,這可能是因為FVC和FEV1是肺疾病的標準生理指標,但反映肺氣腫和血管異常的敏感性不如DLCO[22]。而DLCO不僅與限制性通氣功能障礙的動脈硬化密切相關[23],而且還是ILD進展的敏感指標[19]。
本研究局限性在于首先本研究為單中心研究,樣本量較小,仍需進一步的多中心大樣本量研究證實該結論。其次有關ILD和DM的共同發病機制尚未明確,仍需進一步的體內外實驗進行驗證。總之,本研究結果顯示合并DM能增加ILD患者認知功能障礙的發生風險,DLCO,HbA1c水平是ILD合并DM患者發生認知功能障礙的獨立危險因素。

