LED綠光照明對壩上長尾雞胚胎期小腸及法氏囊發育的影響
趙惠媛,郝文文,耿立英,張傳生,李祥龍
(河北科技師范學院動物科技學院,河北省特色動物種質資源挖掘與創新重點實驗室,河北 秦皇島,066004)
禽類作為一種色敏性動物,對于不同波長光的辨色力極強,繼而影響其生長發育、生產性能、免疫功能等[1]。郝文文等[2]研究發現,孵化期使用適宜綠光照明可以促進雞胚肌纖維發育;譚子超等[3]研究發現,以綠光LED為光源間歇照明可提高肉雞生長性能,毛雞出欄的經濟效益最高;謝電等[4]在研究中使用15 lx的綠光照明生長早期(0~6 d)雛雞,通過對小腸各段絨毛高度、粘膜厚度及杯狀細胞數量等指標進行測定,發現該條件下綠光照可在一定程度上改善肉雞小腸黏膜結構,繼而提高小腸消化吸收能力,促進生長發育;李然等[5]研究發現,藍光在產蛋高峰期及后期可顯著提高海蘭褐蛋雞脾臟細胞免疫功能;段龍等[6]研究發現,間歇光照可顯著提高肉仔雞(14~42 d)的脾臟和法氏囊指數。除了作為一種消化器官,小腸還具有免疫功能,其粘膜層中的淋巴細胞可對腸道中的病原體發生相應的免疫反應,屬于腸道相關淋巴組織中的重要成員[7]。作為腸道免疫系統的重要組成部分,腸道相關淋巴組織還包括法氏囊、腸道淋巴結、盲腸扁桃體、幽門扁桃體[8]等免疫器官,其中法氏囊是禽類所特有的中樞免疫器官,是B淋巴細胞發育分化的場所,多能干細胞于雞胚孵化發育的第8~18天來到法氏囊[9],在激素作用下形成具有免疫活性的B淋巴細胞,以淋巴濾泡的形式存在。禽類作為一種經濟型動物,提高其消化能力、增強免疫功能,可顯著改善其生產性能,繼而帶來良好的經濟效益。壩上長尾雞生存于壩上高寒環境中的特殊性,造就了其抗寒力強、耐粗飼的優良特性[10],然而其生產性能較低、產肉率低限制了其在養殖領域中的發展,在孵化階段雞消化系統的早期發育對于實現出殼后雛雞的體質量增長發育尤為關鍵,而與之相關的腸道相關淋巴組織作為機體免疫的第一道屏障,可有效抵御病原體的侵襲,增強機體免疫力。因此,筆者以壩上長尾雞為研究對象,研究不同強度的LED綠光照明對孵化期小腸及法氏囊發育的影響,為在生產實踐中合理改良壩上長尾雞種蛋孵化條件提供一定的科學依據。
1 材料與方法
1.1 試驗材料
試驗所需120枚質量相近的壩上長尾雞種蛋購自張家口市綠色田園禽業科技有限公司,孵化前對其進行消毒、編號、稱質量。
試驗所需的甲醛溶液、無水乙醇、二甲苯、蘇木素染液、伊紅染液、鹽酸、石蠟及中性樹脂等均購自石家莊豐悅科技有限公司。
奧林巴斯BX-40倒置顯微鏡購自OLYMPUS公司(中國)。NLF-320型微電腦全自動孵化器購自山東農科孵化設備有限公司。
1.2 試驗方法
1.2.1試驗設計 選取重量相近的壩上長尾雞種蛋120枚,隨機分成4組,分別為弱光組(30~80 lx綠光),中光組(90~140 lx綠光),強光組(150~200 lx綠光),黑暗組。孵化條件:1~6 d溫度38.0 ℃,濕度60%;7~18 d溫度37.8 ℃,濕度55%;19~20 d溫度37.2 ℃,濕度65%。各光照組種蛋分別于孵化的10~18 d給予12 h光照-12 h黑暗的照明,光源波長為525 nm±10 nm。各組分別于16,18,20日胚齡時收集6枚種蛋,二氧化碳法處死雞胚后,取小腸各段(十二指腸、空腸、回腸)和法氏囊,置于1.44 mol/L甲醛中固定24 h,以備待測試驗。
1.2.2石蠟切片 本試驗對不同組別的雞胚十二指腸、空腸、回腸及法氏囊進行了組織石蠟切片并染色,以觀察不同組別雞胚各器官的顯微結構。石蠟切片步驟如下:
①分別將各組不同胚齡的雞胚十二指腸、空腸、回腸及法氏囊用1.44 mol/L甲醛溶液固定24 h。
②梯度脫水(順序及時間為50%(體積分數,下同)的乙醇1 h,70%乙醇1 h,85%乙醇1 h,95%乙醇40 min共2次,無水乙醇30 min共2次)。
③二甲苯透明(每小時更換1次二甲苯,共3次)。
④浸蠟與包埋:將透明化的組織浸入60 ℃的石蠟中進行浸蠟處理,共3次,每次1 h,隨后將組織包埋于包埋盒中。
⑤塑型與切片:包埋好的石蠟塊塑型成棱臺狀固定于木托上,即可用切片機進行組織切片,厚度為5 μm。
⑥展片與粘片:切好后的組織薄片需在42 ℃水浴鍋中進行展片,隨后撈至涂有蛋白甘油的載玻片上,于37 ℃恒溫箱中過夜烘干后即可進行H.E染色。
1.2.3H.E染色 H.E染色法又稱之為蘇木素—伊紅染色法,染色步驟如下:
①首先將石蠟切片利用二甲苯進行脫蠟處理,共2次,每次10 min。
②將切片依次在梯度濃度下降的酒精中浸泡處理(順序為無水乙醇2 min,無水乙醇2 min,95%乙醇2 min,80%乙醇2 min,70%乙醇2 min),最后用蒸餾水洗2 min。
③將切片放入蘇木素染液中浸泡3 min。
④將切片放入1%(體積分數)鹽酸酒精中酚化2下,自來水沖洗3 min。
⑤將切片放入淡氨水中返藍20 s,自來水沖洗5 min,直至顯微鏡下細胞核呈現清晰的藍色。
⑥將切片放入伊紅染液中染色3 min。
⑦切片依次放入70%乙醇30 s,80%乙醇30 s,90%乙醇30 s,95%乙醇5 min共2次,無水乙醇5 min共2次進行脫水處理。
⑧切片放入二甲苯中進行透明處理,每次10 min,共2次。
⑨擦片后利用中性樹脂封片,隨后鏡檢即可。
1.2.4顯微鏡觀察及數據采集 利用奧林巴斯BX-40倒置顯微鏡進行組織切片觀察,并利用顯微鏡成像系統拍攝照片進行數據采集。分別測量各組雞胚E16,E18和E20時十二指腸、空腸及回腸絨毛高度及肌層厚度,絨毛高度以每張切片中最長的10根絨毛長度平均值為測定數值,肌層厚度以每張切片最厚肌層位置厚度為測定數值。分別測量各組雞胚E16,E18,E20時法氏囊濾泡面積,以每張切片中最大的10個濾泡面積平均值作為測定數值。
1.2.5數據處理與統計分析 本次試驗采用SPSS 20.0統計學軟件進行單因素方差分析,利用LSD檢驗方法進行多重比較,數據結果用“平均值±標準差”表示,P<0.05表示存在顯著差異。
2 結果與分析
2.1 不同光照度LED綠光照明對壩上長尾雞胚胎期小腸絨毛和胚層發育的影響
觀察各組雞胚十二指腸段組織切片(圖1),并對其絨毛高度和肌層厚度進行測量。結果表明:在16胚齡時,弱光組絨毛高度顯著高于黑暗組(P<0.05),而中光組和強光組與黑暗組無顯著性差異(P>0.05)(表1);中光組肌層厚度顯著高于弱光組和強光組(P<0.05),黑暗組與該3組無顯著性差異(P>0.05)。在18胚齡,4組間絨毛高度均存在顯著性差異(P<0.05),其中中光組最高,強光組最低;中光組肌層厚度顯著性高于黑暗組(P<0.05),其余各組間無顯著性差異(P>0.05)。在20胚齡,弱光組絨毛高度顯著高于其余3組(P<0.05),其中中光組和強光組絨毛高度顯著性低于黑暗組(P<0.05);中光組肌層厚度顯著性高于弱光組(P<0.05),其余各組間無顯著性差異(P>0.05)。

注:E16,E18,E20分別代表16胚齡,18胚齡,20胚齡。下同。圖1 不同光照度LED綠光孵化下壩上長尾雞胚胎期十二指腸顯微結構
觀察各組雞胚空腸段組織切片(圖2),并對其絨毛高度和肌層厚度進行測量。結果表明:在16胚齡,弱光組絨毛高度顯著性高于中光組和黑暗組(P<0.05),強光組絨毛高度顯著性低于中光組和黑暗組(P<0.05)(表1);試驗各組間肌層厚度均存在顯著性差異(P<0.05),其中弱光組最高,黑暗組最低。在18胚齡,中光組和黑暗組絨毛高度顯著性高于弱光組和強光組(P<0.05),中光組和黑暗組之間無顯著差異(P>0.05);而弱光組和中光組肌層厚度顯著性高黑暗組(P<0.05),強光組與黑暗組之間無顯著差異(P>0.05)。在20胚齡,弱光組絨毛高度顯著性高于其它3組(P<0.05),其余各組間無顯著性差異(P>0.05);強光組肌層厚度顯著性高于弱光組和中光組(P<0.05),黑暗組肌層厚度最低,顯著性低于另外3組。
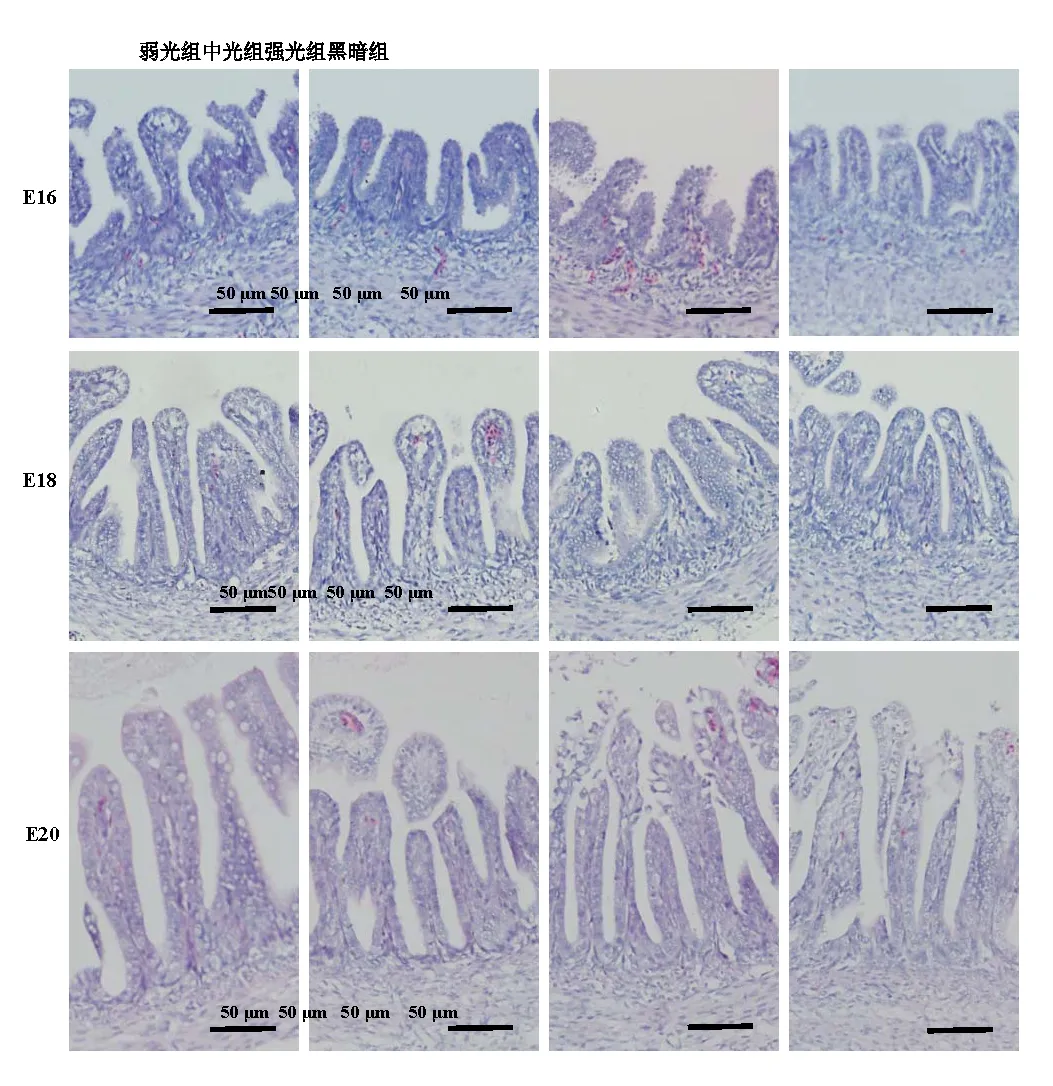
圖2 不同光照度LED綠光孵化下壩上長尾雞胚胎期空腸顯微結構
觀察各組雞胚回腸段組織切片(圖3),并對其絨毛高度和肌層厚度進行測量。結果表明:在16胚齡時,弱光組和中光組絨毛高度顯著性高于黑暗組(P<0.05),強光組與黑暗組間無顯著性差異(P>0.05)(表1);肌層厚度中光組最高,弱光組次之,均顯著性高于黑暗組(P<0.05),強光組與黑暗組間無顯著性差異(P>0.05)。在18胚齡時,黑暗組絨毛高度顯著高于另外3組(P<0.05),強光組最低;中光組和強光組肌層厚度顯著高于黑暗組(P<0.05),弱光組與黑暗組間無顯著差異(P>0.05)。在20胚齡,中光組和強光組絨毛高度顯著低于黑暗組(P<0.05),弱光組與黑暗組間無顯著差異(P>0.05);黑暗組肌層高度顯著低于另外3組(P<0.05)。
2.2 不同強度LED綠光照明對壩上長尾雞胚胎期法氏囊發育的影響
觀察各組雞胚法氏囊組織切片(圖4),并對其濾泡大小進行測量。結果發現:在16胚齡時,弱光組法氏囊濾泡的平均面積顯著性大于其余3組(P<0.05),中光組和強光組略大于黑暗組,差異不顯著(P>0.05)(表2);到了18胚齡,弱光組法氏囊濾泡平均面積仍然顯著性大于中光組和黑暗組(P<0.05),此時強光組法氏囊濾泡平均面積顯著性小于中光組和黑暗組(P<0.05);在20胚齡時,3個光照組法氏囊濾泡平均面積均顯著性大于黑暗組(P<0.05)。
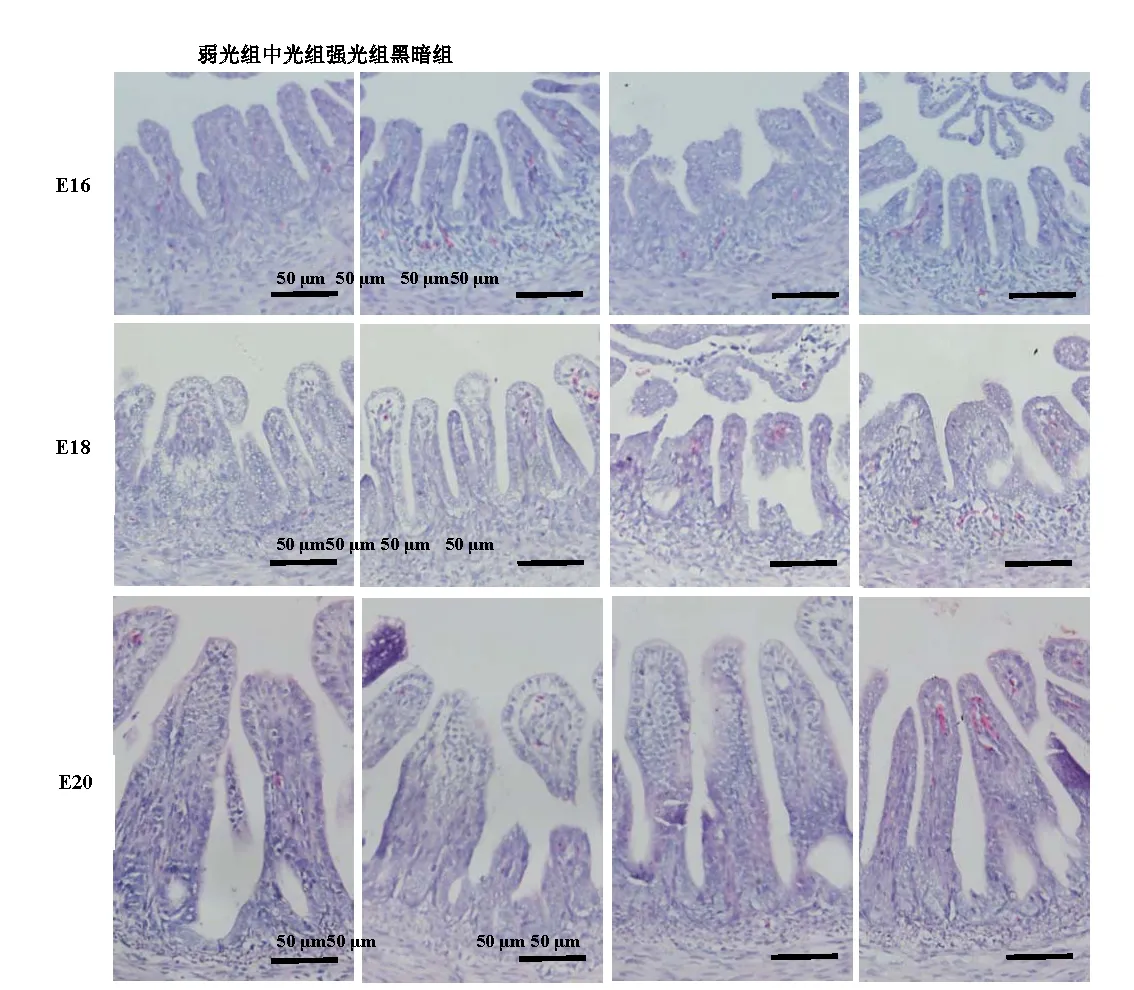
圖3 不同光照度LED綠光孵化下壩上長尾雞胚胎期回腸顯微結構
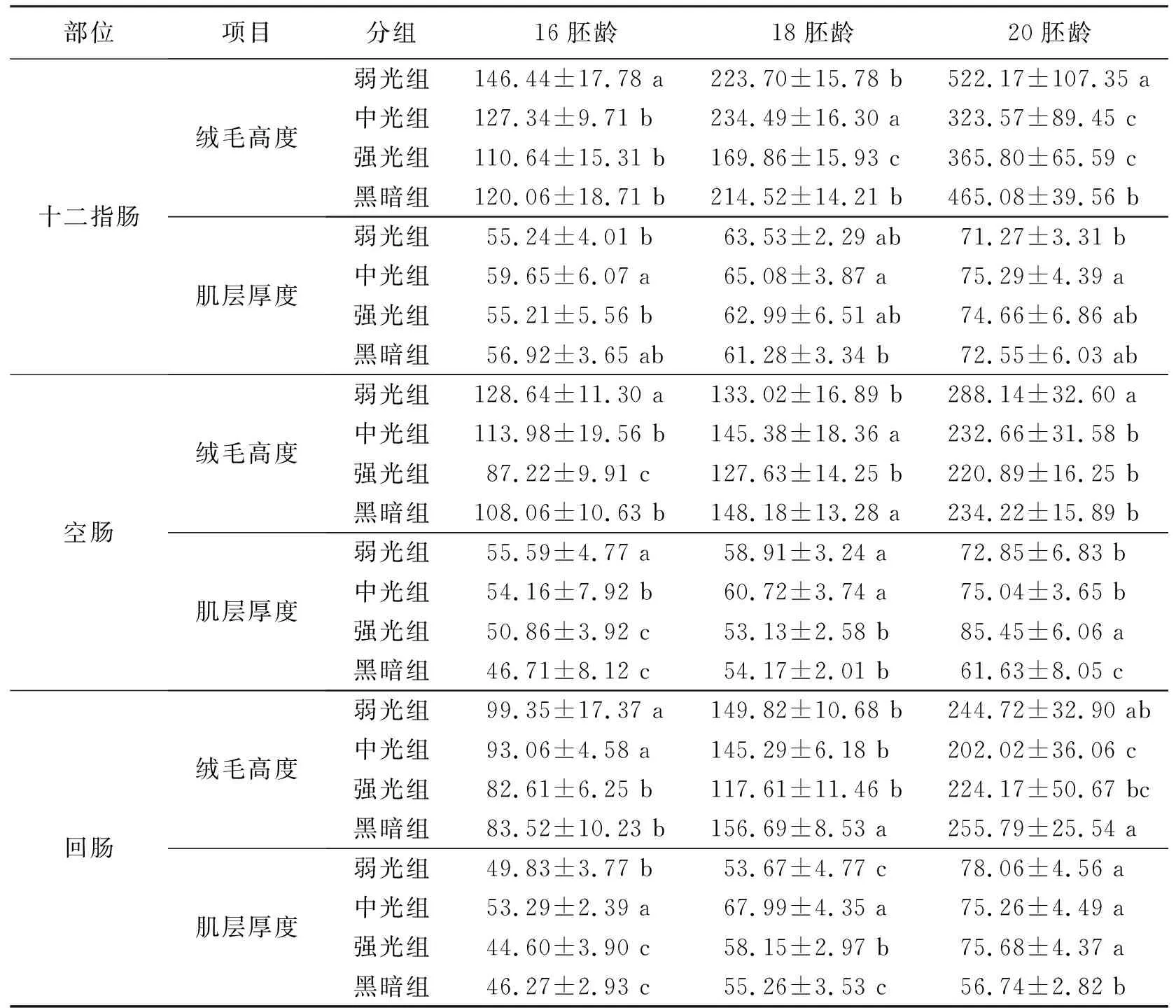
表1 不同光照度LED綠光對壩上長尾雞胚胎期小腸絨毛和肌層發育的影響 μm
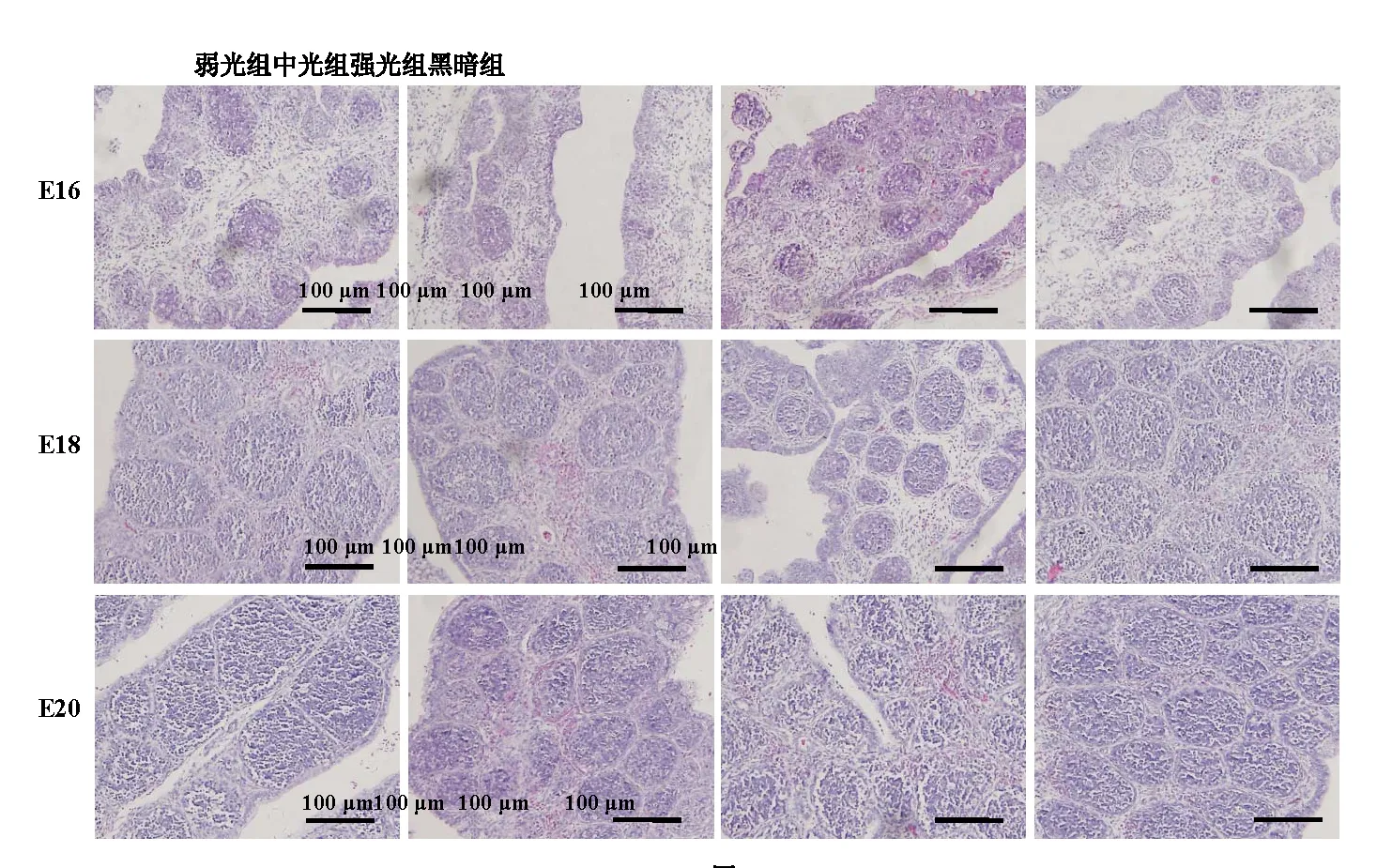
圖4 不同光照度LED綠光孵化下壩上長尾雞胚胎期法氏囊顯微結構

表2 不同光照度LED綠光對壩上長尾雞法氏囊濾泡平均面積的影響 μm 2
3 討 論
3.1 不同光照度LED綠光對壩上長尾雞胚胎期小腸發育的影響
在種蛋孵化過程中,第15~20胚齡期是小腸消化吸收與免疫功能快速發育的關鍵時期[11]。本次試驗以壩上長尾雞為研究對象,研究該階段綠光照明對小腸發育的影響,結果表明,弱光組(30~80 lx)雞胚小腸各段的絨毛高度及肌層厚度顯著高于黑暗組,表明該光照條件利于壩上長尾雞胚胎期小腸的發育。這與謝電等[4]研究綠光對AA肉雛雞腸道發育中的結果一致。在雞胚發育過程中,15胚齡時小腸腸壁的粘膜層、粘膜下層、肌層及漿膜結構已初步形成,此時粘膜層向內突起形成絨毛結構,絨毛上皮主要由柱狀細胞和杯狀細胞構成,細胞尚不具備吸收營養物質的能力;直至18胚齡,絨毛已增高至小腸壁厚度的一半,細胞功能日益完善[11];到20胚齡時,小腸絨毛呈現長葉狀,其柱狀細胞已經完全成熟、具有選擇性吸收的能力,杯狀細胞分泌的粘液,一方面促進營養物質的消化吸收,另一方面與柱狀細胞分泌的糖蛋白結合進而形成腸道粘膜上皮表面的保護層,成為抵御潛在致病原的物理屏障[12,13]。30~80 lx光照度下雞胚小腸絨毛高度顯著提高,意味著其上皮中柱狀細胞和杯狀細胞的數量也隨之上升,有利于增強孵化后雛雞的營養吸收能力,提高其生長能力;另外,小腸絨毛上皮間存在淋巴細胞,可以抵御腸道病原微生物的侵襲從而保護機體。小腸肌層由平滑肌構成,受植物性神經調控而進行有節律的收縮,肌層增厚,其收縮力提高,加快小腸壁的蠕動,從而加快腸道營養物質進入到循環系統。適宜強度的綠光照明可通過促進雞胚的小腸發育提高營養吸收能力,從而促進生長發育。
3.2 不同光照度LED綠光對壩上長尾雞胚胎期法氏囊發育的影響
法氏囊是禽類特有的中樞免疫器官,是B淋巴細胞發育成熟的場所,同時其還與盲腸扁桃體、PP結等共同構成腸道粘膜相關淋巴組織,構成機體免疫的第一道屏障[14]。禽法氏囊的發生是一個較為復雜的過程,4~5胚齡時即產生法氏囊原基[15],直至第15~16胚齡才形成大小不一的淋巴濾泡,在18胚齡時法氏囊基本形成,隨著胚齡的增加,法氏囊淋巴濾泡之間界限清晰,面積明顯增大[16]。本試驗條件下,在20胚齡時,各光照組壩上長尾雞的法氏囊濾泡平均面積均顯著大于黑暗組。與黑暗組相比,弱光組、中光組和強光組雞胚法氏囊濾泡平均面積分別增長了49.43%,33.60%,27.66%。這表明在胚胎發育過程中,綠光照射可以促進雞胚法氏囊的發育,器官形態可影響功能變化,由此推測綠光可通過增大法氏囊的濾泡面積從而提高其免疫功能,最終促進機體生長發育。
4 結 論
在本試驗中,孵化期使用綠光照明種蛋對于壩上長尾雞胚胎期小腸各段和法氏囊的發育產生了一定影響,其中使用30~80 lx的綠光照明可促進小腸絨毛發育、肌層增厚,法氏囊濾泡增大,而光照度過高對于腸道的發育則有一定的抑制作用。

