基于G-四鏈體的PCR-RCA雙重擴增技術檢測沙門氏菌
劉健慧,張先舟,張蘊哲,李蘭茹,王紅靜,高 潔,耿鳳珍,檀建新,*
(1.河北農業大學食品科技學院,河北 保定 071000;2.河北旅游職業學院,河北 承德 067000;3.河北大學附屬醫院,河北 保定 071000)
沙門氏菌()是一種革蘭氏陰性食源性病原菌,屬腸桿菌科,常以家畜、家禽作為傳染源。進食被沙門氏菌污染而未煮熟的食品或未消毒的奶制品可誘發嘔吐、腹瀉等癥狀。在我國,75%的細菌性食物中毒事件由沙門氏菌造成,因此為保障食品安全,急需快速靈敏的檢測手段對其監控。
目前,食源性病原菌的檢測手段主要包括傳統的微生物學檢測、生理生化鑒定和現代的免疫學方法、分子生物學方法等。純培養方法雖作為檢測的金標準,但需要在各種選擇性培養基中進行分離培養、形態檢測、生化鑒定,檢測耗時長,失去了快檢的應用意義;免疫學方法雖不需要復雜的儀器,檢測準確性好,但制備高特異性單克隆抗體相對困難、成本高,限制了其使用前景;分子生物學方法主要以核酸檢測方法為主,常分為聚合酶鏈式反應(polymerase chain reaction,PCR)、多重PCR、實時PCR等非等溫擴增技術和環介導等溫擴增、滾環擴增(rolling circle amplification,RCA)、鏈置換擴增等等溫擴增技術。核酸檢測技術雖存在較多弊端,如過于敏感導致假陽性和引物設計相對復雜、需要大量篩選驗證等,但其檢測周期短、特異性強、可進行多種病原菌同時檢測,精準定量,故取得了廣闊的發展。
核酸信號輔助放大是快檢有效、直接的策略。生物素-親和素連接、酪酰胺信號放大、納米顆粒信號放大、核酸染料信號放大等技術均已實現廣泛應用,但需額外在體系中添加或標記信號放大因子,使實驗設計復雜,且靈敏度易受到添加量的干擾。而G-四鏈體作為富G的單鏈功能核苷酸,將其自身或互補堿基設計到相關序列中,可開發出多種成本低、有效性強的生物傳感器。如水溶性苯并噻唑染料硫黃素T (thioflavin T,ThT)可特異性識別并嵌入G-四鏈體凹槽中,導致熒光信號顯著增強,進而通過檢測熒光強度實現信號放大。
本研究先針對沙門氏菌基因設計PCR擴增引物,并在下游引物的5’端標記15個A堿基(15A),通過PCR擴增積累誘發RCA反應的環外“引物”。同時將G-四鏈體互補序列和15個A堿基設計成含有黏性末端的發卡結構,并連接成啞鈴環狀DNA,作為RCA擴增的模板。以PCR產物為“橋梁”,將PCR與RCA偶聯,當沙門氏菌基因組DNA存在時,啟動RCA擴增,不斷積累富G序列,最終通過測量雙重擴增產物與ThT混合溶液的熒光強度,實現對沙門氏菌的定量檢測。該方法在無靶標的擴增體系中無G-四鏈體生成,能夠極大降低背景值,為食品中致病菌的快檢提供新策略。
1 材料與方法
1.1 材料與試劑
志賀氏菌(ATCC 12022)、單核細胞性李斯特菌(CICC 21633)、金黃色葡萄球菌(CICC 21600)、銅綠假單胞菌(ABCC 0927)、大腸埃希氏菌(CMCC 44752)、甲型副傷寒沙門氏菌(CICC 21501)、鼠傷寒沙門氏菌(CICC 21484)、丙型副傷寒沙門氏菌(CICC 21512)均由河北農業大學生物工程實驗室提供;核酸序列由金唯智生物科技有限公司合成;細菌基因組DNA提取試劑盒、DNA純化回收試劑盒 天根生化科技有限公司;2×EsMaster Mix(Dye)、PAGE凝膠制備試劑盒 北京康為世紀生物科技有限公司;100 bp DNA ladder、T4 DNA聚合酶 寶生物工程(大連)有限公司;50 bp ladder 北京聚合美生物科技有限公司;2.0 DNA聚合酶 NEB(北京)有限公司;ThT 北京Solarbio公司;其他主要試劑均為國產分析純。
1.2 儀器與設備
MTH-012型旋渦混合儀 海門其林貝爾儀器制造有限公司;070-851型PCR儀 德國Biometra公司;DYY-10 C型電泳儀 北京市六一儀器廠;JY04S-3E型凝膠成像分析系統 北京科普爾科技發展有限公司;K5500型超微量核酸測量儀 北京凱奧科技發展有限公司;FP-750熒光分光熒光計 日本分光株式會社。
1.3 方法
1.3.1 細菌基因組提取
取1 mL過夜培養菌液,提取細菌基因組DNA,具體操作方法見細菌基因組DNA提取試劑盒說明書。并用核酸測量儀對其DNA濃度及純度進行測定。
1.3.2 引物及啞鈴環設計
通過Primer Premier 5設計了上游引物(HF)序列:5’-GAAAGAGCAACTGGCCAACG-3’,下游引物(TR)序列:5’-AAAAAAAAAAAAAAAATGCTTGAGCTGATTGCGC-3’。通過DNAMAN設計了可在T4 DNA連接酶的作用下連接成穩定啞鈴型的發夾(CP)序列:5’-Phosphate-ATGAACAGG TCTAAAAAAAAAAAAAAACCCAACCCGCCCTA CCCTTTCCTGTTC-3’。并合成了15個T的環外引物5’-TTTTTTTTTTTTTTT-3’,驗證實驗的可行性。
1.3.3 PCR條件優化
以沙門氏菌基因組DNA為模板,采用HF與TR通過PCR擴增目標序列,獲得PCR產物觸發后續RCA擴增。為確保得到大量包含15個堿基T(15T)的PCR產物且控制后續誘發RCA反應的“引物”量,達到相對定量效果,本實驗對初始引物濃度進行優化,設置了1、2、3、4 μmol/L的梯度變化,在相同的濃度添加量及模板濃度下,尋求最佳的引物初始濃度,最終確定PCR體系為:25 μL 2×EsMaster Mix(Dye),2 μL HF(3 μmol/L),2 μL TR(3 μmol/L),2 μL各濃度基因組DNA,ddHO補至50 μL。
本實驗在TR的5’端額外標記了15個A堿基,目的是在PCR結束后獲得大量包含15個T的PCR產物。這就造成了引物對的不等長,從而設置了54、56、58、60、62、64 ℃退火溫度梯度優化,最終確定PCR程序為:95 ℃預變性5 min,95 ℃變性30 s,56 ℃退火30 s,72 ℃延伸10 s,72 ℃延伸5 min,28個循環。PCR產物采用2%的瓊脂糖凝膠電泳驗證(140 V、40 min),后利用凝膠成像系統進行觀察分析,并按照DNA純化回收試劑盒步驟純化PCR產物。
1.3.4 啞鈴環狀DNA的制備
借助T4 DNA連接酶能封閉DNA鏈上切口的作用,將所設計的啞鈴環狀DNA發夾前體的黏性末端連接。并對發夾DNA的反應終濃度及T4 DNA連接酶的加入量進行優化,保障發夾DNA連接成啞鈴環的效率。發夾DNA(10 μmol/L)終濃度梯度設置為1、0.5、0.25、0.1 μmol/L,T4 DNA連接酶(350 U/μL)用量梯度設置為0.5、1.0、1.5、2、2.5 μL。最終確定連接反應為5 μL發夾DNA、10 μL 10×T4 DNA連接緩沖液和83 μL ddHO混合均勻后95 ℃保溫5 min后37 ℃孵育30 min,使發夾DNA變性,充分進行堿基互補配對。后加入2 μL T4 DNA連接酶,37 ℃孵育3 h,65 ℃滅酶10 min,所制得的連接產物可直接使用或-20 ℃保存備用。
將連接后的啞鈴環狀DNA產物20 μL加入loading buffer染色后在15%的聚丙烯酰胺凝膠電泳(polyacrylamide gel electrophoresis,PAGE)表征(140 V,1 h),后用3×Gel Red染色液(45 mL蒸餾水,5 mL 1 mol/L的NaCl溶液,15 μL 10 000×Gel Red母液)室溫避光振蕩染色30 min。最終利用凝膠成像系統進行觀察分析。
1.3.5 RCA擴增及G-四鏈體熒光檢測的條件及優化
RCA擴增是借助2.0 DNA聚合酶強烈的鏈置換能力實現的,為達到快速檢測的目的,對啞鈴環狀DNA用量、RCA反應時間及溫度進行優化。啞鈴環狀DNA(0.5 μmol/L)的加入終濃度設置為50、100、150、200、250、300 nmol/L;反應時間設置為20、40、60、80、100 min;反應溫度梯度設置為56、59、62、65、68 ℃。因RCA擴增產物為冗長且包含富G序列的ssDNA,為判斷該產物是否在擴增結束后自身形成二級結構,對ThT誘導折疊G-四鏈體結構造成干擾,因此將RCA擴增產物與ThT混勻后95 ℃變性5 min后4 ℃孵育5 min處理與直接室溫孵育對比,并對ThT用量及孵育時間進行優化,將ThT(1 mmol/L)濃度梯度設置為5、10、20、30、40、50 nmol/L;孵育時間梯度設置為30、40、50、60、70 min。
最終確定反應條件為20 μL啞鈴環狀DNA,10 μL PCR純化產物,5 μL 10×2.0 DNA聚合酶緩沖液,4 μL 2.5 mmol/L dNTP Mix溶液,2.5 μL 100 mmol/L MgSO溶液,7.5 μL ddHO混合均勻后95 ℃變性5 min后4 ℃孵育5 min,加入1 μL 10×2.0 DNA聚合酶,59 ℃孵育1 h。在RCA擴增產物中加入1.5 μL ThT溶液,95 ℃變性5 min,4 ℃孵育5 min后室溫孵育1 h,最終將50 μL反應液轉移到狹縫比色皿中,用熒光分光光度計測定激發波長425 nm、發射波長486 nm下的熒光值,選擇最優條件用于后續實驗。
1.3.6 基于G-四鏈體的RCA反應可行性驗證
為了排除實驗結果的假陽性和驗證啞鈴環狀DNA的連接效果,以合成的15個T的靶標序列為模板進行RCA擴增G-四鏈體的可行性驗證。根據1.3.5節反應條件對2 μL合成靶標進行陽性對照,無靶標的陰性對照,無2.0 DNA聚合酶對照和無啞鈴環狀DNA模板對照。最終測量激發波長425 nm、發射波長450~550 nm的熒光信號,同時取5 μL擴增產物采用1%的瓊脂糖凝膠電泳驗證結果,判定RCA反應擴增G-四鏈體的信號放大策略的可行性。
1.3.7 基于G-四鏈體的PCR-RCA方法檢測沙門氏菌
1.3.7.1 方法特異性
對過夜培養的革蘭氏陰性菌(大腸埃希氏菌、志賀氏菌、銅綠假單胞菌、甲型副傷寒沙門氏菌、丙型副傷寒沙門氏菌和鼠傷寒沙門氏菌)和革蘭氏陽性菌(單核細胞性李斯特菌和金黃色葡萄球菌)的基因組DNA進行提取。根據實驗優化的最佳條件進行基于G-四鏈體的PCR-RCA方法檢測,測定486 nm下的熒光信號,驗證構建方法對沙門氏菌的特異性。
1.3.7.2 方法靈敏度
取過夜培養的沙門氏菌菌液1 mL進行基因組DNA提取,并將提取的核酸進行梯度稀釋,測其核酸含量,按照優化好的條件進行基于G-四鏈體的PCR-RCA方法檢測,測量發射波長為450~550 nm的熒光信號,并取486 nm的熒光值,判斷此方法的靈敏度。
1.3.7.3 方法檢出限(limit of detection,LOD)
取培養的沙門氏菌菌液,用0.85%的生理鹽水進行10 倍梯度稀釋,每個稀釋度取1 mL進行菌落計數。將上述各稀釋度菌液5 mL接種于45 mL滅菌牛奶中,均質后取1 mL提取基因組DNA,對基于G-四鏈體的PCR-RCA方法進行牛奶加標樣品中LOD分析。根據文獻[28]計算方法:LOD=3/(為空白樣品的標準偏差,為校準曲線的斜率),確定此方法的LOD。
1.4 數據處理
相關數據的處理及標準曲線的計算采用Microsoft Excel 2010軟件,圖表的繪制采用GraphPad Prism 8軟件,并采用Adobe Photoshop CS5軟件對圖片進行了組合排列。
2 結果與分析
2.1 PCR條件優化
引物與模板相互作用,在相同模板濃度下,PCR產物會隨著引物濃度的增加而增多,但引物濃度過大又會造成模板經指數擴增后的產物無區別,干擾后續的定量效果,因此進行引物濃度優化。圖1顯示,當引物濃度達3 μmol/L后,LOD為0.17 pg/μL,且不隨著引物濃度增加而變化,因此選用引物濃度3 μmol/L用于后續實驗。
因TR的5’端引入15個堿基A,導致上下游引物不等長,值相差較大,因此進行退火溫度優化。圖1E為退火溫度依次為54、56、58、60、62、64 ℃時的瓊脂糖凝膠電泳結果,當退火溫度為56 ℃時,產物較亮,且無非特異擴增,因此選取56 ℃用于后續實驗。
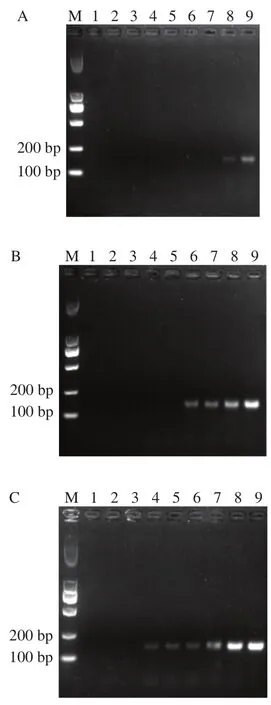

圖1 PCR條件的優化Fig. 1 Optimization of PCR conditions
2.2 發夾DNA的連接及優化
RCA反應的關鍵是構建一個完整的環狀模板,而本實驗根據G-四鏈體的反向互補序列及PCR擴增3’端的15個T堿基產物,設計出自身可折疊成半啞鈴結構的發夾DNA,且2個發夾DNA的黏性末端又可被T4 DNA連接酶連接成封閉的啞鈴環。圖2A~D分別是發夾DNA加入的終濃度1、0.5、0.25、0.1 μmol/L,T4 DNA連接酶添加量0.5、1、1.5、2、2.5 μL的連接產物。不難發現發夾探針濃度相對較低時,整個體系的連接效率變高,但也依然存在未連接的原始探針。因此為保障連接的啞鈴環狀DNA產物量的相對較多,又避免未連接探針的絕對浪費,選取探針終濃度為0.5 μmol/L,T4 DNA連接酶量為2 μL的連接產物用于后續實驗。


圖2 發夾DNA的連接優化Fig. 2 Optimization of hairpin DNA ligation
2.3 RCA擴增及G-四鏈體熒光檢測的條件及優化
2.3.1 RCA反應條件優化
RCA反應是擴增G-四鏈體從而實現信號放大的關鍵因素,對后續檢測的靈敏度起著重要作用,借助2.0 DNA聚合酶具有的5’→3’聚合酶活性和強鏈置換活性,可實現高效的等溫擴增。RCA反應時間及溫度均會對2.0 DNA聚合酶的效率造成干擾,從而影響RCA擴增的產物量,而啞鈴環狀DNA用量是決定擴增產物多少的關鍵因素,啞鈴環較多,會造成模板浪費,反之會影響實驗的靈敏度。
由圖3A可見,隨著啞鈴環狀DNA濃度從50 nmol/L增加到200 nmol/L,熒光強度逐漸加強到最大,而超過200 nmol/L時,可能因添加的濃度過大,導致非特異擴增增強,從而富G產物積累減少,熒光值降低。因此選擇啞鈴環狀DNA加入量為200 nmol/L用于后續實驗。由圖3B可見,隨著反應時間從20 min增加到60 min,熒光信號逐漸增強,當時間達到60 min后,熒光值幾乎不發生變化,推測此時已達到反應最大限度,因此選擇該時間用于后續實驗。由圖3C可見,隨著溫度在56~68 ℃的變化,熒光值呈現先升高后下降趨勢,推測隨著溫度的升高,逐漸接近酶的最適溫度,此時反應效率最大,但當溫度持續上升,使聚合酶在高溫下部分失活,又環外引物受值影響互補配對能力下降,故熒光信號降低,因此選擇59 ℃進行后續實驗。
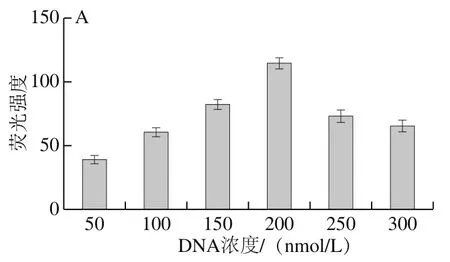
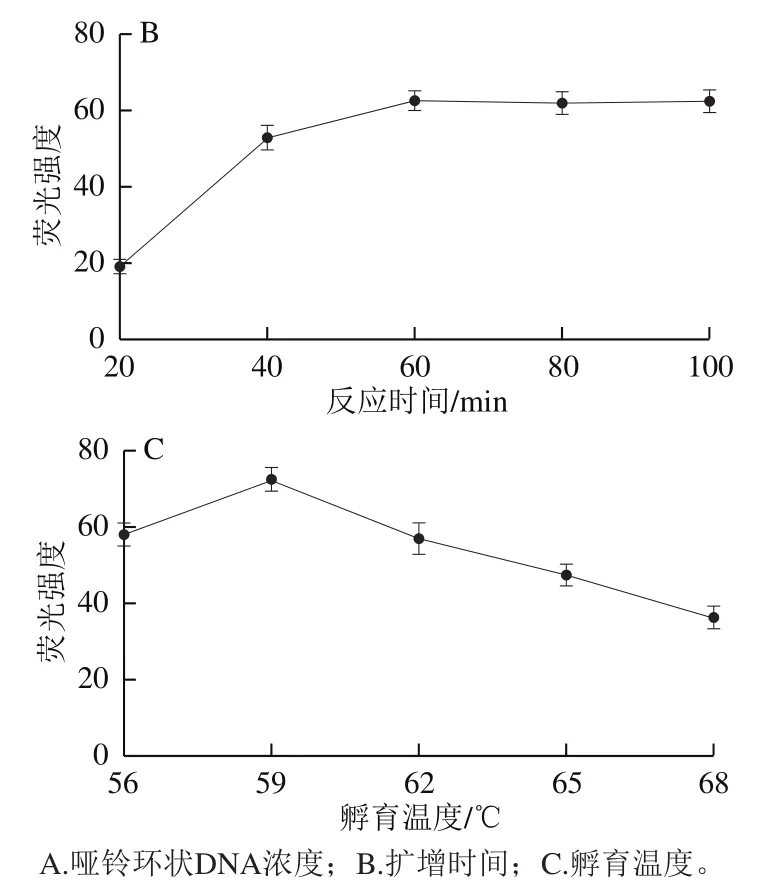
圖3 RCA反應條件優化Fig. 3 Optimization of RCA reaction conditions
2.3.2 G-四鏈體熒光檢測條件優化
ThT的旋轉結構致使自身熒光值低,但當其特異性識別G-四鏈體并嵌入其中時,會產生強烈的熒光信號,從而達到檢測的目的。因此G-四鏈體結構形成的多少,ThT的用量及二者相互作用的時間都會對實驗的靈敏度有較大影響。
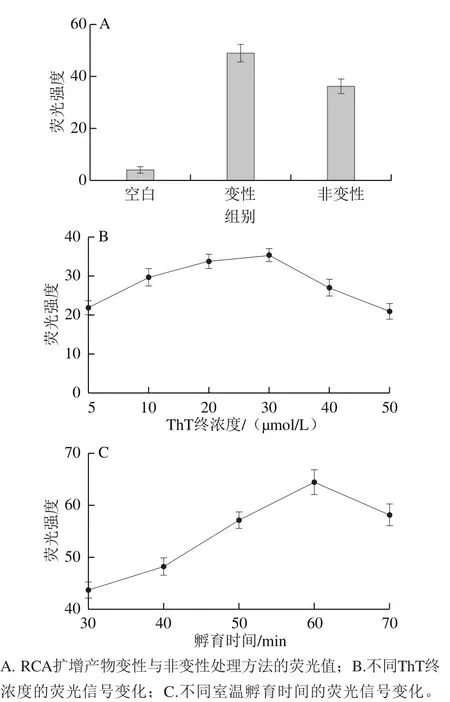
圖4G-四鏈體熒光檢測條件優化Fig. 4 Optimization of fluorescence detection conditions for G-quadruplex
圖4A為對RCA擴增的長鏈ssDNA產物進行95 ℃、5 min,4 ℃、5 min處理和直接室溫孵育的檢測結果,發現RCA產物與ThT經過熱變性處理,熒光信號得到明顯提升。推測是長鏈ssDNA自身折疊成二級結構,使富G序列被包裹,從而影響了ThT誘導G-四鏈體結構的功能。因此,選擇熱變性處理后再進行室溫孵育的方法進行后續實驗。圖4B為ThT終濃度由5~50 μmol/L的優化結果,當濃度從5~30 μmol/L時,熒光值逐漸增大且達到最大,但濃度超過30 μmol/L,熒光值呈現降低趨勢,推測是因溶解ThT粉末的溶液為50%的冰乙酸,自身pH值較低,在過酸的溶液中G-四鏈體結構形成受到影響所致。因此,選擇30 μmol/L的ThT添加量作為后續條件。圖4C為RCA產物與ThT室溫孵育時間優化結果,當二者作用60 min時,熒光信號達到最大值,且隨著時間的延長,熒光值基本不再有大幅度的變化,因此選擇60 min孵育時間作為后續條件。
2.4 基于G-四鏈體的RCA反應可行性驗證
通過通用引物對沙門氏菌的基因組DNA進行PCR擴增,得到3’端含有15個T的PCR產物,將其變性解旋后,再誘發RCA反應和ThT熒光檢測,因此15個T堿基能否引發RCA反應是實驗的關鍵。同時也針對RCA反應的發生條件,驗證實驗是否存在假陽性和啞鈴環狀DNA的連接效果,進行了如下對照。
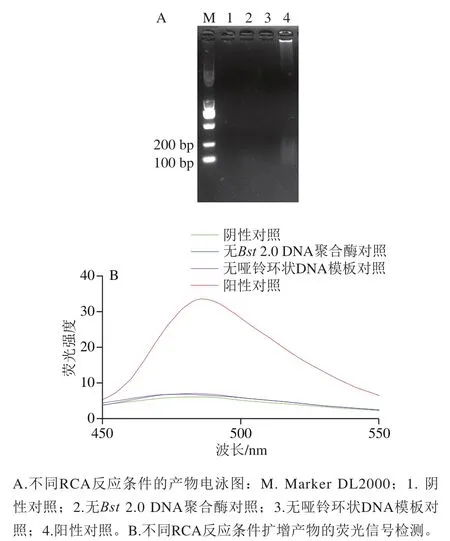
圖5 基于G-四鏈體的RCA反應可行性驗證Fig. 5 Feasibility verification of G-quadruplex based RCA reaction
對比瓊脂糖凝膠電泳圖(圖5A)與熒光信號(圖5B)可知,陰性對照、無2.0 DNA聚合酶對照和無啞鈴環狀DNA模板的對照反應體系,均不能誘發RCA反應,故也不能產生強烈的熒光信號,故本實驗構建的基于G-四鏈體的RCA技術檢測沙門氏菌的方法具有良好的可行性。
2.5 基于G-四鏈體的PCR-RCA方法檢測沙門氏菌的特異性
為評價方法的特異性,對1.1節中菌株進行基因組DNA提取,根據優化實驗得到的最佳反應條件進行基于G-四鏈體的PCR-RCA擴增及ThT誘導產物增強自身熒光強度的檢測。在保證其他菌株的DNA濃度大于沙門氏菌DNA濃度和其他反應條件相同情況下,驗證構建方法的特異性。由圖6可知,含目標DNA的反應體系產生了明顯的熒光信號,而其他非目標菌的熒光信號與空白對照相差無幾,證明基于G-四鏈體的PCR-RCA方法對沙門氏菌具有高度的特異性。

圖6 基于G-四鏈體的PCR-RCA檢測方法的特異性Fig. 6 Specificity of G-quadruplex-based PCR-RCA detection method
2.6 基于G-四鏈體的PCR-RCA方法檢測沙門氏菌的靈敏度
取1 mL過夜培養的沙門氏菌,提取基因組DNA后進行10 倍系列稀釋,得到1.7 fg/μL、17 fg/μL、0.17 pg/μL、1.7 pg/μL、17 pg/μL、0.17 ng/μL、1.7 ng/μL、17 ng/μL的靶標樣品,在優化的反應條件下進行基于G-四鏈體的PCR-RCA方法的檢測,以確定該方法的靈敏度。由圖7A可知,在17 fg/μL~1.7 ng/μL的基因組DNA模板下,隨著靶標質量濃度的逐漸增加,熒光信號也呈現逐漸增強的趨勢。且由圖7B可知,基因組DNA濃度對數與熒光信號呈現出良好的線性關系,線性回歸方程為=2.101+2.872 3(=0.992 5),靈敏度為17 fg/μL,說明構建的基于G-四鏈體的PCR-RCA檢測方法可以對沙門氏菌進行有效的鑒別和定量檢測。
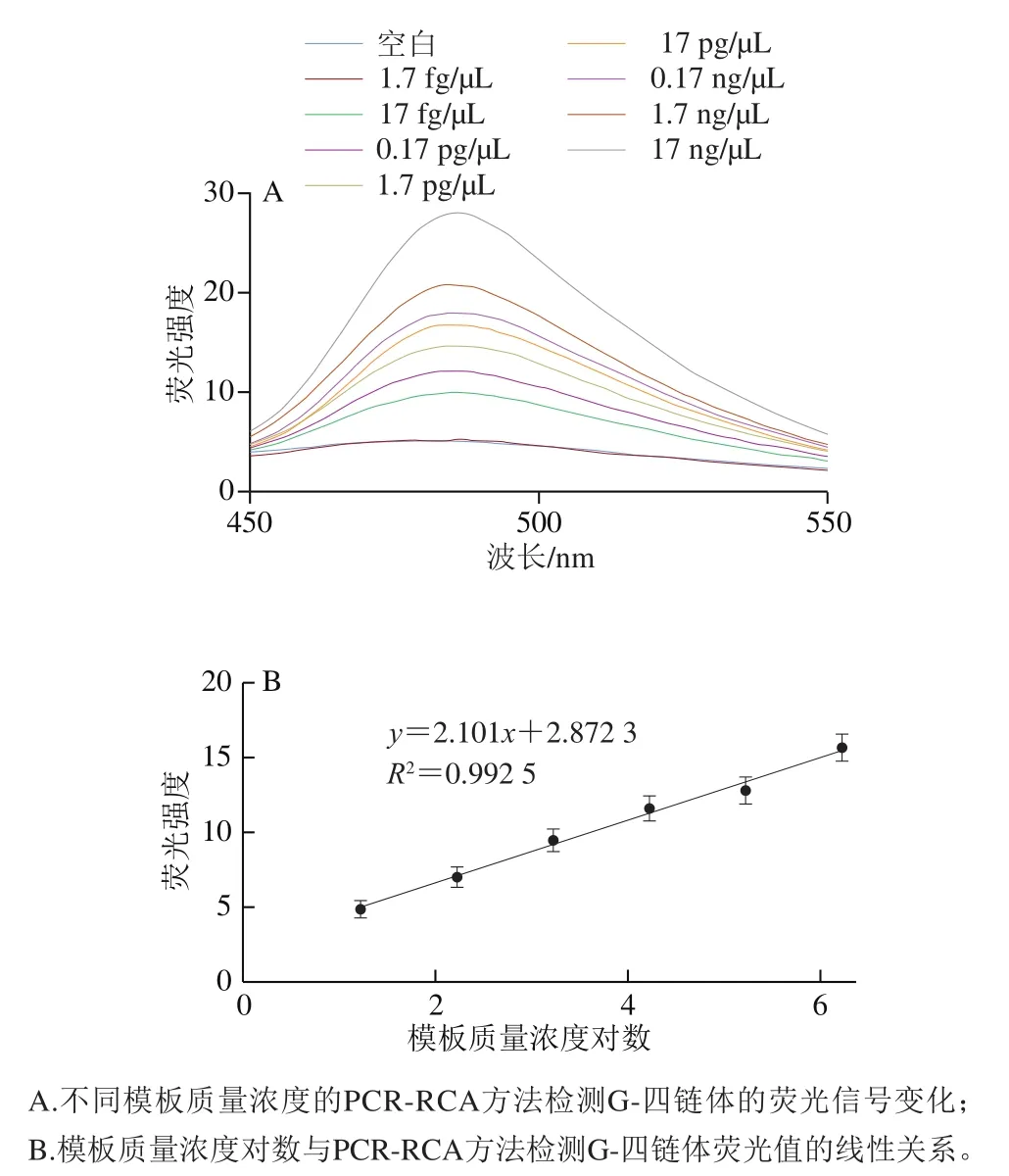
圖7 基于G-四鏈體的PCR-RCA檢測方法的靈敏度Fig. 7 Sensitivity of G-quadruplex-based PCR-RCA detection method
2.7 牛奶加標樣品中基于G-四鏈體的PCR-RCA方法的LOD
利用PCR-RCA方法擴增G-四鏈體熒光檢測沙門氏菌的最佳條件,對沙門氏菌標準菌株污染的牛奶進行檢測,其中人為污染濃度為10~10CFU/mL,通過觀察ThT誘導擴增產物并特異性結合G-四鏈體的熒光增強效果及對比加標樣品污染濃度,進行檢測靈敏度計算。由圖8A可知,熒光信號隨著樣品污染程度的增加而增加。且由圖8B可知,在10~10CFU/mL樣品污染濃度下,其對數與熒光值呈現出良好的梯度變化,計算檢測限為4.48 CFU/mL。因此本實驗構建的方法在沙門氏菌實際檢測中實用性良好,在一定范圍內可用于沙門氏菌的定量檢測。


圖8 基于G-四鏈體的PCR-RCA方法檢測人工污染沙門氏菌的牛奶樣品Fig. 8 Detection of Salmonella in artificially contaminated milk samples by the G-quadruplex-based PCR-RCA method
3 結論與討論
目前,G-四鏈體偶聯RCA的方法,已實現單核細胞性李斯特菌、克氏桿菌屬、microRNA等的檢測。但其研究或采用較為復雜的引發RCA擴增的手段,或設計更為復雜的環狀模板,增加了實驗的難度。本實驗建立的基于G-四鏈體的PCR-RCA雙重擴增檢測沙門氏菌的方法,特點與優勢在于:1)借助PCR擴增,使產物3’端生成的15個T堿基觸發后續實驗,既可確保引物與靶基因片段識別檢測的特異性,又可在核酸第1次擴增時積累大量“引物”,確保實驗的靈敏度。該方法實現了對低豐度目標序列的初步擴增,獲得與擴增產物等量的“15T”,為后續含“15A”的頸環結構提供RCA擴增引物,通過誘發RCA擴增間接完成對目標序列的檢測,也通過RCA擴增得到巨量G-四鏈體實現熒光信號的分析。因此,該方法對低豐度DNA樣品具有應用潛力。2)以“15A”堿基為“橋梁”,可擴展到對不同目標核酸序列的檢測中,即只需要根據目標序列設計5’端帶“15A”的引物,無需重新設計啞鈴環狀DNA模板,就可實現對不同目標序列的檢測,使方法具備通用性。3)設計帶有“AT”兩個堿基黏性末端的發夾結構,在T4 DNA連接酶的作用下可產生類似T-載體的連接效果,巧妙高效地連接成啞鈴環狀DNA模板。此方法有別于其它連接方式,不需要額外添加成環引物和核酸外切酶消化未連接的環,有效減少實驗假陽性。4)與熒光定量PCR檢測中的熒光染料法相比,本實驗方法可彌補由于嵌入核酸的熒光染料無法區分特異性產物與非特異產物造成的檢測結果誤差大的缺點;與探針法相比,可避免探針設計相對復雜、標記熒光淬滅基團成本高的弊端。最終利用ThT對核酸第2次擴增產物中的重復富G單元特異識別,將核酸信號輔助放大為熒光信號,借助熒光分光光度計即可實現檢測的精準定量效果,雖然步驟上略顯繁瑣,但是其應用范圍較熒光定量PCR更為廣泛。
G-四鏈體作為一種高穩定性、廣泛存在的功能核酸,以易于修飾和合成、檢測方式靈活的優異特征,已應用到多種核酸檢測技術中。但如何巧妙地將G-四鏈體與所檢核酸相偶聯,積累大量富G序列是其關鍵。因此進行如下改進:1)PCR擴增的引物濃度是后續生成誘發RCA反應的前提。通過PCR擴增所得的RCA引物濃度高時,雖然靈敏度得到顯著提高,但易掩蓋RCA引物間的濃度差,直接影響RCA富G產物檢測的梯度。因此,本實驗優化選擇3 μmol/L的PCR引物,剛好能獲得最佳RCA擴增梯度。2)與擴增靶標得到5’-磷酸化產物并經過核酸外切酶消化和不對稱拖尾PCR (AT-PCR)獲得ssDNA產物觸發后續RCA反應的方法相比,本實驗通過直接對PCR純化產物進行熱變性處理,使解鏈的3’端15個T堿基與啞鈴環狀DNA模板相互識別配對,通過鏈替換擴增積累大量RCA產物,使整個實驗操作變得便捷。3)RCA擴增產物為冗長的ssDNA,其自身二級結構會包裹大量重復的富G序列而影響G-四鏈體結構的形成,因此在進行ThT熒光信號放大檢測前,將RCA產物進行熱變性及冷卻孵育處理,使富G堿基裸露,即可顯著提升檢測靈敏度。
綜上,通過一系列的實驗設計與優化,建立了PCRRCA雙重核酸擴增與G-四鏈體核酸輔助檢測信號放大聯合檢測沙門氏菌的新方法,該方法有效性強、穩定性好、靈敏度高,借助熒光分光光度計對所檢樣品的熒光值進行分析,即實現一定范圍內的定量檢測。可廣泛用于其他食源性致病菌的檢測,通用性強,只需改變PCR擴增的引物,即可達到對靶物質的測定。但相比其他信號放大技術,G-四鏈體/ThT的熒光信號強度易受到緩沖體系中一價陽離子濃度的影響,因此在檢測復雜樣品和低濃度樣品時存在一定的局限性。

