浮性與沉性生物絮團氨氮處理能力與營養組成的比較研究
譚竟宏,陸泳因,羅國芝,2,3,譚洪新,2,3,劉文暢,2,3
(1上海海洋大學上海水產養殖工程技術研究中心,上海 201306;2 上海海洋大學上海市水產動物良種創制與綠色養殖協同創新中心,上海 201306;3 上海海洋大學水產科學國家級實驗教學示范中心,上海 201306)
生物絮團技術是通過向養殖水體中添加碳源或提高飼料中的碳含量促進硝化細菌等微生物生長和對氮的吸收,將水體中浮游植物、細菌、顆粒有機物等絮凝成養殖對象可攝食的生物絮團,從而起到凈化水質的作用[1-2]。然而生物絮團的積累會導致養殖池底的總懸浮固體(TSS)含量增加,這會對養殖對象的攝食情況,甚至生長發育等產生負面影響[3-6]。
傳統絮團生物量的調控,通常通過添加沉降單元[7]或者絮團脫水技術[8]排除掉密度體積較大的絮團來達到減少系統TSS質量濃度的目的。絮團沉淀過程中,生物絮團會逐漸分為兩部分,即浮性絮團與沉性絮團。浮性絮團是因為水體低溶氧水平、營養缺乏或其他刺激絮團生長的條件導致絲狀微生物的快速增殖或發生絮團的反絮凝作用形成[9-12]。沉性絮團則是由細菌胞外聚合物(Extracellular Polymeric Substances,EPS)粘連微生物逐漸形成的密度較大的細菌團[13-14]。有研究表明通過沉淀調節絮團TSS質量濃度不會影響系統水質控制能力[15],但同樣大小的絮團也會有不同的沉降速度[16]。目前的研究結果并不能證明沉性絮團或者浮性絮團各自的水質控制能力且沒考慮沉淀的時間成本。
本研究以5 min為沉淀時間,比較了浮性絮團和沉性絮團的總氨氮處理能力和營養組成,旨在為養殖中生物絮團量的調控提供參考。
1 材料與方法
1.1 設備以及材料
生物絮團用魚用膨化配合飼料(通威股份公司)培養絮團,所用飼料含28%粗蛋白、12%粗纖維、5%粗脂肪、15%粗灰分、0.6%總磷以及12.5%水分。18個10 L聚乙烯透明桶為容器。用透明硅膠軟管(內徑5mm,外徑7 mm)作為曝氣管,采用大馬蹄曝氣石曝氣。馬弗爐(SR-JX3-9箱式電爐)用于灼燒絮團。兩臺羅茨鼓風機(功率750W,森森集團股份有限公司)。元素分析儀ELMENTAR VARIO MAX用于分析生物絮團的碳氮元素。坩堝用于絮團進行灼燒。葡萄糖(C6H12O6)為碳源。碳酸氫鈉(NaHCO3)調節堿度。多參數水質測量儀(WTW,Multi 3430,德國)用于水質指標檢測。紫外分光光度計(型號UV2000,上海尤尼柯,中國)用于水質檢測。
1.2 試驗設計
取18個10 L聚乙烯透明水桶,有效體積為7 L,將18個桶編為6組,分別為A組、B組、C組、D組、E組、F組,每組3個平行,組內編號為1、2、3。試驗用上海海洋大學養殖技術與工程實驗室已經培養好的生物絮團,將生物絮團沉淀5 min,取上清液42 L,平均倒入C組、F組,每組體積為7 L,每桶TSS≈150 mg/L。將原生物絮團重新混勻沉淀5 min后,取沉淀,使用曝氣3 d以上的自來水將其稀釋,使其TSS≈150 mg/L,平均倒入A組、D組,每組體積為7 L。將原生物絮團重新混勻后,直接取用生物絮團,加入曝氣3 d以上的自來水將其稀釋,使其TSS≈150 mg/L,再將混勻后的生物絮團平均倒入B組、E組,每組體積為7 L。

表1 各個試驗組設置條件Tab.1 Set conditions for each experimental groups
上述各組初始堿度維持在300.00 mg/L左右,兩臺羅茨鼓風機(功率750 W)為上述18個桶進行曝氣,溶氧保持最初取樣時一致。對A、B、C、D、E、F組絮團進行總氨氮快速轉化試驗,即A、B、C三組分別以初始質量濃度為10 mg/L氯化銨作為氮源,以DOC/TN(溶解性有機碳/總氮)=15加入葡萄糖作為碳源;D、E、F三組分別以初始質量濃度為10 mg/L氯化銨作為氮源。當每組的亞硝酸鹽氮含量下降至約為0 mg/L時,則試驗結束。
2 試驗指標與檢測方法
2.1 水質指標測定
2.2 絮團指標測定
TSS采用稱重法進行測定[18];絮團粗蛋白和碳氮比(C/N)使用元素分析儀ELMENTAR VARIO MAX檢測氮元素含量,再換算成蛋白質平均系數6.25[19]。粗灰分測定采用GB/T 6438—2007[20]的方法;粗脂肪采用氯仿-甲醇法[21],脂肪酸測定采用甲酯化法[22],水解氨基酸采用GB/T 5009.124—2003[23]前處理,上機測定(日立,L-8800,氨基酸分析儀)。
2.3 氨氮去除效率和總氨氮去除速率計算公式

R=100%×(C1-C2)/C1
(1)
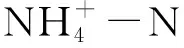

S=(C1-C2)/(T×t)
(2)
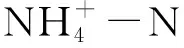
2.4數據分析
試驗數據采用Excel軟件進行結果統計,用Origin、Adobe Illustrator軟件進行相關圖表的繪制。試驗數值用平均值±標準差(Mean±SD)形式表示,采用SPSS 22.0統計軟件對數據進ANOVA單因素方差分析,P<0.05為差異性顯著。
3 結果
3.1 生物絮團組分指標
試驗結束時,如表2所示加碳源組浮性絮團粗蛋白含量最高為(30.66±0.01)%,不加碳源組沉性絮團粗灰分含量最高為(45.99±1.51)%,加碳源組混合絮團粗脂肪含量最高為(4.46±0.22)%;加碳源組粗蛋白含量高于不加碳源組且粗灰分含量低于不加碳源組,而C/N低于不加碳源組。脂肪酸測定結果如表3所示,兩種條件下浮性絮團EPA含量最高。

表2 試驗結束時各組生物絮團營養指標含量Tab.2 The contents of bioflocs nutrient composition at the end of experiment
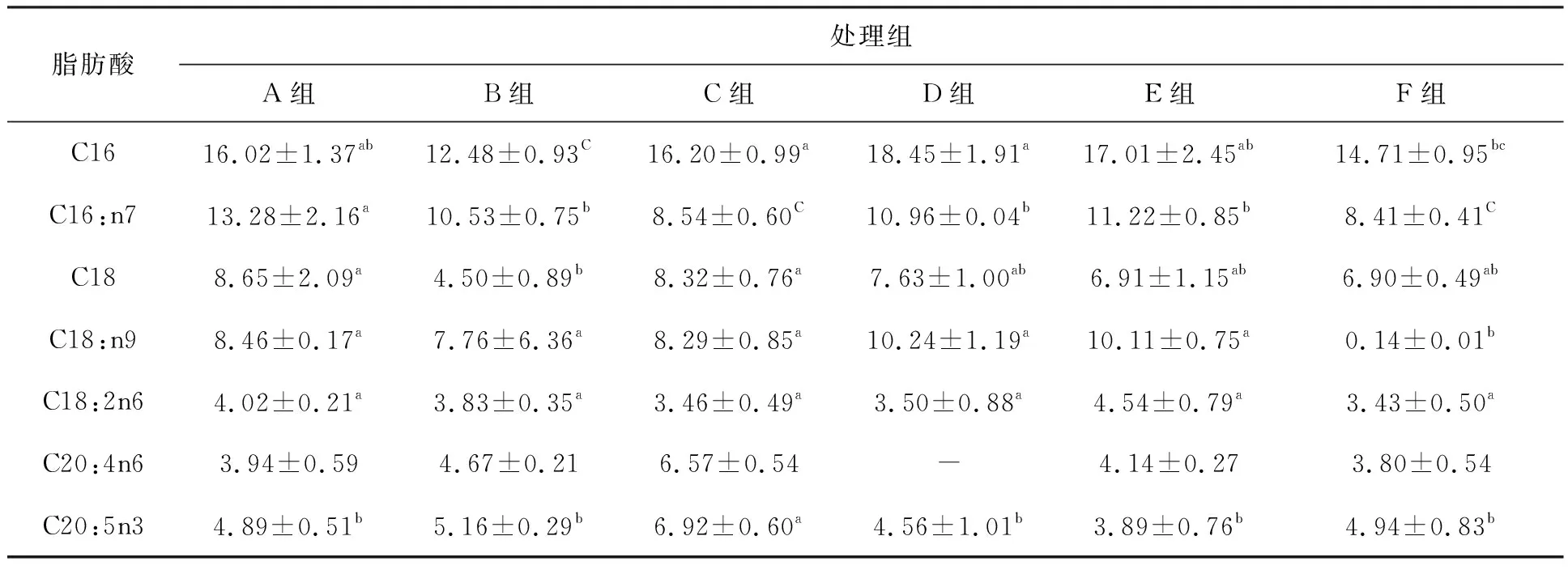
表3 試驗結束時各組生物絮團的脂肪酸含量Tab.3 The contents of bioflocs fatty acids at the end of experiment
3.2 生物絮團的水解氨基酸含量
如表4所示,加碳源組A、B、C中,甘氨酸、半胱氨酸、蛋氨酸、組氨酸、天冬氨酸組內差異顯著(P<0.05),不加碳源組中天冬氨酸、蘇氨酸、絲氨酸、蛋氨酸、脯氨酸組內差異均顯著(P<0.05)。加碳源組中,浮性絮團氨基酸含量是除了甘氨酸以外為組內最高;不加碳源組中,浮性絮團氨基酸含量是除了蛋氨酸以外為組內最低。加碳源所有組中氨基酸含量高于不加碳源組。
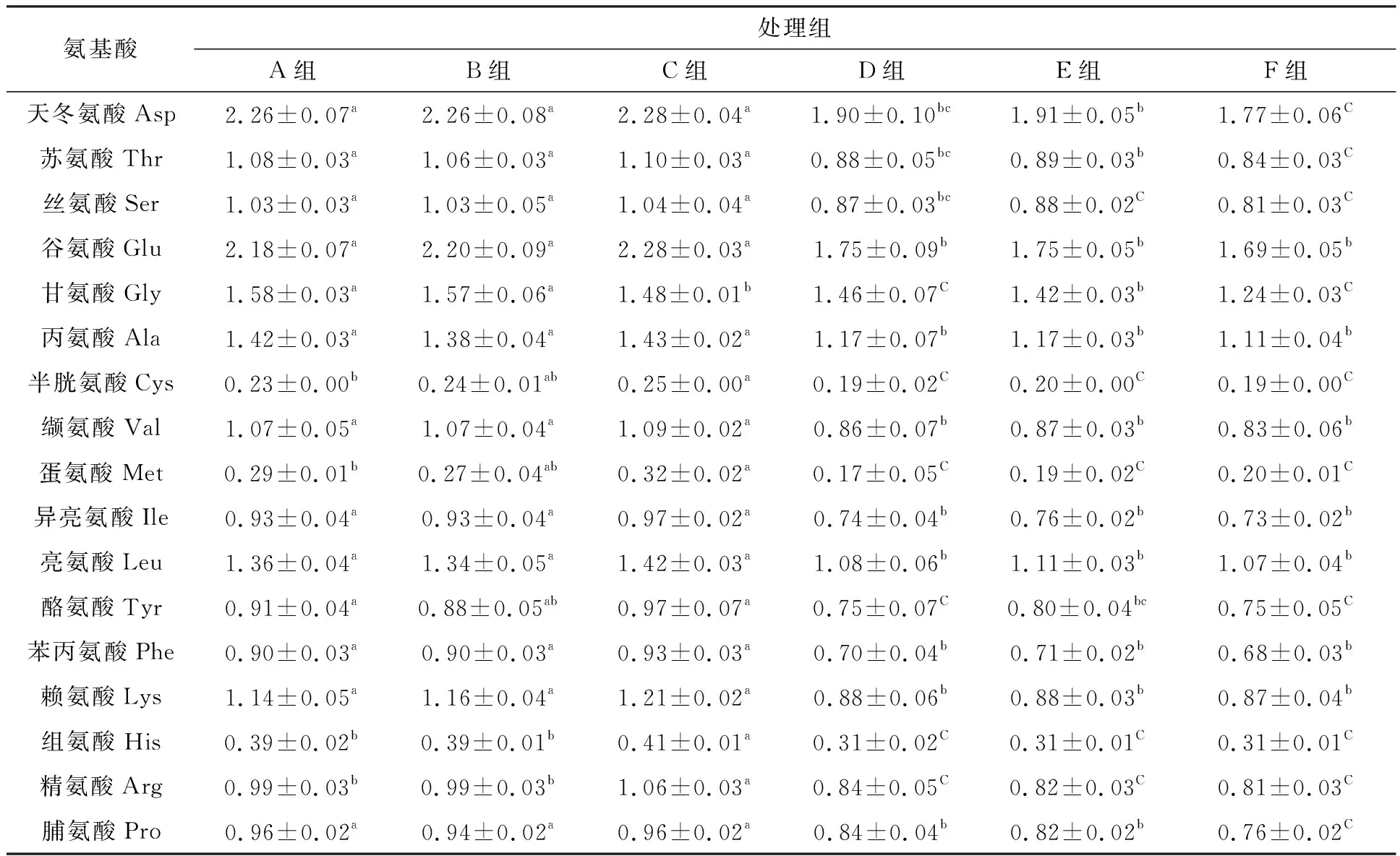
表4 試驗結束時17種氨基酸含量Tab.4 The contents of 17 kinds of amino acids at the end of experiment
3.3 試驗期間的水質變化
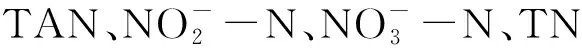
表5 試驗運行期間各組主要水質指標的平均值以及標準差Tab.5 The average and standard deviation of each primary water quality index in all treatment groups during the experiment
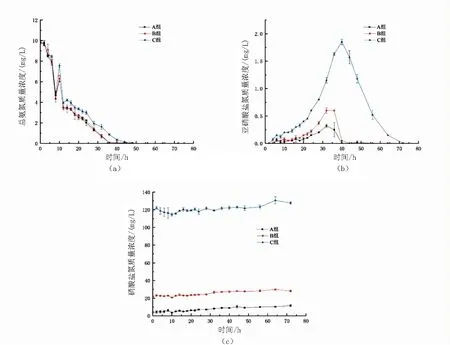
圖1 10mg/L總氨氮快速轉化試驗加碳源組中A組、B組、C組的三態氮變化圖Fig.1 Dynamics of total ammonium-N(a),nitrite-N(b)and nitrate-N(c) in A,B and C duringthe adding carbon source experimental period
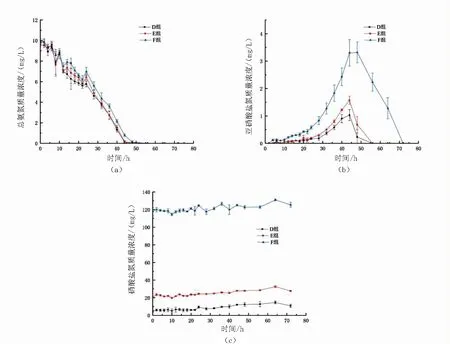
圖3 10mg/L總氨氮快速轉化試驗不加碳源組中D組、E組、F組的三態氮變化圖Fig.3 Dynamics of total ammonium-N(a),nitrite-N(b)and nitrate-N(c) in D,E andF during the no adding carbon source experimental period
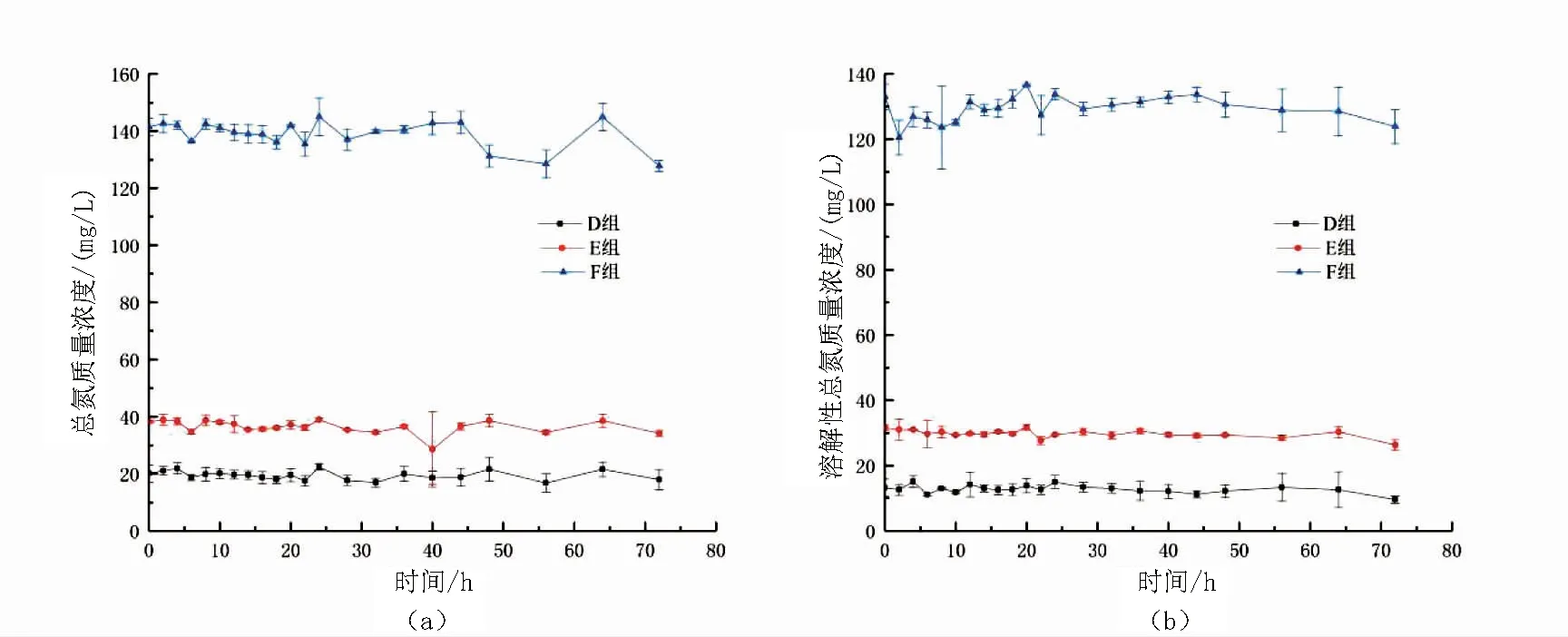
圖4 10mg/L總氨氮快速轉化試驗不加碳源組中D組、E組、F組的總氮與溶解性總氮變化圖Fig.4 Dynamics of TN(a) and DTN(b) in D,E and F during the no adding carbon source experimental period
3.4 試驗前后TSS含量變化
如圖5和圖6所示,試驗結束時,兩種條件下TSS質量濃度都上升且加碳源組增加量高于不加碳源組。加碳源組中,A組和B組前后TSS質量濃度差異顯著(P<0.05),C組前后TSS質量濃度差異不顯著(P>0.05);不加碳源組D組和F組前后TSS質量濃度差異顯著(P<0.05),B組TSS質量濃度前后差異不顯著(P>0.05)。
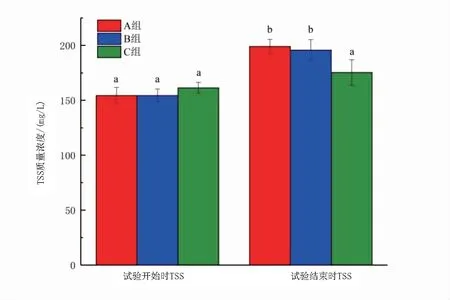
圖5 加碳源組試驗開始時、結束時各組TSS變化Fig 5 Dynamics of total suspended solids from beginning to end of the adding carbon source experiment
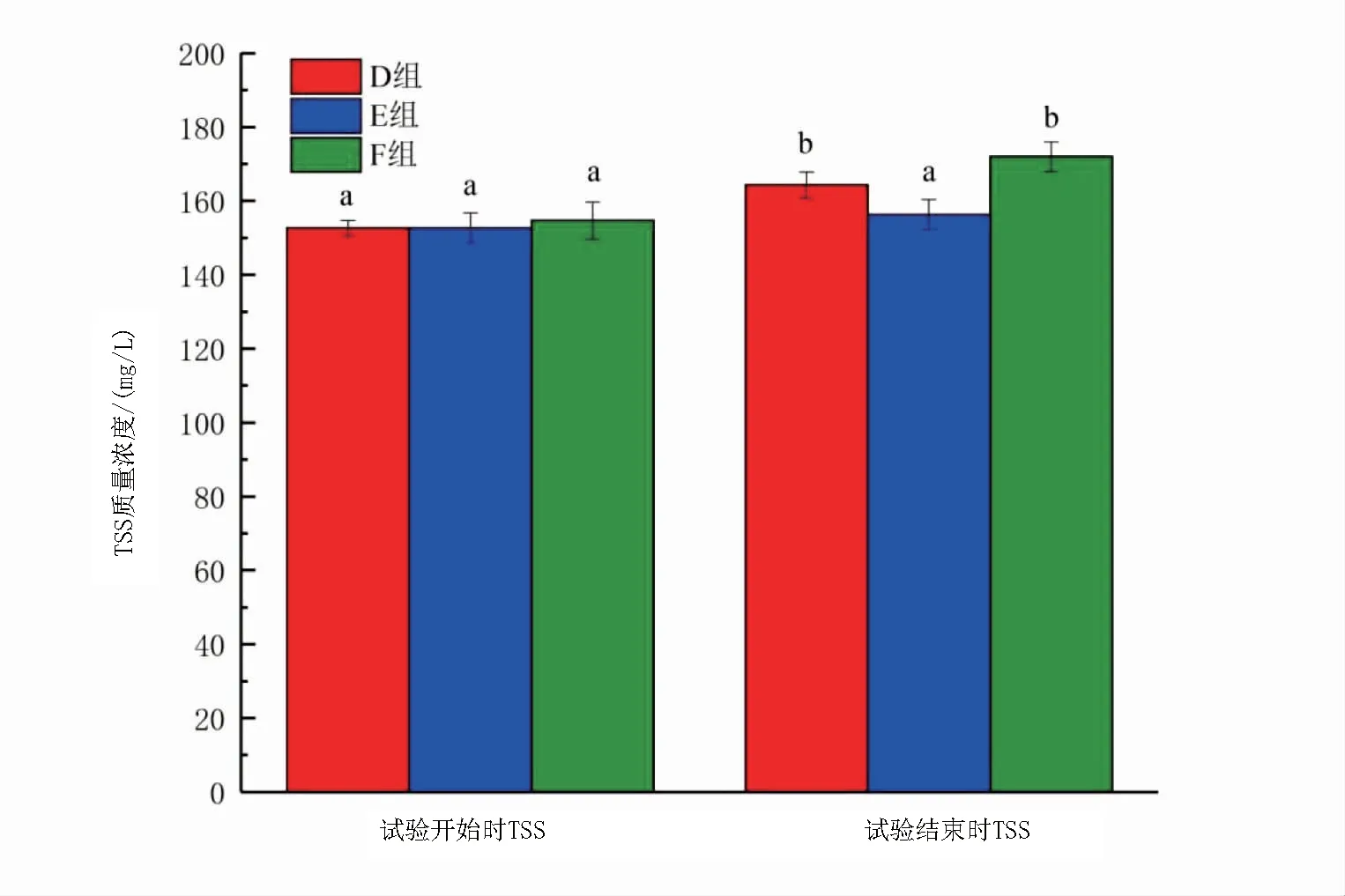
圖6 不加碳源組試驗開始時、結束時各組TSS的變化Fig 6 Dynamics of total suspended solids from beginning to end of the no adding carbon source experiment
4 討論
4.1 沉性與浮性生物絮團對生物絮團系統營養成分比較
本試驗加碳源組中粗蛋白含量顯著高于不加碳源組粗蛋白含量,有研究表明[24-27]添加碳源有利異養微生物的生長以及提高生物絮團系統中的生物多樣性,而異養細菌生長速率為自養細菌的10倍,提供了更多的菌體蛋白。所以加碳源組粗蛋白含量高于不加碳源組,與研究結論相符。本研究中加碳源組與不加碳源組中浮性絮團粗蛋白含量最高,可能與生物絮團中的胞外聚合物(Extracellular Polymeric Substances,EPS)的含量有關。有研究表明[28-33]EPS中蛋白質是其主要成分,污泥的絮凝能力隨著總EPS含量的增加而降低,與本研究結果相符。試驗前后粗灰分占比高達40%左右,吳盛凱等[34]用生物絮團養殖羅非魚,研究結果表明隨著養殖進程的推進,生物絮團的粗灰分占比不斷增加,最后占比為30%左右。本研究使用的生物絮團來自上海海洋大學循環水養殖技術與工程實驗室,生物絮團硝化系統建立到本試驗使用距離有半年,其間一直添加碳源氮源保證其硝化進程的運行,本試驗粗灰分含量在40%左右,可能是原絮團培養周期長,導致粗灰分占比的增加。
試驗前后粗脂肪的含量變化不大,在4%左右。Kuhn等[35]通過養殖試驗表明生物絮凝物之間可能存在不確定的營養不一致。這一結果與Ekasari等[36]的研究結果一致,其研究表明即使粒徑較小的絮團,粗脂肪含量也高于粒徑較大的絮團。也有一些研究表明生物絮團的微生物群落的結構不同,取樣時間的不同,都會引起營養指標的差異[37-40]。B組、C組與E組、F組C16差異顯著(P<0.05),A組與D組僅在C16:n7差異顯著(P<0.05),除了E組,其余5組多不飽和脂肪酸含量都增加,且加碳源組比不加碳源組含量高,與Elrazak等[41]和Qi等[42]研究不相同,葡萄糖可能是影響細菌生長和EPA生產率的最重要因素,添加葡萄糖會導致EPA含量下降。但也有研究表明脂肪酸含量與生物量以及種群豐度有關[37]。本研究中加碳源組EPA含量高于不加碳源組含量,可能是生物量以及豐度高于不加碳源組。兩種條件下,浮性絮團的EPA含量高于組內其余兩組,可能是浮性絮團有更高的亞硝酸鹽積累,有研究表明pH、溫度或外界壓力等其他因素會引起細胞膜的變化且細胞膜流動性越強,EPA含量越高[41,43-47]。本研究中更高的亞硝酸鹽積累可能導致浮性絮團中細菌的細胞膜流動性增強,所以兩種條件下浮性絮團EPA含量為同組內最高。
本試驗加碳源組中,氨基酸含量高于不加碳源組,與金毅等[48]、Schneider等[49]研究結果一致,即生物絮團中更高的碳源輸入以及更高的生物量,有利于營養物質的增加。加碳源組中浮性絮團氨基酸含量除了甘氨酸以外高于其余兩組,與張揚等[50]和Rontani等[51]研究相似,即浮性顆粒可能含有更多的氨基酸等營養物質。不加碳源組中,浮性絮團氨基酸含量除了蛋氨酸以外低于其余兩組,可能是因為水體擁有更高的亞硝酸鹽氮負荷,在不加碳源的條件下,生物絮團進行硝化作用消耗了更多的自身營養物質,與李莉等[52]研究結果相似。
4.2 沉性絮團與浮性絮團對生物絮團系統氮素轉化比較

浮性絮團的增多還有一種可能性是生物絮團發生反絮凝,導致絮團密度體積粒徑變小,沉浮性變差,浮性絮團增加[9-12]。葉繼良等[57]以轉速作為變量,通過水體剪切力切割生物絮團,發現高轉速組的絮團緊實密度高,低轉速組的絮團松散密度低,但通過氨氮快速轉化試驗發現二者對氨氮有良好的去除速率且各組之間差異不顯著。Souza等[58]發現生物膜的大小以及總懸浮固體的數量不會影響BFT系統中的硝化過程,但會造成硝化活性延遲或降低。所以本試驗浮性絮團的產生原因可能不是發生了反絮凝。
5 結論
浮性絮團與沉性絮團粗蛋白差異不顯著,加碳源組粗蛋白含量高于不加碳源組;沉性絮團比浮性絮團擁有更高的粗灰分含量,不加碳源組粗灰分含量整體高于加碳源組;加碳源后混合絮團粗脂肪含量更高,不加碳源組中沉性絮團粗脂肪含量更高;加碳源組與不加碳源組中,浮性絮團具有更高的EPA含量;加碳源組中浮性絮團氨基酸含量除甘氨酸以外高于沉性絮團,不加碳源組中,浮性絮團氨基酸含量除了蛋氨酸以外低于沉性絮團;浮性絮團比沉性絮團具有更高的亞硝酸鹽峰值,不加碳源組氨氮去除效率高于加碳源組。應進一步探究沉性絮團與浮性絮團在實際生產中對養殖對象產生的影響,為生物絮團量的調控提供更優解的方案。
□

