銀鯧脾臟和腎臟組織細胞體外培養研究
王 燕, 舒鳳玲, 陳東月, 王亞軍, 解家松, 周素明
銀鯧脾臟和腎臟組織細胞體外培養研究
王 燕, 舒鳳玲, 陳東月, 王亞軍, 解家松, 周素明*
(寧波大學 海洋學院, 浙江 寧波 315832)
為探究銀鯧脾臟和腎臟組織細胞體外培養條件, 本研究采用組織塊培養法對銀鯧脾臟和腎臟組織進行原代培養. 實驗選用DMEM/F-12、M199和DMEM等作為基礎培養基, 在其中分別添加體積分數為10%、15%、20%的胎牛血清, 并添加青鏈霉素及慶大霉素以防細菌污染. 結果表明: 銀鯧脾臟和腎臟組織在胎牛血清體積分數為20%的DMEM/F-12培養基中貼壁最好, 遷出細胞的種類最多, 細胞生長速度最快. 其中脾臟組織共遷出6種不同的細胞, 分別為: 免疫細胞、基質細胞、上皮樣細胞、成纖維樣細胞、造血灶和未知細胞; 腎臟組織共遷出3種細胞, 分別為: 上皮樣細胞、巨噬細胞和成纖維樣細胞.
銀鯧; 脾臟; 腎臟; 細胞培養
銀鯧()屬鱸形目(Perciformes)、鯧科(Stromateidae)、鯧屬(), 是我國沿海重要的經濟魚類之一, 主要分布于東海、南海、黃海、渤海等地區. 由于銀鯧刺少、肉質細膩鮮美, 深受消費者的喜愛, 其市場需求量不斷增大. 隨著野生銀鯧資源逐年減少, 以及我國禁漁期制度的執行, 捕撈銀鯧已經無法滿足市場的需求[1-2]. 因此, 銀鯧的人工養殖及苗種繁育受到有關研究者的極大關注, 許多研究團隊已開展銀鯧人工繁殖的相關研究. 近些年, 銀鯧的繁育及全人工養殖技術在寧波地區取得了重大突破[3-6], 但由于馴化時間短、養殖環境與野生環境存在較大差異等原因, 導致人工養殖的銀鯧對環境中的病原微生物易感, 養殖過程中銀鯧疾病頻繁發生, 已成為銀鯧養殖業亟待解決的問題[1].
細胞培養是細胞生物學研究方法的重要手段之一, 是推動生命科學領域發展的重要技術. 水產動物的細胞培養始于20世紀60年代, 最早被用于水產動物病毒的分離與純化, 該技術對水產動物的疾病防治有著重大貢獻[7-8]. Wolf和Quimby于1962年建立了世界上第一株魚類細胞系–—虹鱒生殖腺細胞系(Rainbow Trout Gonadal Cell, RTG-2)[9]. 目前, 已建立的魚類細胞系至少550株以上, 其材料主要源自魚類的鰭、肌肉、表皮、腎臟、脾臟等不同組織. 隨著魚類細胞培養技術研究的深入, 其應用范圍也從最初的病毒分離純化擴展到魚類的生理學、免疫學和病害防治等方面[10-11]. 脾臟和腎臟是魚類重要的免疫造血器官, 在抵抗外來抗原的免疫調節過程中起到重要作用[12]. 目前已經有多種魚類, 如草魚()、花鱸()、赤點石斑魚()、斑點叉尾()、松江鱸()、大黃魚()、羅非魚()等建立了脾臟及腎臟組織來源的細胞系[13-19]. 上述細胞系的建立為魚類免疫及病毒性疾病的致病機理等基礎研究提供了培養簡單、遺傳穩定的細胞模型和材料.
隨著銀鯧人工繁育及養殖技術的突破, 養殖銀鯧的商業化道路已成為必然. 但目前對銀鯧生理、遺傳、營養及疾病等基礎研究仍較為匱缺.
本文以銀鯧脾臟、腎臟組織為研究材料, 通過組織塊培養方法, 探索其離體培養條件, 旨在為銀鯧脾臟、腎臟組織來源細胞系的建立及后續生理學、免疫學和病害防治等研究提供參考.
1 材料和方法
1.1 實驗材料
實驗銀鯧購自寧波市象山港灣水產苗種有限公司, 體長(8±2)cm, 體質量(5.0±2.5)g.
主要試劑: DMEM(HyClone)、M199(HyClone)、DMEM/F-12(HyClone); 0.25%胰酶(含EDTA)、雙抗(青霉素100IU·mL-1、鏈霉素100μg·mL-1);胎牛血清(FBS); 100mg慶大霉素; 25mg可溶性兩性霉素B, 以上試劑均購自寧波鎮海百川生物科技有限公司.
1.2 方法
1.2.1 培養基的配制
在3種培養液(DMEM/F-12、M199、DMEM)中分別添加10%、15%、20%胎牛血清, 50mg·mL-1慶大霉素、可溶性兩性霉素B(3mg·mL-1)、100IU·mL-1青鏈霉素混合液配制成完全培養基.
1.2.2 組織分離及處理
將銀鯧置于已消毒的托盤中, 用75%乙醇對銀鯧進行體表消毒, 然后斷尾放血, 移至超凈臺中, 用彎頭鑷子將銀鯧的脾臟和腎臟取出, 置于裝有2mL含抗生素(終質量濃度為100IU·mL-1的青鏈霉素混合液和100mg·mL-1慶大霉素、3mg·mL-1可溶性兩性霉素B)的PBS的EP管中漂洗3次, 每次5min, 棄漂洗液; 然后分別加入1mL DMEM、M199、DMEM/F-12(添加終質量濃度為100IU·mL-1的青鏈霉素混合液和100mg·mL-1慶大霉素、3mg·mL-1可溶性兩性霉素B)3種培養基進行消毒30min; 最后用剪刀將組織碎剪成1mm3組織塊, 用上述3種培養基清洗2次, 每次5min.
1.2.3 腎臟和脾臟組織的原代培養
將經處理的組織細胞液(DMEM、M199、DMEM/F-12分別添加0.5%胎牛血清、終質量濃度100IU·mL-1的青鏈霉素混合液和100mg·mL-1慶大霉素)重懸后均勻接種于25cm2培養瓶中, 貼壁4h后分別添加3mL DMEM、M199、DMEM/F-12培養基(添加20%胎牛血清、終質量濃度100IU·mL-1的青鏈霉素混合液和100mg·mL-1慶大霉素), 并正置于26℃細胞培養箱中恒溫培養. 隨后在倒置顯微鏡下觀察并記錄. 根據細胞的遷出及生長狀況, 每2~3d更換一半培養基.
2 結果
2.1 培養基對銀鯧脾臟、腎臟組織細胞原代培養的影響
銀鯧脾臟和腎臟組織細胞原代培養的實驗結果見表1. 從表1可知, 在添加20%胎牛血清的3種基礎培養基中, 銀鯧脾臟和腎臟的組織塊邊緣都有細胞遷出, 其中DMEM和M199兩種培養基中組織細胞遷出數量少、鋪瓶率較低. 在隨后培養過程中, 2種組織的組織塊不會脫落, 但無細胞遷出; 而DMEM/F-12基礎培養基中脾臟和腎臟組織塊遷出細胞數量較多、鋪瓶率高, 而且細胞的生長效果最好.

表1 銀鯧脾臟、腎臟細胞原代培養基篩選
2.2 脾臟組織塊遷出細胞形態和造血灶的產生
脾臟組織塊接種貼壁5d后, 在添加20%FBS的DMEM/F-12培養基中大量細胞從組織塊邊緣遷出, 并且呈放射狀排列在組織塊周圍, 按其形態和遷出順序可以分為6種細胞(圖1).
(1)A型細胞: 組織塊接種貼壁后, 一些貼壁的植塊在啟動培養的第3天, 最先遷出少量全體通透的圓形(直徑約10μm)或橢圓形細胞(圖1(a)). 細胞個體多數較小, 細胞核清晰, 可以貼壁, 但貼壁不牢固. 培養第5天觀察到部分細胞呈現橢圓形并伴有偽足生長, 遷出一些呈現馬蹄形和三角形的細胞. (2)B型細胞: DMEM/F-12培養基中培養到第8 天, 觀察到B型細胞從一些組織塊邊緣遷出(圖1(b)). 這些細胞排列不均勻, 細胞質內存在大量黑色顆粒物質, 在細胞培養瓶底部以多層交叉網狀結構存在, 細胞層質密、細胞貼壁牢固, 當細胞合成大片細胞層時在貼壁牢固的細胞層上出現一些零散的圓形細胞. (3)C型細胞: 在啟動培養到第12天觀察到C型細胞, 該細胞貼壁較牢固, 細胞形態為多角形、扁平狀, 細胞排列緊密, 胞體內存在大量顆粒狀物質, 細胞核不易辨清(圖1(c)). (4)D型細胞: D型細胞與C型細胞同時出現, 是培養過程中一些組織塊集中遷出的細胞(圖1(d)). D細胞(長徑50~120μm, 短徑5~10μm)胞體多呈梭形、多角形和扁平星形等, 具有突起, 細胞顏色暗沉, 細胞核明顯, 呈卵圓形, 一些細胞核中有2個核仁, 胞內含有許多小顆粒, 細胞呈交叉生長, 細胞貼壁極牢固. (5)E型細胞: 細胞大小不一、貼壁不牢, 最初依附于基質細胞生長, 表層出現一些全體通亮的圓形細胞, 單個零星分布, 慢慢聚集成簇, 成團塊的細胞仍維持圓形, 逐漸變成小山樣(圖1(e)). (6)F型細胞: 細胞形態多樣, 有不規則的三角形、梭形和圓形(圖1(f)).
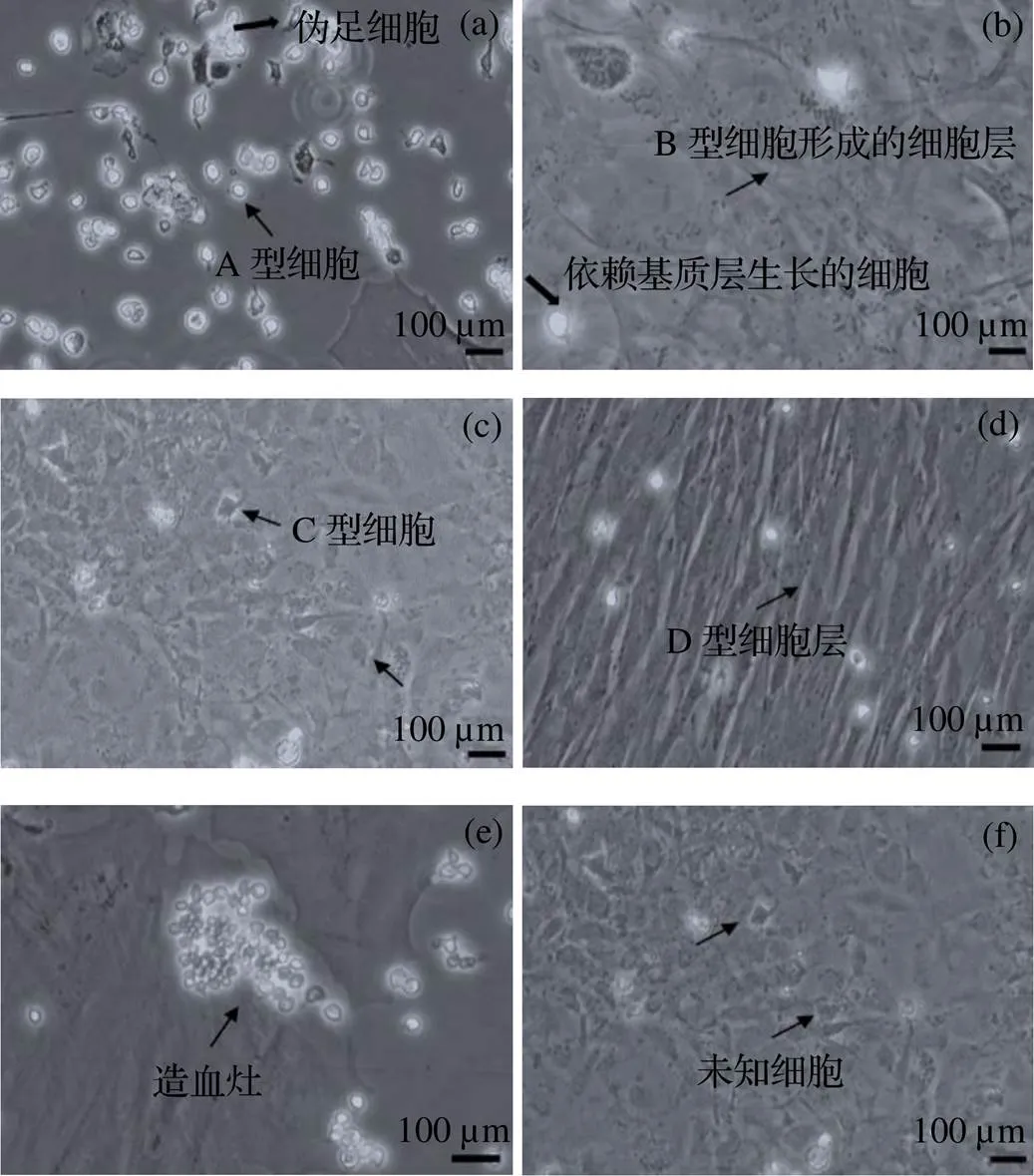
圖1 體外培養的銀鯧脾臟細胞
2.3 腎臟組織塊遷出細胞形態
接種的腎臟組織塊貼壁4d后, 大量的細胞開始從組織塊的周圍遷出, 并出現明顯的生長暈(圖2(a)). 開始的原代細胞是多種細胞共存, 隨著培養時間的推移, 最終培養物中共產生3種不同形態的細胞(圖2).
(1)A型細胞: 接種3~5d后的貼壁組織有細胞遷出, 細胞貼壁不牢, 細胞的胞核較小, 細胞呈現帶有短小突起的圓形或橢圓形, 部分細胞帶有較長偽足, 呈現不規則形狀(圖2(b)). (2)B型細胞: 在啟動培養7d后, 一些植塊邊緣開始遷出B型細胞(圖2(c)),遷出的細胞形態不一, 有的細胞呈現扁平狀、多角形, 胞質內含有大量黑色顆粒. (3)C型細胞: 貼壁組織培養初期, C型細胞與B型細胞同時遷出(圖2(d)), 細胞胞體呈現長梭形, 細胞交叉排列且沒有生長方向, 一般形成復雜的網狀結構. 當細胞不斷增殖, 細胞排列也更加密集, 形成質密的細胞層, 此時細胞貼壁極牢固.

圖2 體外培養的銀鯧腎臟細胞
3 討論
DMEM、M199和DMEM/F-12是魚類細胞培養中廣泛使用的基礎培養基. DMEM相對于MEM含有豐富的氨基酸和維生素; M199適用于多種魚類細胞的培養; DMEM/F-12營養成分豐富, 使用的血清較少[20-23]. Alvarez等[24]將DMEM/F-12培養基成功用于淡水魚和海水魚的鰭、腎等組織的培養. 李苗苗等[25]發現DMEM/F-12和L-15均適用于鰻鱺腎臟細胞的生長和增殖. Mauger等[26]在金魚鰭條組織的體外培養中發現DMEM/F-12能夠誘導培養物快速堿化, 因此不適合其鰭條組織細胞的增殖. 上述研究結果表明, 不同種類甚至同一種類不同組織遷出的細胞所需的培養基不同, 篩選合適的基礎培養基是提高細胞在體外成活率的關鍵.
本研究選用3種培養基(DMEM、M199和DMEM/F-12)作為銀鯧脾臟和腎臟等組織細胞培養的基礎培養基, 經過對比發現DMEM/F-12對銀鯧組織細胞的培養效果明顯優于DMEM和M199(表1), 表明DMEM/F-12比較適合銀鯧脾臟和腎臟組織細胞的體外培養.
胎牛血清是哺乳動物及魚類細胞體外培養重要的添加成分, 能夠為細胞提供生長所需的生長因子和各種營養物質, 但同時也含有一些對細胞增殖不利的物質[27-28]. 因此, 在對細胞進行離體培養時需要對胎牛血清的濃度進行優化. 本研究在對銀鯧脾臟和腎臟組織進行離體培養時對添加的胎牛血清設置了3個不同的濃度梯度, 通過對比細胞遷出數量和增殖速度發現, 當胎牛血清濃度為10%和15%時, 脾臟和腎臟組織遷出細胞少、細胞的增殖速度慢; 而當血清濃度提高到20%時, 脾臟和腎臟組織塊邊緣遷出大量細胞, 而且細胞生長最快、效果最好. 上述結果說明銀鯧脾臟和腎臟組織細胞對胎牛血清濃度的依賴性較強, 高濃度胎牛血清能刺激細胞遷出及增殖.
脾臟和腎臟是魚類重要的免疫器官[29], 其中脾臟主要由血細胞、內皮細胞、網狀細胞、巨噬細胞和黑色素巨噬細胞組成, 而腎臟主要由處于不同成熟階段的血細胞、內皮細胞以及具有排泄和內分泌功能的細胞組成[30-32]. 在魚類的特異性和非特異性免疫中, 脾臟和腎臟發揮著不可替代的作用, 脾臟的免疫防御功能僅次于頭腎[33]. 本研究在對銀鯧脾臟組織進行離體培養時發現有貼壁性不強、細胞較小、呈明亮的球狀細胞(圖1(a)), 這種細胞與Mu?oz等[34]在鱸魚(L)的血細胞體外培養中發現的淋巴細胞形態非常接近. 通過體外細胞染色發現, 該類型細胞核質比較多, 符合淋巴細胞特征, 因此推測該細胞類型為淋巴細胞. 王文君等[35]在大瀧六線魚脾臟細胞體外培養研究中得到一種基質細胞, 該細胞貼壁性較強, 其形態交叉分布, 在匯合之前就生長在其他細胞上, 以多層網狀結構存在, 這種細胞與圖1(b)細胞形態特征非常相似. 另外, 它們在生長及遷移過程中無接觸抑制現象, 能重疊生長, 與Diago等[36]在虹鱒()頭腎基質細胞系TPS的生長相符, 由此推測圖1(b)細胞為基質細胞. 圖1(c)細胞貼壁性較強、細胞形態多樣、形狀不規則, 為多邊形, 胞體呈扁平的棱形, 細胞中含有小顆粒, 這種細胞與Fla?o等[37]在虹鱒脾臟培養物中發現的上皮樣細胞和Diago等[36]在虹鱒頭腎基質細胞系培養中發現的上皮樣細胞形態特征極為相似, 所以推測圖1(c)細胞為類上皮樣細胞. 圖1(d)細胞或并排排列, 或交叉排列, 呈現出成纖維細胞樣, 這在虹鱒魚脾臟組織細胞培養[37]中以及虹鱒魚脾臟外植體構建具有網狀內皮特征的細胞系[38]中都有觀察到, 故推測為成纖維樣細胞. 基質細胞的類型多種多樣, 結構多層化, 更換培養基培養一段時間后, 圓形相的亮細胞松散附著在基質上, 通常它們以小簇的形式出現, 其中一些發展成巨大的團塊或堆積成類似“小山”樣的細胞. 當將其脫離基質細胞進行單獨培養時, 發現其出現停止增殖的現象, 所以圖1(e)細胞是依附基質細胞生存. 這與Ganassin等[39]在虹鱒魚脾臟組織細胞培養過程中發現的造血灶類似, 故推測圖1(e)細胞為造血灶. 此外, 在脾臟組織遷出細胞中觀察到一種貼壁性較強的細胞, 該細胞顏色較深、細胞排列緊密, 呈現卵圓形、扁平狀、扇形等多種形態. 目前, 在魚類脾臟組織細胞培養相關的文獻中尚未見到有關此類細胞的描述, 因此對圖1(f)細胞類型的確認還需進一步研究. 在對銀鯧腎臟組織培養過程中, 也出現了多種類型細胞, 包括巨噬細胞、成纖維樣細胞和上皮樣細胞等. 而隨著培養時間的延長, 巨噬細胞、成纖維樣細胞數量逐漸減少直至消失, 最終類上皮樣細胞在培養物中成為優勢細胞. 隨著培養時間的延長以及傳代次數的增加, 類上皮樣細胞形態呈扁平狀、細胞間隙增大、細胞密度降低, 同時細胞增殖緩慢. 許多研究表明[40-42], 細胞的增殖與細胞的密度密切相關, 來源不同的細胞擁有不同的特性, 有的細胞比較依賴于高密度才能生長. 趙晶等[43]在分離培養小鼠胚胎干細胞時提出細胞的接種密度能夠影響細胞的增殖. 本研究發現, 銀鯧腎臟組織來源類似上皮樣細胞, 對細胞密度要求很高. 細胞密度太低時, 細胞增殖緩慢、間隙增大、鋪層時間延長, 同時容易造成細胞衰老; 細胞密度過高時, 培養基營養成分不足, 細胞呈現纖細狀, 甚至卷曲脫落. 所以, 銀鯧腎臟組織遷出細胞的體外培養條件還有待進一步研究.
4 結語
本研究以銀鯧的脾臟和腎臟組織為材料, 用組織塊培養法成功進行了銀鯧脾臟和腎臟組織細胞原代培養, 發現在培養溫度為26℃時, 銀鯧的脾臟和腎臟組織細胞在添加20%FBS的DMEM/ F-12培養基中生長速度最快, 細胞遷出種類較多, 其中脾臟組織共遷出6種類型細胞, 腎臟組織共遷出3種類型細胞, 這可為銀鯧脾臟和腎臟組織細胞株和細胞系的建立提供參考.
[1] 許躍, 錢冬, 周素明, 等. 養殖銀鯧虹彩病毒感染的組織病理學分析及分子檢測[J]. 水產學報, 2020, 44(9): 1416-1423.
[2] 施兆鴻, 謝明媚, 彭士明, 等. 溫度脅迫對銀鯧()幼魚消化酶活性及血清生化指標的影響[J]. 漁業科學進展, 2016, 37(5):30-37.
[3] 魏秀錦, 張波, 單秀娟, 等. 渤海銀鯧的營養級及攝食習性[J]. 中國水產科學, 2019, 26(5):904-913.
[4] 楊程, 高權新, 張晨捷, 等. 飼料中添加南極磷蝦粉對銀鯧幼魚生長、非特異性免疫及抗氧化功能的影響[J]. 海洋漁業, 2019, 41(2):224-233.
[5] 周劍光, 張林, 張晨捷, 等. 銀鯧染色體核型研究[J]. 海洋漁業, 2018, 40(1):97-101.
[6] 施兆鴻, 趙峰, 王建鋼, 等. 舟山漁場銀鯧人工授精及孵化[J]. 漁業現代化, 2009, 36(1):18-21; 34.
[7] 唐旖, 蔡靈, 楊明. 細胞3D培養技術及其在水產養殖上的應用[J]. 漁業研究, 2020, 42(3):288-292.
[8] 于淼, 管華詩, 郭華榮, 等. 魚類細胞培養及其應用[J]. 海洋科學, 2003, 27(3):4-8.
[9] Wolf K, Quimby M C. Established eurythermic line of fish cells[J]. Science, 1962, 135(3508):1065-1066.
[10] 王藝舟. 中華鱘五種組織細胞系建立及青魚生殖細胞標記基因的鑒定[D]. 武漢: 華中農業大學, 2020.
[11] 王賢麗. 幾種重要海水養殖魚類細胞系的建立、誘導分化及其應用研究[D]. 青島: 中國海洋大學, 2009.
[12] 馬佳樂, 侯萍, 王思瑤, 等. 全氟辛酸誘導斑馬魚脾臟損傷及白細胞介素表達紊亂的免疫毒效應研究[J]. 環境科學學報, 2016, 36(7):2687-2693.
[13] 左文功, 錢華鑫, 許映芳, 等. 草魚腎組織細胞系CIK的建立及其生物學特性[J]. 水產學報, 1986, 10(1):11-17.
[14] Ye H Q, Chen S L, Sha Z X, et al. Development and characterization of cell lines from heart, liver, spleen and head kidney of sea perch[J]. Journal of Fish Biology, 2006, 69:115-126.
[15] Huang X H, Huang Y H, Sun J J, et al. Characterization of two groupercell lines: Application to studies of Singapore grouper iridovirus (SGIV) propagation and virus-host interaction[J]. Aquaculture, 2009, 292(3/4):172-179.
[16] 徐進. 斑點叉尾鮰腎臟細胞系建立與出血病病原學研究[D]. 武漢: 華中農業大學, 2012.
[17] 單莉娟. 松江鱸()腎細胞系的建立及生物學特性分析[D]. 大連: 大連海洋大學, 2015.
[18] 鄭在予, 楊金先, 陳秀霞, 等. 大黃魚腎臟組織細胞系(YCK)的建立[J]. 福建農業學報, 2017, 32(10):1051-1056.
[19] 趙建青, 賈鵬, 劉文枝, 等. 羅非魚腎臟細胞系的建立及其生物學特性[J]. 中國水產科學, 2019, 26(2):382-390.
[20] Chen S L, Sha Z X, Ye H Q. Establishment of a pluripotent embryonic cell line from sea perch () embryos[J]. Aquaculture, 2003, 218(1/2/3/4):141-151.
[21] 辛林偉, 魏凌云, 李強, 等. 培養基對兔骨髓間充質干細胞體外擴增的影響[J]. 山東大學學報(醫學版), 2009, 47(10):50-53; 59.
[22] 曾汝君, 馬亞仙, 張郡, 等. α-MEM培養基和高糖DMEM培養基對RAW264.7細胞向破骨細胞分化的影響[J]. 中國骨質疏松雜志, 2018, 24(6):745-749; 790.
[23] 龍舒婷, 羅鵬佗, 張永馨, 等. 魚類細胞培養的方法、條件及應用研究概述[J]. 生物學教學, 2020, 45(9):4-5.
[24] Alvarez M C, Otis J, Amores A, et al. Short-term cell culture technique for obtaining chromosomes in marine and freshwater fish[J]. Journal of Fish Biology, 1991, 39(6):817-824.
[25] 李苗苗, 吳斌, 林楠, 等. 鰻鱺腎臟細胞系的建立及其對鰻鱺皰疹病毒的敏感性[J]. 水生生物學報, 2020, 44(2):237-244.
[26] Mauger P E, le Bail P Y, Labbé C. Cryobanking of fish somatic cells: Optimizations of fin explant culture and fin cell cryopreservation[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2006, 144(1):29-37.
[27] 徐金輝, 秦緒禎, 張鴻程, 等. 無血清培養基和有血清培養基對背根神經節生長的差異[J]. 中國組織工程研究, 2021, 25(13):2043-2048.
[28] 代金彩, 聶竹蘭, 趙年樺, 等. 塔里木裂腹魚尾鰭細胞系的建立及鹽堿度對其增殖的影響[J]. 漁業科學進展, 2021, 8(3):1-12.

[30] 季益平, 匡思雯, 袁子, 等. 銀鯧脾臟和頭腎的形態與組織學特征[J]. 寧波大學學報(理工版), 2020, 33(4):1-5.
[31] 盧致遠. 甘露寡糖對生長中期草魚生產性能、免疫器官健康的作用及其機制[D]. 雅安: 四川農業大學, 2018.
[32] 雷雪彬. 草魚免疫器官個體發育的組織結構和免疫細胞變化[D]. 上海: 上海海洋大學, 2013.
[33] Dalmo R A, Ingebrigtsen K, B?gwald J. Non-specific defence mechanisms in fish, with particular reference to the reticuloendothelial system (RES)[J]. Journal of Fish Diseases, 1997, 20(4):241-273.
[34] Mu?oz J, Esteban M A, Meseguer J.culture requirements of sea bass (L.) blood cells: Differential adhesion and phase contrast microscopic study[J]. Fish & Shellfish Immunology, 1999, 9(5):417-428.
[35] 王文君, 張志峰, 汪岷, 等. 大瀧六線魚脾臟細胞體外培養的研究[J]. 中國海洋大學學報(自然科學版), 2010, 40(8):93-97.
[36] Diago M L, López-Fierro M P, Razquin B, et al. Establishment and characterization of a pronephric stromal cell line (TPS) from rainbow trout,W[J]. Fish & Shellfish Immunology, 1995, 5(6): 441-457.
[37] Fla?o E, López-Fierro P, álvarez F, et al. Splenic cultures from rainbow trout,: Establishment and characterisation[J]. Fish & Shellfish Immunology, 1998, 8(8):589-606.
[38] Moritomo T, Anderson D P, Schill W B. Establishment of a cell line with reticulo-endothelial characteristics from a rainbow trout spleen explant[J]. Fish Pathology, 1990, 25(3):165-169.
[39] Ganassin R, Bols N. Development of long-term rainbow trout spleen cultures that are haemopoietic and produce dendritic cells[J]. Fish & Shellfish Immunology, 1996, 6(1):17-34.
[40] 張豐, 李青, 秦緒軍, 等. 細胞密度與細胞增殖關系的初步分析[J]. 醫學研究生學報, 2006(1):23-25; 33.
[41] Jorgensen P, Tyers M. How cells coordinate growth and division[J]. Current Biology, 2004, 14(23):R1014-R1027.
[42] Prehn R T. Many growth factors may not be growth factors[J]. Cancer Research, 1992, 52(3):501-507.
[43] 趙晶, 董雅娟, 柏學進, 等. 飼養層細胞的接種密度對分離培養胚胎干細胞的影響[J]. 中國獸醫學報, 2009, 29(4):494-501.
The primary culture of cells from spleen and kidney tissues of
WANG Yan, SHU Fengling, CHEN Dongyue, WANG Yajun, XIE Jiasong, ZHOU Suming*
( School of Marine Sciences, Ningbo University, Ningbo 315832, China )
Tissues from spleen and kidney of the silver pomfret were collected for primary cell culture using tissue piece cultivation method, in order to study the primary cell cultured conditions. DMEM, M199 and DMEM/F-12 supplemented with different concentrations of fetal bovine serum (10%, 15% and 20% FBS) and antibiotics (penicillin, gentamicin) were applied to prevent bacterial contamination. The results showed that tissues in DMEM/F-12 with 20% FBS had the best cell adherence and fastest cell growth, based on cell attachment efficiency and growth rate. The immune cells, stromal cells, epithelioid cells, fibroblast-like cells, and hematopoietic foci were present in the spleen tissue cultures of silver pompano. Hematopoietic foci cells were observed on the stromal layer. In cell cultures of silver pomfret kidney, there were mainly three types of cells. These were the epithelioid cells, macrophages and fibroblast-like cells. The establishment of cell lines from spleen and kidney of silver pomfret would benefit the research on the functions of the fish spleen and kidney.
; spleen; kidney; cell culture
S917.4; Q246
A
1001-5132(2022)04-0009-06
2021?08?18.
寧波大學學報(理工版)網址: http://journallg.nbu.edu.cn/
浙江省重點研發計劃項目(2019C02059); 寧波市公益項目(202002N3043); 寧波市自然科學基金(2019A610426).
王燕(1995-), 女, 江蘇連云港人, 在讀碩士研究生, 主要研究方向: 魚類疾病. E-mail: 2793747318@qq.com
通信作者:周素明(1981-), 女, 湖北棗陽人, 博士/講師, 主要研究方向: 水產動物疾病防控及健康養殖. E-mail: zhousuming@nbu.edu.cn
(責任編輯 史小麗)

