內鏡下護理干預止血治療聯合H+-K+酶抑制劑對十二指腸潰瘍患者的治療效果及對免疫功能的影響
陳玲紅,吳雅鋆,林慧玲,莊云英 (聯勤保障部隊第910醫院消化內鏡中心,福建 泉州 362000)
消化性潰瘍分為兩種,其一為胃潰瘍,第二個為十二指腸潰瘍,其中十二指腸潰瘍在我國屬于常見病和多發病之一[1-2]。潰瘍的形成存在各種因素,其中基本因素為酸性胃液對黏膜的消化作用[3]。十二指腸潰瘍多發生于氣候變化比較大的春秋兩季,而且男性的發病率要高于女性,十二指腸潰瘍多發生在十二指腸球部,以前壁居多,其次為后壁、下壁和上壁[4]。隨著社會的高速發展,人們生活、工作的節奏不斷加快,壓力增大和生活不規律等,導致我國十二指腸潰瘍的發病率持續上升,對人們的生活、工作等造成嚴重影響,因此,尋找一種安全有效的治療方法尤為重要[5]。H+-K+酶抑制劑是在臨床治療中最為常用的抑制胃酸分泌的藥物,常用于十二指腸潰瘍患者[6]。內鏡下護理止血治療是目前臨床上較為常用的內鏡治療護理方法。本文研究中使用內鏡下止血治療聯合H+-K+酶抑制劑對十二指腸潰瘍患者進行治療,觀察和對比其治療效果及對免疫功能的影響。現報告如下。
1 資料與方法
1.1一般資料:選取2018年9月~2021年3月與我院接受治療的十二指腸潰瘍患者137例,按照隨機分為抑制劑組(68例)、聯合護理組(69例)。抑制劑組包括男37例,女31例,年齡20~56歲,平均(36.10±18.90)歲,病程1~5年,平均(2.85±2.04)年;聯合護理組患者包括男36例,女33例,年齡19~50歲,平均(32.77±16.36)歲,病程2~7年,平均(4.275±2.58)年,兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。本研究所用患者及家屬均知情同意,并獲得我院倫理委員會批準。
納入標準:所有入選患者均經我院胃鏡檢查顯示十二指腸潰瘍病灶。
排除標準:①病歷資料不全者;②H+-K+酶抑制劑過敏者;③合并血液系統疾病者;④有溝通障礙,無法溝通者。
1.2方法
1.2.1治療方法:兩組患者均進行抗生素、保護胃黏膜等治療。抑制劑組使用H+-K+酶抑制劑進行治療,20 mg/次,空腹口服,2次/d。聯合護理組在抑制劑組的基礎上給予內鏡下護理干預止血治療:術前護理,患者入院之后,根據患者的癥狀、體征以及檢查結果估算出出血量,對患者建立起靜脈通道,擴充血容量。由內鏡護士向患者以及家屬扼要解釋出血原因、內鏡治療的基本原理以及優點,向患者講述成功案例,對術中可能產生的不適情況進行詳細說明,使患者心理壓力降低,更好地配合治療。在術中患者取左側位,在下方放置一次性墊防止嘔吐物污染,進境之后嚴密觀察患者的生命體征,保持呼吸通暢。在術后囑咐患者禁食24~48 h,48 h之后若無出血情況,給予少量溫、涼無渣流質飲食,告誡患者盡量避免腹部用力。
1.2.2兩組患者H+-K+-ATP酶活性、胃泌素水平比較:使用ATP比色法檢測H+-K+-ATP酶活性、胃泌素。收集所有患者治療前后靜脈血5 ml,按照體積比1∶9加入沸雙蒸水,在沸水攪勻制成10%勻漿液后再置于沸水中煮10 min,抽提1 min離心測量。
1.2.3治療前后BAO、MAO、PAO水平比較:使用免疫透射比濁法檢測BAO、MAO、PAO。準備3個試管并分別標記為標準管、測定管及空白管,3個試管中均加入350 μl緩沖液,標準管中加入20 μl BAO、MAO、PAO標準液,測定管中加入20 μl血清,空白管中加入20 μl蒸餾水,3個試管分別搖晃均勻,常溫環境靜置5~10 min后使用分光光度計進行比色,在500 nm波長處以空白管調零,記錄吸光度,對BAO、MAO、PAO水平進行計算。
1.2.4治療前后HMGB1、TNF-α、hs-CRP水平比較:使用酶聯免疫吸附實驗法檢測HMGB1、TNF-α、hs-CRP。使用之前收集好的患者靜脈血5 ml,離心處理后-80℃環境中保存。采用酶聯免疫吸附法(ELISA)對HMGB1、TNF-α、hs-CRP蛋白表達量進行檢測,取50 mm碳酸鹽包緩沖液對抗原進行稀釋,在聚苯乙烯的反應孔內加入使用50 mm碳酸鹽包緩沖液稀釋后抗原,進行加蓋處理之后存放24 h在攝氏度4℃冰箱內,第2天進行3次洗滌,然后拋干,將稀釋液(pH值為7.4 0.02 mol/L Tris-HCl緩沖液)稀釋的待測標本0.1 ml放入每個孔中,同時放入陽性和陰性對照標本,存放在攝氏度42℃環境中60 min,移除液體后,進行3次洗滌并拋干,在每個孔中放入HMGB1、TNF-α、hs-CRP 0.1 ml,存放60 min,移除液體后。進行3次洗滌并拋干,在每個孔中放入低物液(0.1 mol/L的Na2HPO4,0.05 mol/L的枸櫞酸),混勻之后放入0.1 ml鄰苯二胺,進行20 min遮光,再一次放入2 mol/L H2SO40.05 ml放置在每個孔內,終止反應。最后使用酶標儀檢測A450值檢測HMGB1、TNF-α、hs-CRP。
1.2.5CD3+、CD4+、CD8+水平檢測:使用流式細胞儀檢測CD3+、CD4+、CD8+。將待測細胞用磷酸鹽緩沖液洗2次,加入5 μl的AnnexinV染液和10 μl的碘化丙啶染液,4℃避光染色30 min,使用流式細胞儀檢測凋亡率。將待測細胞用70%的乙醇溶液4℃固定,次日離心,用含有終濃度為1 mg/ml的RNaseA酶加100 μl后混勻,之后加PI染液0.4 ml避光染色30 min,使用流式細胞儀檢測細胞周期的變化。
1.2.6兩組護理質量對比:對比護理組患者護理質量,護理質量的內容包括了服務態度、就診管理、服務規范3個項目,每小項100分,分數越高表明護理質量越好。
1.2.7療效評價:將兩組患者治療效果分為顯效、有效、無效三種標準。顯效:臨床癥狀消失,胃鏡顯示潰瘍癥狀消失;有效:臨床癥狀明顯改善,潰瘍面積縮小50%以上;無效:臨床癥狀未得到緩解甚至加重。總有效率=(顯效例數+有效例數)/總例數×100%。

2 結果
2.1兩組H+-K+-ATP酶活性、胃泌素水平比較:兩組患者治療前H+-K+-ATP酶活性、胃泌素水平比較,差異無統計學意義(P>0.05);治療后兩組患者H+-K+-ATP酶活性、胃泌素水平均有所下降,且聯合護理組低于抑制劑組,差異具有統計學意義(P<0.05)。見表1。

表1 兩組H+-K+-ATP酶活性、胃泌素水平比較
2.2兩組治療前后基礎胃酸排泌量(BAO)、單胺氧化酸(MAO)、銅綠假單胞菌(PAO)水平比較:兩組患者治療前BAO、MAO、PAO水平比較,差異無統計學意義(P>0.05);治療后兩組患者BAO、MAO、PAO值均有所下降,且聯合護理組低于抑制劑組,差異具有統計學意義(P<0.05)。見表2。

表2 兩組治療前后BAO、MAO、PAO水平比較
2.3兩組治療前后高遷移率族蛋白β1(HMGB1)、腫瘤壞死因子-α(TNF-α)、超敏C-反應蛋白(hs-CRP)水平比較:兩組患者治療前HMGB1、TNF-α、hs-CRP水平比較,差異無統計學意義(P>0.05);治療后兩組患者HMGB1、TNF-α、hs-CRP均有所下降,且聯合護理組HMGB1值高于抑制劑組,TNF-α、hs-CRP低于抑制劑組,差異具有統計學意義(P<0.05)。見表3。

表3 兩組治療前后HMGB1、TNF-α、hs-CRP水平比較
2.4兩組治療前后CD3+、CD4+、CD8+水平比較:治療前兩組患者CD3+、CD4+、CD8+水平對比,差異無統計學意義(P>0.05);治療后聯合護理組CD3+、CD4+水平高于抑制劑組,CD8+水平低于抑制劑組,差異具有統計學意義(P<0.05)。見表4。
2.5兩組護理質量比較:兩組患者治療前服務態度、就診管理、服務規范評分相比,差異無統計學意義(P>0.05);治療后兩組患者服務態度、就診管理、服務規范評分有所上升,且與抑制劑組相比,聯合護理組服務態度、就診管理、服務規范評分較高,差異有統計學意義(P<0.05)。見表5。

表4 兩組治療前后CD3+、CD4+、CD8+水平比較
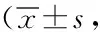
表5 兩組患者護理質量比較分)
2.6兩組患者治療有效率比較:聯合護理組患者治療總有效率高于抑制劑組,差異具有統計學意義(P<0.05)。見表6。

表6 兩組患者治療有效率比較[n(%)]
2.7不良反應率比較:聯合護理組患者治療過程中不良反應發生率略高于抑制劑組,但兩組比較差異無統計學意義(P>0.05)。見表7。

表7 不良反應率比較[n(%)]
3 討論
有學者在研究中表明,胃酸分泌異常是十二指腸潰瘍癥狀發病的決定性因素。所以治療十二指腸潰瘍時應先抑制胃酸分泌[7]。H+-K+酶抑制劑作為一種廣譜的質子泵抑制劑,具有抑制胃酸分泌的作用[8],黃森湛等在研究[9]中表示,使用H+-K+酶抑制劑對十二脂腸潰瘍患者進行治療,能夠抑制胃酸分泌,幫助潰瘍愈合。應用內鏡下止血治療出血的成功率極高,避免了患者實施外科手術[10]。隨著內鏡與附近技術的飛速發展,使用內鏡下護理干預出血治療來對十二指腸潰瘍患者得到了廣泛的應用[11]。本文研究中使用H+-K+酶抑制劑聯合內鏡下護理干預止血治療對十二指腸潰瘍患者進行治療,患者H+-K+-ATP酶活性、胃泌素均明顯下降,說明H+-K+酶抑制劑聯合內鏡下護理干預止血治療能夠抑制患者體內的H+-K+-ATP酶活性和胃泌素的分泌,抑酸效果更加理想。
BAO為基礎胃酸分泌量,指在無食物、藥物刺激的狀態下連續數小時的胃酸分泌量[12]。MAO是指經五肽胃泌素刺激后,1小時內內壁細胞充分發揮分泌功能,所能分泌的胃酸量[13]。PAO是銅綠假單胞菌,又稱為綠膿桿菌,為一種革蘭陰性菌、好氧、呈長棒形的細菌,是一種機會性感染細菌[14]。PAO廣泛分布于自然界及正常人的皮膚、腸道和呼吸道,是臨床一種較為常見的條件致病菌之一。PAO天生對大部分抗生素具有抗藥性,其中包括慶大霉素、頭孢他啶、哌拉西林、丁胺卡那霉素、頭孢噻肟酸等,并且能夠快速產生抗藥性突變[15]。本文研究中使用H+-K+酶抑制劑聯合內鏡下護理干預止血治療對十二指腸潰瘍患者進行治療,患者BAO、MAO、PAO均明顯下降,說明H+-K+酶抑制劑聯合內鏡下護理干預止血治療能夠抑制十二指腸潰瘍患者體內BAO、MAO、PAO的增殖,有一定的治療效果。
HMGB1為高遷移率族蛋白B1,是一種高度保守的核蛋白,廣泛分布于哺乳動物細胞內[16]。HMGB1具有極強的黏性,可以與細胞表面多種不同分子結合,如肝磷脂、蛋白聚糖、磷脂等。TNF-α屬于TNF受體超家族,目前,研究人員已經證實腫瘤壞死因子蛋白同系物超家族存在著29個不同的受體[17]。這些受體又被分為三類。TNF主要由活化的巨噬細胞,NK細胞及T淋巴細胞產生。hs-CRP是由機體受到微生物入侵或組織損傷等炎性反應性刺激時肝細胞合成的急性相蛋白,在炎性反應開始時就迅速攀升,在48 h時便可達到頂峰[18]。本文研究中使用H+-K+酶抑制劑聯合內鏡下護理干預止血治療對十二指腸潰瘍患者進行治療,患者體內HMGB1、TNF-α、hs-CRP均出現下降趨勢,說明使用H+-K+酶抑制劑聯合內鏡下護理干預止血治療能夠控制十二指腸潰瘍患者HMGB1、TNF-α、hs-CRP值。
臨床研究表明,十二指腸潰瘍會對患者免疫功能造成一定影響,T淋巴細胞亞群的測定是檢測機體細胞免疫功能的重要指標,并且對某些疾病(如自身免疫病、免疫缺陷病、惡性腫瘤、血液病、變態反應性疾病等)有一定的輔助診斷作用,能夠在分析發病機制,觀察療效及監測預后有重要意義[19-20]。T淋巴細胞是機體免疫系統內功能最重要的一大細胞群,在正常機體內各個T淋巴細胞亞群相互使用,維持著機體正常免疫功能。CD3+T細胞是主要的淋巴細胞亞群,參與機體適應性免疫應答過程,CD4+T淋巴細胞亞群是輔助T細胞表面的一種標記,主要是對體液免疫和細胞免疫起到輔助作用。CD8+T淋巴細胞亞群是抑制性T細胞的一種標記。主要對免疫以及細胞毒性起到抑制作用[21]。本文研究結果顯示,使用H+-K+酶抑制劑聯合內鏡下護理干預止血治療對十二指腸潰瘍患者進行治療,T淋巴細胞亞群CD3+、CD4+水平出現上升,CD8+水平出現下降,說明二者聯合能夠調控患者體內CD3+、CD4+、CD8+水平增強患者的免疫功能。
本文研究中發現,使用H+-K+酶抑制劑聯合內鏡下護理干預止血治療后患者護理質量評分得到較好的改善,此結果說明兩者聯合對十二指腸潰瘍患者進行治療,能夠有效提升護理質量,對患者的治療起到較好的促進作用。由此可見,使用H+-K+酶抑制劑聯合內鏡下護理干預止血治療能夠對十二指腸潰瘍患者起到較好的護理作用,值得臨床推廣。
綜上所述,本文研究中發現,使用H+-K+酶抑制劑聯合內鏡下護理干預止血治療能夠抑制十二指腸潰瘍患者體內的H+-K+-ATP酶活性、胃泌素的分泌、BAO、MAO、PAO,減少患者體內胃酸的生成,調節T淋巴細胞亞群,增強患者的免疫功能,起到較好的護理效果。

