槲皮素脂質納米粒凍干粉末體外穩定性及肝癌細胞毒性研究
苗方,馬蘭
菏澤醫學專科學校,山東 菏澤 274000
槲皮素(Quercetin,Que)具有明確的抗癌、抗炎作用[1-2],但因其具有低水溶性、低生物利用度以及化學穩定性較差的劣勢,在臨床應用中受到了極大的限制[3]。納米技術的出現為槲皮素提供了前所未有的發展空間,為許多疏水性藥物提高溶解度和生物利用度提供了有效的方法。槲皮素制備成納米顆粒并經由納米載體遞送之后,具有極高程度的抗癌潛力,在臨床應用中擁有一定治療前景,受到各界的廣泛關注[4]。納米制劑常用于提高藥物溶解度、吸收、循環、滯留時間以及體內分布特異性的各種遞藥系統,包括自乳化乳劑、納米顆粒、脂質載體、膠束、包合物等,這些技術皆能夠提高槲皮素的生物利用度與穩定性,極大地提高了槲皮素的臨床應用價值[5-7]。
固體脂質納米粒(solid lipid nanoparticles,SLN)是采用適當的方法,將脂質材料制備成納米粒子,將疏水性藥物包裹或嵌合于脂質核中用以提高溶解度,且通過生理因素增加納米粒子在體內靶部位的蓄積。納米脂質載體在用于遞送抗癌藥物時具有諸多顯著的優點,如較好的物理化學穩定性、較高的載藥量和包封率、可控的藥物釋放行為、優良的靶向性及工業化生產的可行性[8-10],故將槲皮素結合脂質納米粒技術進行研究,可充分發揮槲皮素應有的治療潛力。
雖然有關槲皮素納米遞藥系統的報道較多,但有關槲皮素的體外穩定性研究依然較少,本研究制備包載槲皮素的脂質納米粒(SLNs/Que),對其凍干粉末的穩定性進行相關制劑學評價以及體外抑制肝癌細胞的作用研究,為槲皮素臨床制劑的基礎開發提供一定的參考。
1 儀器與試藥
1.1 儀器
電子天平(ME204E,METTLER TOLEDO,瑞士);集熱式磁力攪拌器(DF-101S,上海秋佐科學儀器有限公司);超聲波清洗儀(SB-5200D,張家港市科宇信超聲有限公司);動態光散射儀(Zetasizer nano ZSP,Malvern,英國);高效液相色譜儀(L-2000,桂林伯樂馬科技有限公司);超聲波細胞粉碎機(SFX250,EMERSON,美國);CO2細胞培養箱(MCO-18AC,SANYO,日本);酶標儀(Synergy H1,Bio Tek,美國伯騰儀器有限公司)。
1.2 試藥
槲皮素(質量分數>98%,上海純優生物有限公司);大豆卵磷脂(質量分數>95%,上海綠都實業有限公司);吐溫80(國藥試劑有限公司);香豆素(C6,大連美侖生物有限公司);四甲基偶氮唑藍(上海鈺森生物技術有限公司);優級胎牛血清(四季青生物工程公司);RPMI-1640 培養基(上海sigma-aldrich);其他分析純及色譜純有機試劑均購于國藥試劑有限公司。
2 方法
2.1 脂質納米粒的制備
SLNs/Que 的最佳工藝(已在前期研究中確定使用熱熔乳化超聲分散法):70 ℃水浴加熱攪拌條件下,將已確定用量的槲皮素和單硬脂酸甘油酯溶解于無水乙醇中,作為油相;將已確定用量的大豆卵磷脂和吐溫80 溶解于純化水中,作為水相;保持溫度不變,在攪拌下,以10 mL/min 恒速地將水相溶液分散于油相溶液中;同時采用超聲波處理器處理混合溶液(時間為3 min,功率為400 w,工作與間歇各2 s),制成乳白色的初乳;超聲結束后放置于25 ℃水浴降溫,過0.45 μm 微孔濾膜,即得淡藍色透明的SLNs/Que 溶液。將制備的SLNs/Que 溶液加入10%甘露醇,分裝于西林瓶中,冷凍干燥后得到SLNs/Que 粉末。將粉末經注射用水復溶后,得到SLNs/Que 凍干粉末復溶溶液。空白SLNs 凍干粉末亦采用上述方法制備。
2.2 槲皮素體外分析方法建立
配置質量濃度在2.0 μg/mL~12.0 μg/mL范圍的系列槲皮素標準品溶液,查閱相關文獻,采用紫外可見分光光度法測定槲皮素溶液的吸光度(375 nm波長),將槲皮素溶液濃度和吸光度值分別作為橫坐標(X)和縱坐標(Y),對其進行線性回歸分析[11]。分別取2.0、8.0、12.0 μg/mL 的槲皮素標準品溶液作日內和日間精密度。精密量取白色的SLNs/Que凍干粉末,采用無水乙醇破乳后,配置成9 份供試品溶液,每份加入不同質量的槲皮素標準品(每份1 mL,分別加入0.4 mg、0.5 mg 和0.6 mg,各3 份),稀釋定容后,測定加樣回收率。
2.3 SLNs/Que 包封率和載藥量測定
精密移取制備好的SLNs/Que溶液,15 000 r/min離心20 min,沉淀的納米粒用無水乙醇破乳后,紫外可見分光光度法測定吸光度值(375 nm),按公式(1)和(2)計算得包封率和載藥量。

2.4 穩定性檢查
將SLNs/Que 溶液及SLNs/Que 凍干粉末貯藏于干燥器中,分別于0、30、60、90 d 取樣,對SLNs/Que 溶液及SLNs/Que 凍干粉末復溶溶液進行觀察。使用激光粒度儀測定粒徑和zeta電位。按“2.3”項下方法,測定并計算載藥量和包封率。
2.5 體外釋放行為考察
采用透析法測定SLNs/Que 的體外釋放行為。精密量取0、30、60 和90 d 凍干粉末復溶的SLNs/Que溶液、未凍干的SLNs/Que 溶液和游離槲皮素溶液各6.0 mL,裝入處理好的透析袋,兩端扎緊,浸入含1%吐溫80(v/v)pH 7.4 磷酸鹽緩沖液的200 mL 溶出介質中,進行體外釋放檢查(37±0.5 ℃,100 r/min)。在相應的透析取樣時間點,分別吸取2.0 mL 釋放介質(同時補加同體積同溫度的溶出介質),采用紫外可見分光光度法測定槲皮素濃度。將計算后的槲皮素累計釋放百分率繪制成體外釋放曲線。
2.6 四甲基偶氮唑藍比色法測定細胞活力
HepG2 細胞培養于37 ℃,5%CO2和飽和濕度環境下含5%胎牛血清、100 U/mL 青霉素、100 μg/mL鏈霉素的RPMI-1640 細胞培養液中。將細胞懸液,接種于96 孔板(2×104個)中。培養過夜,棄去培養液。設定空白對照組(為細胞培養液)、空白制劑組(為培養液+不同濃度空白SLNs 溶液)、游離藥物組(為培養液+不同濃度游離槲皮素溶液)、給藥制劑組(為培養液+不同槲皮素濃度的SLNs/Que溶液),加樣(各組100 μL)。分別孵育48 和72 h 后,每孔加入25 μL 四甲基偶氮唑藍溶液(5 mg/mL)處理,測定各孔的光密度OD 值(λ=490 nm),按以下公式(3)計算細胞存活率(以不加藥物的空白細胞為對照組),并計算IC50值。

2.7 統計學方法
數據均采用SPSS 18.0 統計,P<0.05 表示差異有統計學意義。
3 結果
3.1 槲皮素體外分析方法建立
采用紫外可見分光光度法建立槲皮素體外分析方法,線性回歸方程為Y=0.124X+0.062 2,r=0.999 5。結果表明,槲皮素在特定的范圍內(2.0μg/mL~12.0 μg/mL)質量濃度與吸光度呈良好線性。見圖1。高、中和低三種濃度測定的日內精密度和日間精密度的RSD 均小于2.0%,表明測定方法的日間和日內精密度良好。測定方法的加樣回收率結果分別為96.28%、95.47%和101.3%(n=3),表明SLNs輔料對槲皮素含量的測定無影響。
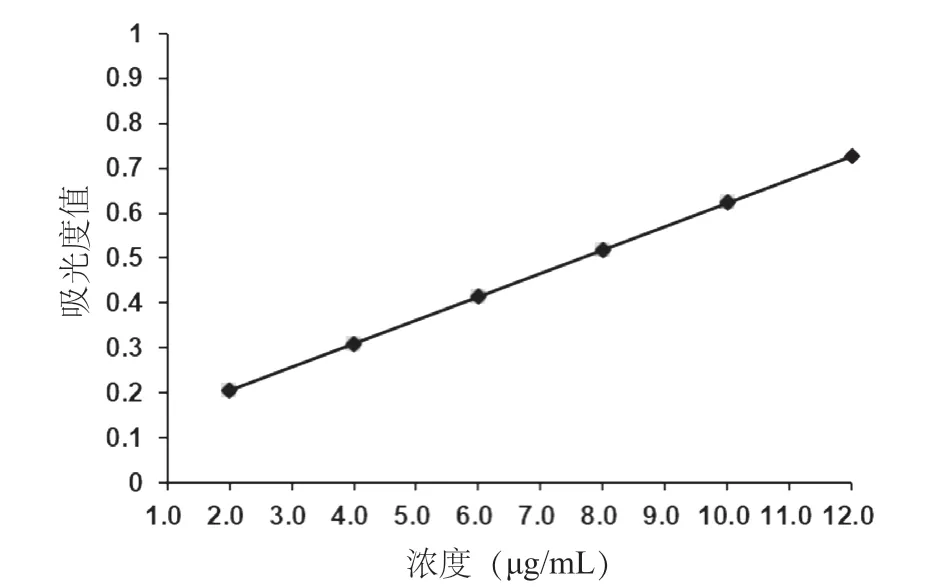
圖1 槲皮素質量濃度與吸光度線性回歸圖
3.2 SLNs/Que 的制劑學性質
考察熱熔乳化超聲分散法最佳工藝制備SLNs/Que 溶液及SLNs/Que 凍干粉末復溶溶液的制劑學性質,結果如表1 所示。研究結果表明,SLNs/Que 溶液和凍干后60 d 內的復溶溶液,其外觀形態均為透明澄清、粒徑、zeta 電位、包封率和載藥量無變化,但凍干后90 d 的復溶溶液,可觀察到外觀渾濁,且呈現一系列不穩定現象如包封率與載藥量明顯降低、粒徑增大、Zeta 電位降低。
表1 SLNs/Que溶液及SLNs/Que凍干粉末復溶溶液的制劑學考察結果()

表1 SLNs/Que溶液及SLNs/Que凍干粉末復溶溶液的制劑學考察結果()
3.3 SLNs/Que 的體外釋放性質研究
不同制劑組槲皮素的累計釋放曲線如圖2 所示,游離槲皮素組2 h 的累計釋放量高達(86.7±3.43)%,4 h 的累計釋放量達到了90%以上;SLNs/Que 凍干粉末90 d 的復溶溶液組2 h 的累計釋放量為(65.6±6.23)%,12 h 的累計釋放量達到了90%以上;而SLNs/Que 溶液組、凍干粉末的復溶溶液組(0 d、30 d、60 d)的累計釋放曲線相似,累計釋放量基本相同,無顯著的凸釋現象,且均呈現了較好的緩釋效果,48 h 的累計釋放量達到90%,基本釋放完全。
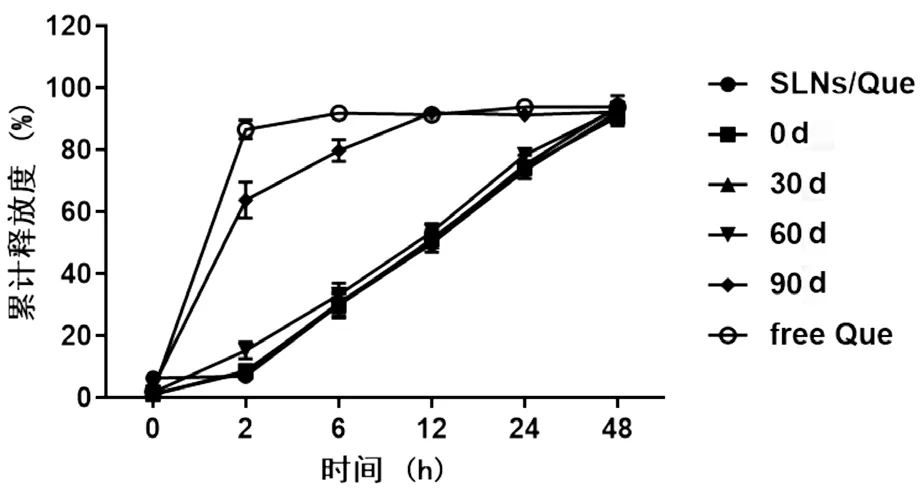
圖2 體外釋放曲線(n=3)
以上結果表明,SLNs/Que 凍干粉末保存60 d的復溶溶液與新制備的SLNs/Que 溶液的制劑學性質及體外釋放行為基本一致,后續采用保存60 d 內的SLNs/Que 凍干粉末復溶溶液進行相關實驗。
3.4 體外細胞毒性研究
采用四甲基偶氮唑藍比色法測定SLNs/Que 對HepG2 細胞的毒性作用。不同濃度空白SLNs 組細胞的生存率均大于90%,表明空白SLNs 對HepG2細胞幾乎無毒性作用,空白載體材料安全性較高。不同濃度的空白SLNs 對HepG2 細胞處理不同時間后的細胞存活率如圖3 所示。
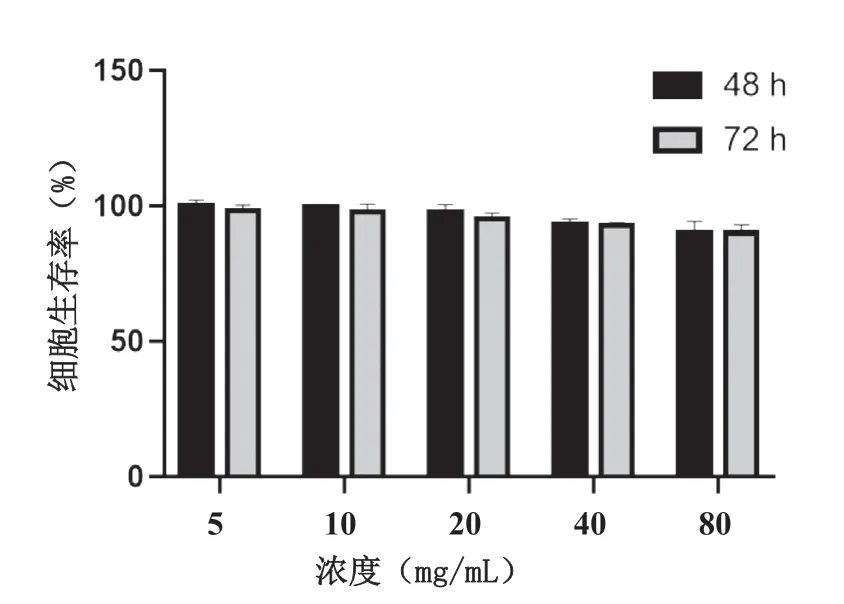
圖3 HepG2經空白SLNs處理48 h和72 h后的細胞存活率(n=5)
HepG2 細胞經SLNs/Que 和槲皮素原料藥處理不同時間后的細胞存活率如圖4 所示。結果表明,隨著槲皮素原料藥濃度增加,其對細胞的毒性也增加。HepG2 細胞經SLNs/Que 和槲皮素原料藥處理后48 h和72 h的IC50值如表2所示。48 h和72 h時,SLNs/Que 的IC50分別降低57.73%和76.27%。與槲皮素原料藥的IC50相比,將槲皮素制成固體脂質納米粒后IC50明顯降低,差異有統計學意義。結果表明,通過脂質納米粒包載后,槲皮素對HepG2 細胞毒性作用增強。
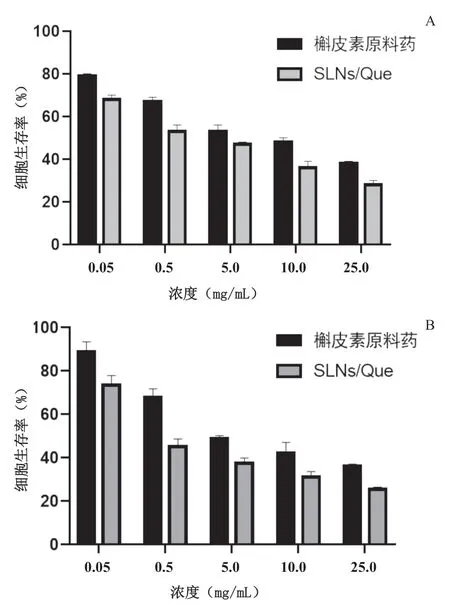
圖4 HepG2細胞經SLNs/Que和槲皮素原料藥處理48 h(A)和72 h(B)后的細胞存活率(n=5)
表2 SLNs/Que和槲皮素原料藥的IC50()

表2 SLNs/Que和槲皮素原料藥的IC50()
4 討論
由于槲皮素在水中溶解度較低,且體內的分布不具有特異性,因此導致其臨床應用受到了極大的限制。本研究采用熱熔乳化超聲分散法制備的SLNs/Que 脂質納米粒,改善以上不足的同時,兼具控制槲皮素緩慢釋放的作用,且更易于工業化生產[12]。SLNs/Que 是以脂質為骨架材料,卵磷脂及吐溫80 為乳化劑制備的納米實心小球。對于微粒分散體系來說,適宜的粒徑除了利于制劑的體外穩定性,還能決定微粒在體內的分布行為,最終對制劑的靶向效果產生一定的影響。由于槲皮素分散于脂質骨架材料中,在釋放過程中,以擴散的方式來實現相對緩慢的釋放,維持體內穩定的血藥濃度。最終結果顯示,本研究制備的脂質納米粒在保存90 d后,其凍干粉末的穩定性下降明顯,可能與凍干保護劑甘露醇的用量有關[13-14],今后將對此問題進行進一步的研究與探討。

