江西省市售鹽酸溴己新片的質(zhì)量分析
宋曉園,賴佐發(fā),廖婷,吳曉勇
贛州市綜合檢驗檢測院,江西 贛州 341000
鹽酸溴己新片為祛痰藥。1961 年由德國勃林格公司的卡爾-托梅子公司開發(fā),我國于1973 年開始生產(chǎn),1977 年開始收入《中國藥典》[1-2],現(xiàn)行標準包括原料及片劑,片劑的規(guī)格為8 mg[3-4]。目前,已獲國家批準生產(chǎn)鹽酸溴己片劑的企業(yè)有33家,批準文號33 個。鹽酸溴己新原料在《歐洲藥典》(10.0版)和《英國藥典》(2020 年版)等國外標準均有收載。本研究對2021 年在江西市場上市售的60 批次鹽酸溴己新片按照《中國藥典》2015 年版二部[3]及國家藥品監(jiān)督管理局標準YBH07702019[5]進行全項目檢驗,將產(chǎn)品的溶出度與參比制劑進行比對,并對水分、有關(guān)物質(zhì)等項目進行探索性研究。
1 儀器與試藥試劑
1.1 儀器
Waters E2695高效液相色譜儀[2998 PDA Detector、Empower 工作站,沃特世科技(上海)有限公司];Agilent1260 高效液相色譜儀(DAD 檢測器,安捷倫科技公司);XSE205DU 型電子天平[梅特勒-托利多(瑞士)];S220 多參數(shù)測試儀[梅特勒-托利多儀器(上海)有限公司];RC8MD 溶出試驗儀(天津市天大天發(fā)科技有限公司);708-850DS 溶出度儀(安捷倫科技公司);V20 容量法卡爾費休水分儀[梅特勒-托利多(瑞士)]
1.2 試藥
抽驗劑型均為片劑,共60 批次樣品,規(guī)格均為8 mg;涉及3 家生產(chǎn)企業(yè)和3 個批準文號,分別占總生產(chǎn)企業(yè)數(shù)和總批準文號數(shù)的9.1%。抽自經(jīng)營企業(yè)48 批次(占80.0%),醫(yī)療單位12 批次(占20.0%)。參比制劑為溴己新片Bisolvon?,批號200968,有效期至202306。樣品信息詳見表1。
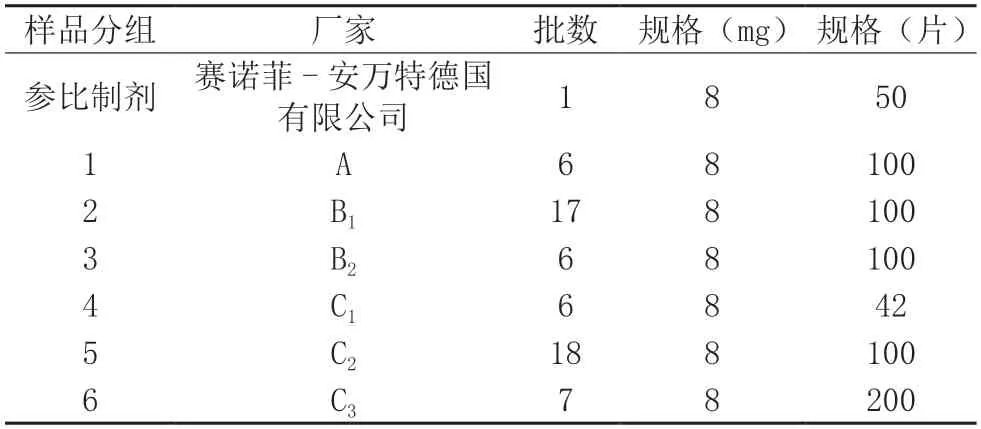
表1 樣品信息
1.3 試劑
鹽酸溴己新對照品(中國食品藥品檢定研究院,批號100427-201903,含量按C14H20Br2N2·HCl計,供HPLC 法測定,含量為99.8%;供UV 法測定,含量為99.9%);鹽酸溴己新雜質(zhì)Ⅰ(中國食品藥品檢定研究院,批號101378-202102);雜質(zhì)Ⅵ(XIZE,批 號:1005A,含 量:98.47%);雜 質(zhì)C[(雜質(zhì)Ⅳ)RAX,批號:20-B00183-06,含量:99.0%];雜質(zhì)A(RAX,批號:20-B00181-03,含量:97.10%);雜質(zhì)B(RAX,批號:20-B00182-05,含量:98.70%);雜質(zhì)D(RAX,批號:20-B00184-08,含量:97.40%);雜質(zhì)F(HEDR,批號:0304A,含量:99.98%);雜質(zhì)H(RAX,批號:20-B00188-11,含量:99.50%);雜質(zhì)I(HEDR,批號:0304B,含量:98.07%);雜質(zhì)J(RAX,批號:20-B001810-03,含量:99.40%);雜質(zhì)K(RAX,批號:20-B001811-03,含量:95.50%);雜質(zhì)L(RAX,批號:20-B001812-07,含量:97.30%);甲醇、乙腈為色譜純,其他試劑均為分析純,水為純化水(FST-Ⅳ-20 超純水機制備)。
2 方法與結(jié)果
2.1 溶出度研究
2.1.1 色譜條件 色譜柱為Xtimate? C18(4.6 mm×250 mm,5 μm),流動相為磷酸鹽緩沖液(取磷酸二氫鉀1.0 g,加900 mL 水使溶解,用0.5 mol/L 氫氧化鈉溶液調(diào)節(jié)pH 值至7.0,用水稀釋至1 000 mL,搖勻)-乙腈(20∶80),流速為1.0 mL/min,PDA 檢測器,檢測波長為245 nm,柱溫為40 ℃,進樣體積為50 μL。
2.1.2 溶出條件 槳法;轉(zhuǎn)速為75 轉(zhuǎn)/min;四種溶出介質(zhì)分別為pH 1.2 鹽酸溶液、pH 4.0 磷酸氫二鈉-檸檬酸緩沖溶液、pH6.8磷酸鹽緩沖溶液和水[6],溶出介質(zhì)體積900 mL,37.0 ℃,取樣時間點為0、5、10、15、30、45、60 min,取樣體積10 mL(濾過,并即時在溶出杯中補充相同溫度、相同體積的溶出介質(zhì),棄去初濾液5 mL,取續(xù)濾液作為供試品溶液),試驗片數(shù)均為6 片。
2.1.3 吸附性 實驗證明鹽酸溴己新具有濾膜吸附性以及溶出度儀器管路的吸附性,造成溶出度結(jié)果偏低,本次研究中鹽酸溴己新片溶出度試驗時采用手動取樣,用有機膜濾過,棄去足夠初濾液以排除吸附性的影響。
2.1.4 溶出曲線比對 將60批國產(chǎn)鹽酸溴己新片分成6組(樣品信息見表1),與參比制劑溶出曲線進行比對研究。國產(chǎn)企業(yè)6 組樣品批間平均累積溶出量與參比制劑在同種溶出介質(zhì)中平均累積溶出量的結(jié)果見表2;此次試驗的鹽酸溴己新片在pH1.2 鹽酸溶液及pH4.0磷酸氫二鈉-檸檬酸緩沖溶液中的溶出速率比較快,在水中次之,在pH6.8 磷酸鹽緩沖溶液中溶出效率低,最大溶出量僅達到40%左右。參比制劑與3 家國內(nèi)企業(yè)6 組樣品在4 種溶出介質(zhì)中的溶出曲線見圖1。

表2 國內(nèi)企業(yè)6組樣品批間平均累積溶出量與參比制劑在同種溶出介質(zhì)中平均累積溶出量
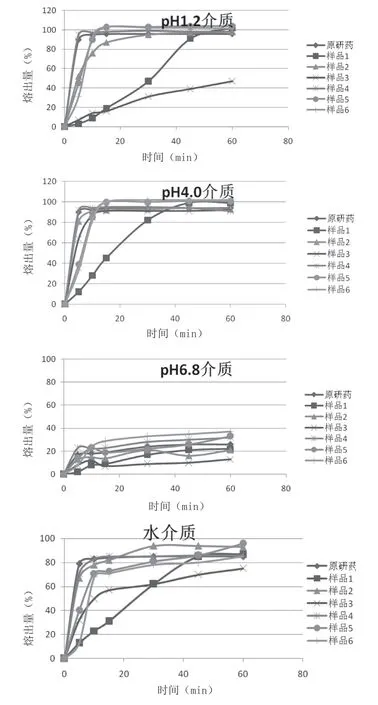
圖1 參比制劑與3家國內(nèi)企業(yè)6組樣品在4種介質(zhì)中的溶出曲線圖
2.1.5 結(jié)果 C1制劑(通過一致性評價的制劑)與參比制劑具有相似的溶出曲線,B1、B2、C2、C3制劑與參比制劑的溶出曲線具有差異性,A 制劑與參比制劑的溶出曲線具有較大的差異。
2.2 水分研究
2.2.1 方法 《中國藥典》2020 年版四部[4]通則0832水分測定法第一法(費休氏法)1.容量滴定法測定。
2.2.2 測定結(jié)果 依照表1 的分組,測得批間水分平均值,見表3。A 廠家制劑的水分批間差異較大。
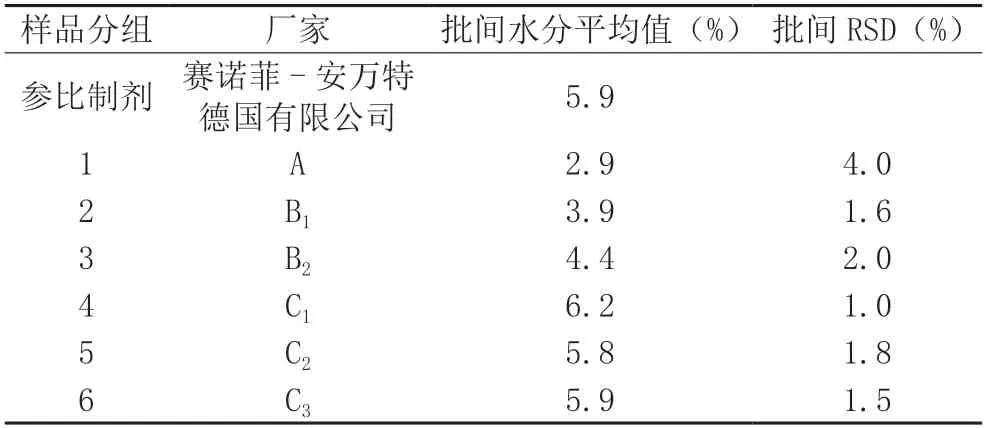
表3 樣品水分值
2.3 有關(guān)物質(zhì)研究
2.3.1 色譜條件 參考文獻[4,7-9]建立色譜方法,色譜柱:Inspire 5 μm C18,250 mm×4.6 mm,5 μm;PDA 檢測器;檢測波長:245 nm;柱溫:40 ℃;流動相A 為0.01 mol/L 乙酸銨溶液,B 為甲醇,C 為乙腈,進行梯度洗脫,見表4。
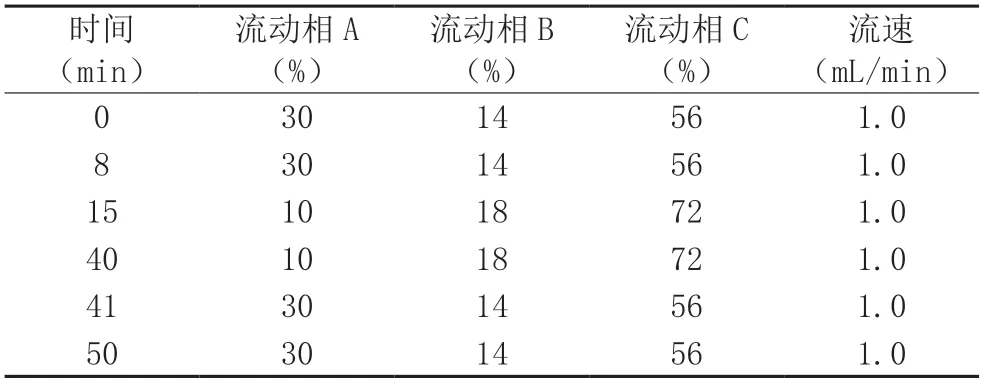
表4 梯度洗脫表
2.3.2 結(jié)果 典型圖譜見圖2。3 家國內(nèi)企業(yè)6 組樣品雜質(zhì)總量檢測結(jié)果全部符合現(xiàn)行標準的規(guī)定(雜質(zhì)總量不得過0.3%);參比制劑1 批樣品同法檢測,雜質(zhì)總量小于0.3%。單個雜質(zhì)檢出情況:國產(chǎn)制劑樣品共檢出6 種已知雜質(zhì)(雜質(zhì)B、雜質(zhì)C、雜質(zhì)L、雜質(zhì)F、雜質(zhì)Ⅵ、雜質(zhì)Ⅰ)和未知雜質(zhì)X,其他已知雜質(zhì)(雜質(zhì)H、雜質(zhì)A、雜質(zhì)I、雜質(zhì)K、雜質(zhì)J、雜質(zhì)D)均未檢出;參比制劑樣品未知雜質(zhì)X 未檢出,僅含有微量的雜質(zhì)B、雜質(zhì)D、雜質(zhì)Ⅵ;雜質(zhì)L 及雜質(zhì)F 僅A 廠家檢出;單個雜質(zhì)檢出量均小于0.1%。與《中國藥典》2015 年版二部和國家藥品監(jiān)督管理局標準YBH07702019 的有關(guān)物質(zhì)規(guī)定相符,最大單個雜質(zhì)量與雜質(zhì)總量差異無統(tǒng)計學意義。在溫度40 ℃、相對濕度75%條件下,6 組樣品拆去內(nèi)包裝(裸露)進行加速實驗,30 d 后取樣測定其有關(guān)物質(zhì),結(jié)果6組樣品的單個雜質(zhì)檢出量均小于0.1%,雜質(zhì)總量均小于0.3%,與拆包裝前數(shù)據(jù)差異無統(tǒng)計學意義。
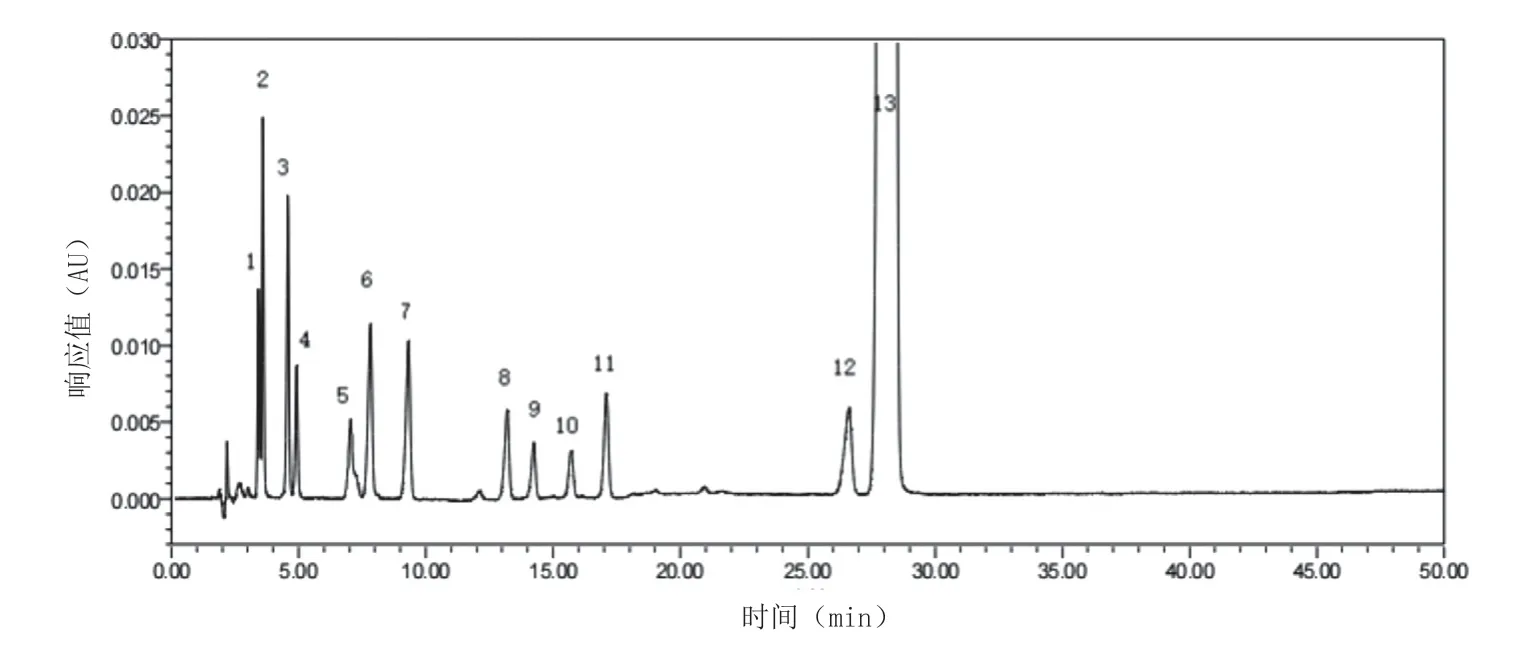
圖2 混合對照品圖譜
2.4 總檢驗結(jié)果
本次抽樣的江西省內(nèi)市售鹽酸溴已新片中,有54 批執(zhí)行標準為《中國藥典》2015 年版二部,6 批執(zhí)行標準為國家藥品監(jiān)督管理局標準YBH07702019。按上述標準檢驗,60 批次均符合規(guī)定,合格率為100%。
3 討論
各家企業(yè)所用鹽酸溴己新原料的來源不同,晶型有所差異,粒徑大小分布也不同,所用的輔料類別及數(shù)量也差別較大,溶出度探索性研究的結(jié)果顯示A 廠家與參比制劑的溶出曲線差別較大,提示企業(yè)應(yīng)注意處方的合理性,積極開展仿制藥質(zhì)量和療效一致性評價工作。《中國藥典》2015 年版二部鹽酸溴己新片無水分檢查項,通過水分測定的研究,顯示A廠家的批間水分差別較大,易使產(chǎn)品質(zhì)量無法得到良好的控制,提示企業(yè)應(yīng)制定相關(guān)質(zhì)量控制標準。

