妊娠早期合并絨毛膜隆起的染色體微陣列分析價值
張曉梅 管衛東
由于各種因素的影響,自然流產的發生人數越來越多,已經成為當前一種比較嚴重的公共衛生問題[1,2]。自然流產是非人為目的造成的流產,指妊娠不足28周、胎兒體重不足1 000g而終止妊娠,其中發生在孕12周前的稱為早期流產。早期流產占自然流產的85.0%以上,約有15.0%的妊娠婦女經歷過早期流產。影響早期自然流產的因素比較多,其中遺傳因素為重要因素[3]。絨毛膜隆起是底蛻膜面絨毛膜向妊娠囊內局部的不規則凸起,在臨床上相對比較罕見,其具體的病因、發病特征還不明確,但是可導致早期流產的發生。染色體微陣列分析(Chromosomal microarray analysis,CMA)技術也被稱為分子核型分析,是臨床上比較先進的檢測技術[4]。CMA可通過固定在基質上的高密度DNA探針來檢測染色體上的互補序列,可覆蓋全基因組,還可免于進行細胞培養,從而達到基因組水平的檢測,同時可檢測染色體拷貝數變異情況,提供染色體核型分析不能提供的染色體微重復、微缺失等信息,檢測染色體不平衡的拷貝數變異(Copy number variations,CNV)[5,6]。CMA具有高通量、準確、方便等優勢,可檢出染色體中的嵌合體、三倍體、單親二倍體、雜合性缺失等[7]。本研究探討妊娠早期合并絨毛膜隆起的CMA價值,以促進CMA的應用。
1 材料與方法
1.1 一般資料 選擇2018年6月~2021年2月在我院診治的妊娠早期自然流產患者122例作為研究對象。納入標準:孕周≤12周;單胎妊娠;B超提示胎兒停止發育;簽署知情同意書;年齡18~45歲;無心、肝、腎等其他基礎疾病。排除標準:有自然流產史者;孕期感染及有害物質接觸史者;臨床資料缺乏者;有家族遺傳病史者;不愿意進行病理采樣者。其中,經產婦38例,初產婦84例;平均年齡(31.48±2.22)歲;平均體質指數(25.01±1.24)kg/m2;平均收縮壓(122.58±13.01)mmHg;平均舒張壓(73.58±10.42)mmHg;平均產次(1.42±0.11)次;平均孕次(2.44±0.18)次;平均孕周(8.17±0.23)周;平均空腹血糖(5.16±0.24)mmol/L。
1.2 超聲方法 所有患者均行超聲檢查,采用美國GE公司生產的VolusonS超聲診斷儀,配有經陰式探頭,探頭頻率為5~8MHz。患者取空腹狀態,放松身心,取截石位,采用無菌式探頭進入陰道掃查子宮及雙側附件區,實時采集圖像并記錄孕囊長度、胚芽長度等,測量絨毛膜隆起的數量及長度并觀察宮腔實時積液狀況。
1.3 染色體微陣列分析 所有患者均給予CMA,DNA提取試劑盒購自QIAGEN公司,全基因組芯片購自Affimetrix公司,數據分析采用Genomestudio2020軟件(SNP array,Illumina公司)。
無菌操作下取所有患者的流產胚胎絨毛置于1.5ml無菌離心管(含有無菌的生理鹽水)內,留取絨毛組織或胎兒大腿內側皮膚面積為2cm×2cm。研磨后提取全基因組DNA,定量DNA濃度后進行DNA純化。選擇CMA平臺進行分析,通過系統軟件芯片圖像顯示分析,記錄染色體異常情況。
1.4 統計學方法 本研究統計軟件為SPSS 21.0,以均數±標準差表示計量數據,采用t檢驗,以率(%)表示計數數據,采用χ2檢驗,所有統計學檢驗采用雙側檢驗,相關性分析采用Spearman(計數數據)和Pearson(計量數據)分析。以P<0.05表示差異有統計學意義,檢驗水準為α=0.05。
2 結果
2.1 兩組超聲指標對比 122例患者中,超聲檢查為絨毛膜隆起12例(絨毛膜隆起組),占比9.8%,其中僅有1個絨毛膜隆起者4例,2~3個絨毛膜隆起者6例,>3個絨毛膜隆起者2例。絨毛膜隆起組的絨毛膜隆起長度高于非絨毛膜隆起組(P<0.05),兩組的孕囊長度、胚芽長度對比差異無統計學意義(P>0.05)。見表1。
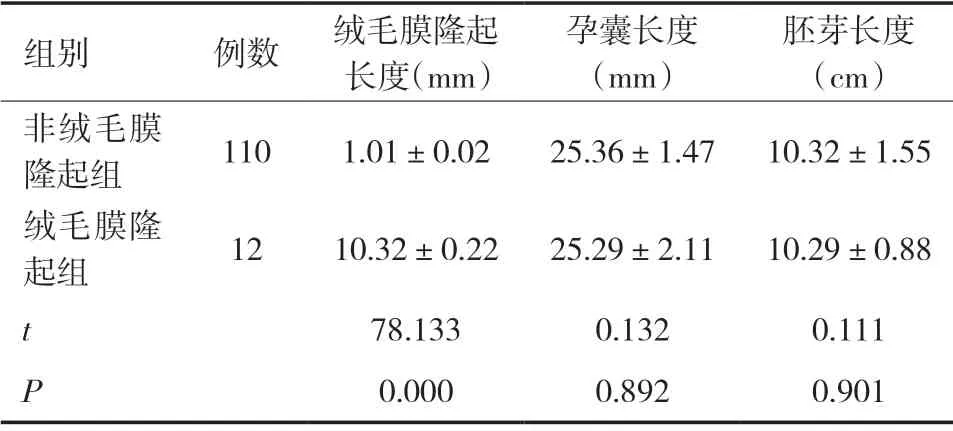
表1 兩組超聲指標對比
2.2 染色體異常情況 所有患者均成功進行CMA,絨毛膜隆起組的染色體異常率為91.7%(11/12),高于非絨毛膜隆起組的9.1%(10/110)(χ2=51.772,P<0.000)。
2.3 染色體異常類型 在絨毛膜隆起組中,染色體數目異常10例,染色體結構異常1例。在非絨毛膜隆起組中,染色體數目異常9例,染色體結構異常1例,對比差異無統計學意義(P>0.05)。見表2。
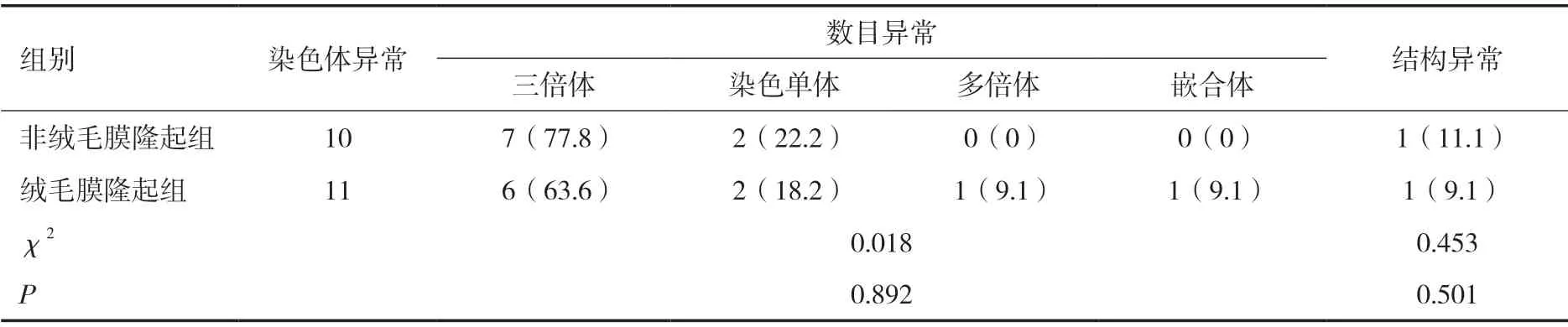
表2 兩組染色體異常類型[n(%)]
2.4 相關性分析 在絨毛膜隆起組中,Spearsman和Pearson分析顯示絨毛膜隆起長度與染色體異常存在相關性(P<0.05),與孕囊長度、胚芽長度無相關性(P>0.05)。見表3。
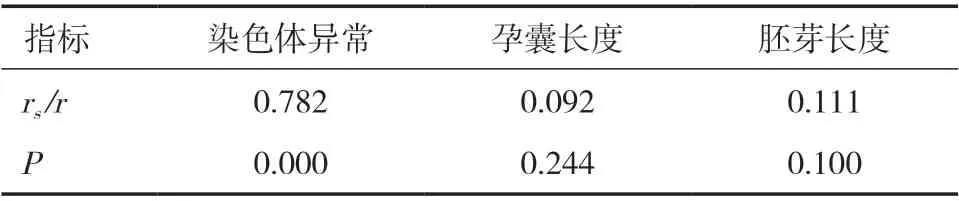
表3 妊娠早期合并絨毛膜隆起的染色體微陣列分析價值
3 討論
自然流產在臨床上比較常見,在育齡婦女中的發生率為10.0%左右,且隨著育齡婦女年齡的增加而增加。近年來隨著生育年齡的推遲及內外在環境的變化,自然流產的發生率有逐年上升的趨勢[8]。絨毛膜隆起是妊娠早期比較少見的一種妊娠囊異常,主要表現為妊娠早期孕囊形態不規則,絨毛膜向妊娠囊內的局部不規則突起。絨毛膜由囊胚的滋養細胞發育而成,絨毛膜表面大量分布有絨毛。隨著胚胎的發育,絨毛可轉變為葉狀絨毛膜,形成胎盤[9]。但是也有部分絨毛膜因血供少,絨毛逐漸退化,而真正成為絨毛膜。絨毛膜隆起為葉絨毛內側出血,囊內壓力較低,無法突破滋養層,可向囊內突起。絨毛膜下血腫指絨毛膜板與底蛻膜分離出血,血液存在于宮腔內子宮壁和絨毛膜之間,可形成血腫[10]。絨毛膜隆起一般呈圓形或橢圓形,多沿子宮壁內側走行,絨毛膜下血腫多表現為妊娠囊、宮腔內、子宮壁之間的無回聲區。妊娠早期合并絨毛膜隆起多會導致胚胎發育障礙,增加流產、早產的發生。本研究顯示在122例患者中,超聲檢查為絨毛膜隆起12例(絨毛膜隆起組),絨毛膜隆起組的絨毛膜隆起長度高于非絨毛膜隆起組(P<0.05),兩組的孕囊長度、胚芽長度對比差異無統計學意義(P>0.05),表明妊娠早期合并絨毛膜隆起多伴隨有絨毛膜隆起長度增加。當前有研究顯示早期妊娠伴有1個絨毛膜隆起的患者流產率在50.0%左右,伴有>1個絨毛膜隆起的患者流產率為100.0%,表明早期流產與絨毛膜隆起大小、隆起數量均有一定的相關性[11]。
妊娠早期合并絨毛膜隆起患者的絨毛細胞活性較差,采用藥物或人工終止妊娠術取出停止發育的胚胎時,很難做到完全無菌性[12]。核型分析為傳統細胞遺傳學技術,對于檢測人員的要求比較高,很難進行推廣應用。染色體微陣列分析彌補了上述不足,具有診斷速度快、分辨率高等優勢,其檢測結果可反映染色體乃至全基因組拷貝數變異等情況,可預測新生兒的結構畸形和智力低下等情況[13]。本研究顯示所有患者CMA均成功,絨毛膜隆起組的染色體異常率為91.7%,高于對照組的9.1%(P<0.05)。在絨毛膜隆起組中,染色體數目異常10例,染色體結構異常1例。在非絨毛膜隆起組中,染色體數目異常9例,染色體結構異常1例,差異無統計學意義(P>0.05)。特別是CMA可精確鑒定標記染色體的來源、區域位置和大小,同時其不易受母血污染而影響結果,能檢測出染色體的微缺失和重復[14]。同時CMA無需培養,具有高檢出率、自動化、高分辨率等特點,能檢出微小片段的缺失、重復。
早期妊娠是胚胎形成、胎兒器官分化的重要時期,絨毛膜突出雖然具有很好的超聲特征,但是超聲易受氣體、膀胱充盈、患者體質指數等影響,容易出現漏診與誤診。CMA在多基因疾病定位克隆以及關聯分析方面取得了很好的效果,其能很好地檢測三倍體、嵌合體等,特別是對染色體嵌合異常的診斷具有更好的靈敏性。本研究Spearman和Pearson分析顯示妊娠早期合并絨毛膜隆起的絨毛膜隆起長度與染色體異常存在相關性(P<0.05),與孕囊長度、胚芽長度無相關性(P>0.05)。并且CMA也能檢測到精確度很高的拷貝數變異,也拓寬了分析自然流產病因的新思路[15]。本研究由于時間問題,納入的患者數量較少,也未進行其他檢測方法的對比分析,將在后續研究中探討。
總之,CMA在妊娠早期合并絨毛膜隆起患者的應用可有效反映染色體數目與結構異常情況,具有很好的臨床價值。

