甘藍型油菜BnaFIL基因啟動子的克隆與表達分析
陳 靜,胡 蓉,劉 勇,秦 藝,熊興華
(湖南農業大學,作物基因工程湖南省重點實驗室,湖南 長沙 410125)
甘藍型油菜(Brassicanapus,AACC,2n=38)作為全球重要的油料作物之一,在我國廣泛種植。在我國,油菜作為油料作物在生產中占有十分重要的位置,是我國第一大油料作物[1]。我國油菜產量大約占全世界總產值的1/3,油菜的種植面積和油菜產量都位居世界第一[2-3]。油菜種植面積占油料作物播種面積的1/2左右,油菜的產量占所有油料作物產量的2/5左右,但依舊不能滿足國民對食用油的巨大需求。為緩解國內食用油的需求,60%左右的食用油需從國外進口油脂或油料。我國南方實行稻稻油三熟制,以提高植物油的產量、保證植物油的安全[4]。在我國油菜的主產區多以種植半冬性油菜為主,其生育期較長,與雙季稻的生育期存在沖突,因此,選育出開花早的早熟品種油菜能夠使油菜生育期縮短,對實行稻稻油三熟制起到至關重要的作用[5]。
適時開花以及花的形態發育不僅對甘藍型油菜的產量與品質有重要影響,同時也決定了其對生態區域的適應性,因此,植株開花的早晚以及花的形態發育是甘藍型油菜育種的重要目標性狀[6-7]。油菜提前開花表明生育期會縮短,所以對甘藍型油菜開花基因的調控機制進行研究有助于油菜早熟品種的選育,為油菜開花期、成熟期的遺傳改良提供理論與實踐依據。
FIL(FILAMENTOUS FLOWER)基因屬于YABBY轉錄調節因子家族中的一個子家族成員[8],對其分生組織中心區域的非自主性影響是通過抑制分生組織的活性來調節的。在植物發育過程中,葉和花等側生器官是由分生組織中的奠基細胞(Founder cells)分化發育而成。細胞確定分化成各器官的命運之后,側生器官原基的發育一直受到分生組織中至今未知的信號調控。例如,用解剖方法或者激光切除方法將葉原基從分生組織中分離,將會得到輻射狀對稱的遠軸化的葉片,表明這種控制葉片近軸化發育的信號來自分生組織[9]。相反地,分生組織的活性受側生器官中的一個信號因子調控。有研究表明,擬南芥和金魚草中的YABBY基因參與這種信號的調控[10-11]。
在擬南芥中,擬南芥fil單突變體會導致花器官成細絲狀,以及花器官形態存在缺陷。Lugassi等[12]在擬南芥中研究發現,FIL基因中存在一個fil-9突變體,該突變體導致花器官的數量和大小出現了高度變異,部分出現同源化以及花序組織出現缺陷。Douglas等[13]對fil-10抑制系的遺傳學和細胞學分析表明,FIL在促進生長方面的作用與它之前所描述的對分生組織特性和側枝器官極性的影響無關,轉錄譜分析表明,FIL下調了大量轉錄因子,而這些轉錄因子又從屬于花序結構的調控部分。Chung等[14]探究生長素反應因子與多效基因之間的互作關系時,發現與野生型擬南芥相比較,其他幾個突變體ettarf4、fil-8、filettarf4、filettarf4old和filettarf4NPA均出現了花序異常的現象,fil的突變體花序均呈現出絲狀結構,無法完成正常的授粉過程,以至于會影響到植株后期的正常發育。Bonaccorso等[15]將擬南芥中的4個YABBY家族基因在酵母中表達,發現只有FIL激活了報告基因。類似的分析表明,該基因是一種激活因子。同時有相關研究表明,FIL基因能夠對開花時間進行調控,同時也可以維持和調控花序分生組織、花分生組織和花器官原生質體的發育[16]。Tanaka等[17]發現,在擬南芥與水稻之間FIL/TOB基因的分支YABBY基因的功能可能被保守,以維持植株分生組織的正常功能。
目前,對FIL基因的研究主要集中在擬南芥和其他植物,甘藍型油菜BnaFIL基因的研究和報道還比較少,FIL基因在油菜中的具體作用還不夠明確。本研究通過克隆BnaFIL基因的啟動子并構建表達載體,將構建好的表達載體轉入擬南芥中并對轉基因植株進行分析,以期為進一步研究甘藍型油菜BnaFIL基因功能提供依據。
1 材料和方法
1.1 試驗材料
本研究所用的12份甘藍型油菜包括6份早花材料、6份晚花材料,均由國家油料改良中心湖南分中心提供。野生型擬南芥(Arabidopsisthaliana)、大腸桿菌(Escherichiacoli)DH5α菌株、農桿菌(Agrobacteriumtumefaciens)GV3101菌株及植物表達載體pBI121均由湖南農業大學作物基因工程湖南省重點實驗室提供。
限制性內切酶ScaⅠ、BamHⅠ、DL2000 DNA Marker、Trans 5k DNA Marker、抗生素、dNTP、高保真聚合酶等購自北京全式金;pUCm-T克隆載體、T4DNA連接酶、DNA質粒提取試劑盒、膠回收試劑盒、利福平抗生素、卡那霉素、GUS染色劑、瓊脂糖等購自生工生物工程(上海)股份有限公司;引物合成和測序由湖南擎科生物技術有限公司完成。
1.2 甘藍型油菜BnaFIL基因啟動子克隆及分析
在TAIR數據庫中查找到擬南芥AtFIL基因的ID(AT2G45190),用擬南芥AtFIL基因的ID在Brassica Database數據庫中Blast,得到甘藍型油菜中BnaFIL基因上游的大約1 300 bp序列信息,用Primer 5.0設計引物,分別命名為BnaFIL-P-F和BnaFIL-P-R(表1)。
表1 引物序列Tab.1 The primer sequences
以甘藍型油菜葉片中提取的DNA為模板,用BnaFIL-P-F和BnaFIL-P-R特異性引物進行PCR擴增。PCR反應體系(50 μL):DNA模板1 μL(1 054.2 ng/μL),2.5 mmol/L dNTP 4 μL,上游引物1 μL(10 μmol/L),下游引物1 μL(10 μmol/L),10×TransTaq HiFi Buffer 5 μL,TransTaq HiFi DNA Polymerase 1 μL,ddH2O 37 μL。PCR反應程序:94 ℃預變性3 min;94 ℃變性45 s,52 ℃退火45 s,72 ℃延伸1.5 min,共35個循環;72 ℃再延伸10 min。PCR擴增結束后,經1%瓊脂糖凝膠電泳對產物進行檢測,采用膠回收試劑盒對pBnaFIL片段進行回收,回收后的目的片段利用T4DNA連接酶連接到pUCm-T克隆載體,熱激法轉化大腸桿菌DH5α感受態。經菌落PCR鑒定后送擎科生物技術有限公司測序。測序結果利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare)在線分析軟件對序列進行順式作用元件預測。
1.3 表達載體構建
將帶pBnaFIL片段的菌種進行擴繁并提取質粒,以該質粒為模板,在原有的啟動子擴增引物上加入限制性內切酶ScaⅠ、BamHⅠ的酶切位點(表1中加粗字母)以及相應的保護堿基對啟動子進行PCR擴增,引物序列見表1。PCR反應體系(50 μL):DNA模板1 μL(1 054.2 ng/μL),2.5 mmol/L dNTP 4 μL,上游引物1 μL(10 μmol/L),下游引物1 μL,10×TransTaq HiFi Buffer 5 μL,TransTaq HiFi DNA Polymerase 1 μL,ddH2O 37 μL。PCR反應程序:94 ℃預變性3 min;94 ℃變性45 s,57 ℃退火45 s,72 ℃延伸1.5 min,共35個循環;72 ℃再延伸10 min。PCR擴增結束后,經1%瓊脂糖凝膠電泳對產物進行檢測,采用膠回收試劑盒對目的片段進行回收,回收后的目的片段利用T4DNA連接酶連接到pUCm-T克隆載體,熱激法轉化大腸桿菌DH5α感受態。經菌落PCR鑒定后提取質粒,同時對pBI121載體質粒進行提取。
分別用內切酶FlyCutScaⅠ和FlyCutBamH Ⅰ對目的片段質粒和pBI121載體進行雙酶切,酶切體系(50 μL):質粒10 μL(986.71 mg/μL),FlyCutScaⅠ1 μL,FlyCutBamHⅠ1 μL,10×FlyCut Buffer 5 μL,ddH2O 33 μL。37 ℃孵育3 h,終止反應時80 ℃加熱20 min。回收酶切后的目的片段,用pBnaFIL啟動子替換pBI121載體上的CaMV35S啟動子,采用T4DNA連接酶構建pBnaFIL-GUS表達載體。將重組質粒通過熱激法轉入大腸桿菌中,在含有卡那霉素(50 mg/mL)的LB培養基上過夜培養,挑取單菌落進行菌落PCR鑒定,提取陽性菌株的質粒進行雙酶切鑒定。
采用凍融法將pBnaFIL-GUS表達載體轉入農桿菌GV3101感受態,將其涂布在含有卡那霉素(50 mg/mL)和利福平(25 mg/mL)的YEB培養基上28 ℃培養2~3 d。挑取單菌落進行PCR鑒定,鑒定引物如表1所示,陽性菌落保存于-80 ℃。
1.4 啟動子表達分析
1.4.1 野生型擬南芥的種植 擬南芥種子消毒:取適量野生型擬南芥種子(不超過50 μL)放入1.5 mL/2.0 mL離心管中,加入75%的酒精1 mL渦旋1 min,用滅菌水清洗1次,加入10%的次氯酸鈉1 mL,期間不斷振蕩消毒10 min,最后用滅菌水清洗6~7次。在洗好的種子中加入0.1%瓊脂糖水1 mL混勻,將混勻的種子均勻鋪灑在1/2 MS培養基上,密封后置于4 ℃冰箱春化2~3 d。
擬南芥的培養:將春化后的種子放置于植物生長培養箱,溫度設置在22~24 ℃,光周期設置在16~18 h,光照強度2 000 lx,以保證擬南芥正常生長。培養7 d左右將野生型擬南芥幼苗移栽至人工土生長,每天觀察其生長狀態,7 d澆一次水,每次都將土完全澆透。移栽后1個月植株開始抽薹,將抽薹出的第1個花序從基部剪去,以便長出更多分枝。待分枝花序長至茂盛就可以進行花序浸染。
1.4.2 農桿菌菌液準備 將含有重組質粒的土壤農桿菌菌株接種到含有卡那霉素(50 mg/mL)和利福平抗生素(25 mg/mL)的YEB培養基上,28 ℃暗培養2 d。挑取單菌落于5 mL含有卡那霉素(50 mg/mL)和利福平抗生素(25 mg/mL)的YEB液體培養基中,28 ℃暗環境振蕩48 h。按照1∶50的比例吸取1 mL的菌液至50 mL含有卡那霉素和利福平抗生素的YEB液體培養基中,28 ℃振蕩培養至菌液 OD600=1.8~2.0時,6 000 r/min離心10 min收集菌體。在菌體中加入100 mL浸染緩沖液,振蕩混勻使菌體充分懸浮在緩沖液中。
1.4.3 擬南芥花序浸染 將培養好的野生型擬南芥剪去花序上已結的角果,前一天晚上將野生型擬南芥澆水浸透。次日,將花序浸入提前配好的浸染液中1 min左右,為保持濕度每株擬南芥都套上袋子,置于暗培養箱中培養過夜,再將其置于光照培養箱中正常培養。第1次浸染后的第5天再次對植株進行浸染,共浸染2次。收取種子經過多代抗性篩選直至直系純合,對純合植株進行GUS染色。
1.4.4 GUS染色 用DMSO將X-Gluc配成20 mmol/L的母液,每管50 μL分裝,置于-20 ℃保存備用。然后稱取Na2HPO4·12H2O 17.9 g,NaH2PO4·2H2O 7.8 g,Na2EDTA 3.72 g,鐵氰化鉀0.165 g,亞鐵氰化鉀0.221 g,Trition-100 1 mL配成1 L X-Gluc基液(50 mmol/L PBS pH=7.0)。GUS染色液由50 μL X-Gluc母液和450 μL X-Gluc基液組成。脫色液由冰醋酸和無水乙醇3∶1混合組成。
將準備好的材料于GUS染色液中浸泡,25~37 ℃保溫過夜。所有綠色材料在75%酒精中脫色2~3次,直至陰性對照呈白色。肉眼觀察或顯微鏡下觀察,白色背景上出現藍色小點區域即為GUS的表達位點。利用體視顯微鏡觀察拍照。
2 結果與分析
2.1BnaFIL基因啟動子的克隆與順式作用元件預測
根據數據庫獲得的甘藍型油菜BnaFIL基因的啟動子序列設計特異性引物,以含有全長啟動子序列的質粒為模板經PCR擴增獲得1 326 bp的啟動子序列(圖1)。通過T4連接酶連接并轉化大腸桿菌獲得pT-Promoter克隆載體。對啟動子序列進行比對分析,結果顯示,在早花材料與晚花材料啟動子之間存在SNP位點,1號位點早花材料為A堿基,晚花材料為G堿基,2號位點早花材料為C堿基,晚花材料為T堿基,且其他堿基基本一致(圖2)。利用PlantCARE軟件對啟動序列進行啟動子順式作用元件分析發現,該序列上包含多種順式作用元件(表2),包括參與光響應的部分保守DNA模塊、核心啟動子必備元件TATA-BOX和CAAT-BOX等,大部分元件都位于啟動子1—500 bp(圖2),由此可以推斷,啟動子的主要功能區位于1—500 bp。
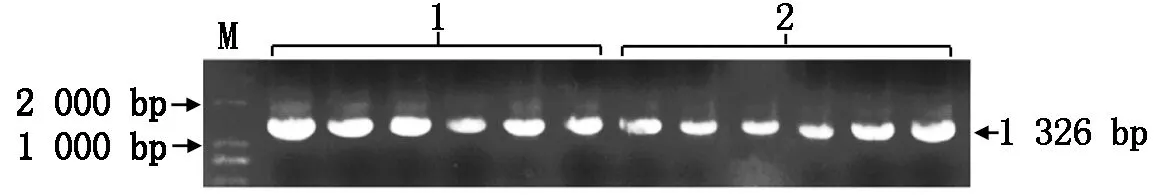
1.晚花材料;2.早花材料;M.DL2000 Marker。圖3同。1.Late flower material;2.Early flower material;M.DL2000 Marker.The same as Fig.3.

1,2.SNP位點。1,2.SNP sites.

表2 啟動子元件Tab.2 Promoter elements
2.2BnaFIL基因啟動子表達載體構建
早花材料與晚花材料經過序列比對和順式作用元件分析,在早花材料和晚花材料中各選取1個材料啟動子序列進行啟動子的表達載體構建。采用表1中含有酶切位點和保護堿基的引物ScaⅠ-P-F/BamHⅠ-P-R對啟動子進行克隆,使擴增得到的片段帶有酶切位點和保護堿基方便后續的酶切,擴增得到的目的條帶為1 344 bp(圖3)。將PCR擴增得到的目的條帶進行膠回收后連接pUCm-T載體,轉化大腸桿菌感受態,經過菌落PCR鑒定獲得陽性菌落,搖菌提質粒,質粒保存備用。
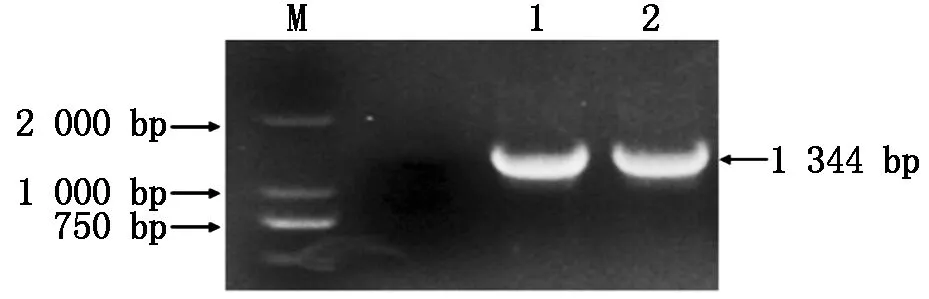
圖3 啟動子擴增Fig.3 Promoter amplification
對啟動子質粒用內切酶FlyCutScaⅠ和FlyCutBamHⅠ進行雙酶切,回收目的片段連接至同樣用內切酶FlyCutScaⅠ和FlyCutBamHⅠ進行雙酶切切除CaMV35S啟動子的pBI121載體(含GUS表達基因)回收的大片段上,經T4連接酶連接轉入大腸桿菌感受態保存(圖4)。從大腸桿菌中提取陽性質粒,經內切酶FlyCutScaⅠ和FlyCutBamHⅠ雙酶切電泳檢測,得到目的片段和pBI121載體片段證明pBnaFIL-pBI121植物表達載體構建成功(圖5)。
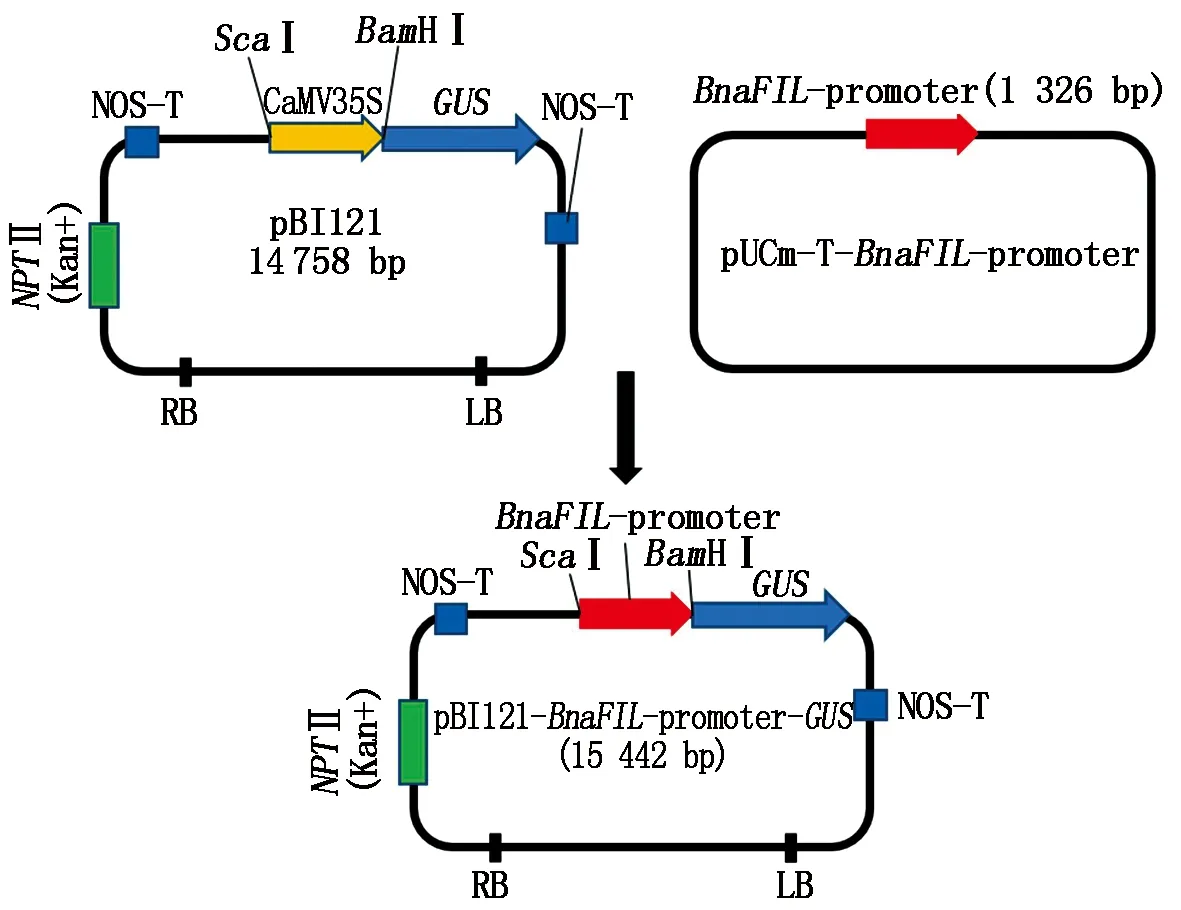
圖4 植物表達載體構建過程Fig.4 Flow chart for construction of the plant expression vector

1.晚花材料重組質粒;2.早花材料重組質粒;M.Trans 5k DNA Marker。1.Recombinant plasmid of late flowering material;2.Recombinant plasmid of early flower material;M.Trans 5k DNA Marker.
將重組質粒轉入農桿菌進行培養,隨機挑選轉入重組質粒的農桿菌單菌落進行菌落PCR鑒定,擴增出一條878 bp的目的條帶(圖6),表明BnaFIL啟動子雙元表達載體成功轉入農桿菌GV3101。
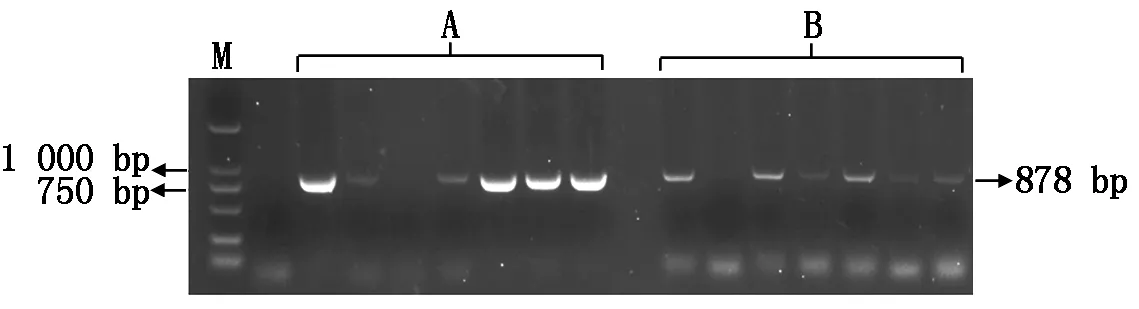
A.轉早花啟動子菌落PCR;B.轉晚花啟動子菌落PCR;M.DL2000 Marker。A.Transforming early flowering promoter colony PCR;B.Transforming late flowering promoter colony PCR;M.DL2000 Marker.
2.3BnaFIL基因啟動子表達分析
將含有重組質粒的土壤農桿菌采用花序浸染法轉化至野生型擬南芥植株中,轉化植株置于植物生長培養箱中正常培養至收獲到T0種子。將T0種子消毒后播撒在含有卡那霉素抗性的1/2 MS培養基上篩選出陽性植株。在篩選過程中陽性幼苗表現為主根和側根均正常生長發育,陰性幼苗表現出發育遲緩且根部無法正常生長,不形成側根。移栽時選取主根和側根生長發育均正常的陽性苗,取幼苗時用鑷子緩緩將幼苗從培養基中拔出,用無菌水清洗幼苗根部的培養基,移入滅菌的人工土,置于植物生長培養箱中正常培養。待T1擬南芥植株長至抽薹時,每株取少量葉片提取擬南芥總DNA鑒定是否為陽性植株。鑒定出3株轉早花重組質粒陽性植株,5株轉晚花重組質粒陽性植株(圖7)。
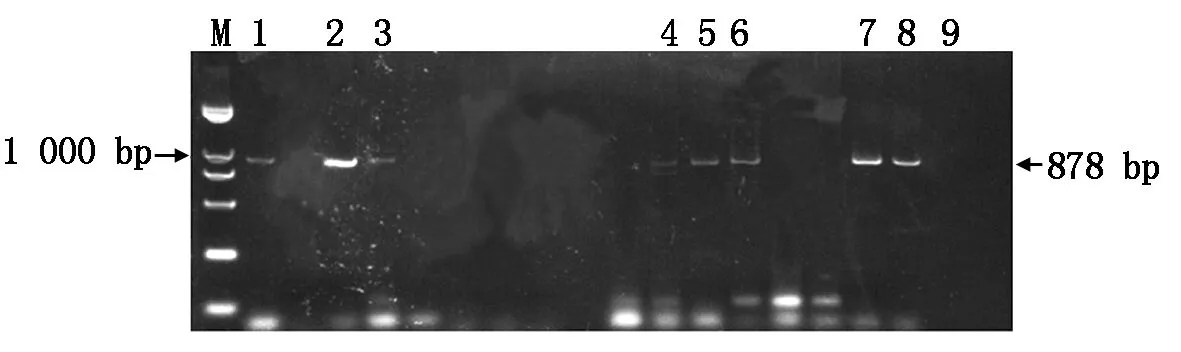
1—3.早花重組質粒抗性苗;4—8.晚花重組質粒抗性苗;9.野生型擬南芥。1—3.Early-flowering recombinant plasmid resistant seedlings;4—8.Late-flowering recombinant plasmid resistant seedlings;9.Wild type Arabidopsis thaliana.
收取T1植株種子,通過上述相同方法對T2植株進行陽性篩選,最終得到T2種子,T2種子采取單株收種。繼續對T2種子進行檢測至株系純合。
將轉基因擬南芥純合株系的種子播種在含有卡那霉素抗性的1/2 MS培養基上,選取長勢良好發育正常的擬南芥幼苗進行GUS染色。染色后發現轉基因擬南芥幼苗GUS基因主要在根莖中表達。含有晚花啟動子重組質粒的擬南芥幼苗GUS基因染色程度較淺,因此,晚花啟動子在苗期表達量較小;含有早花啟動子重組質粒的擬南芥幼苗GUS基因染色程度較深,因此,早花材料啟動子在苗期表達量較大;在野生型擬南芥中GUS基因不表達;pBI121載體轉染的擬南芥GUS基因全株表達(圖8)。
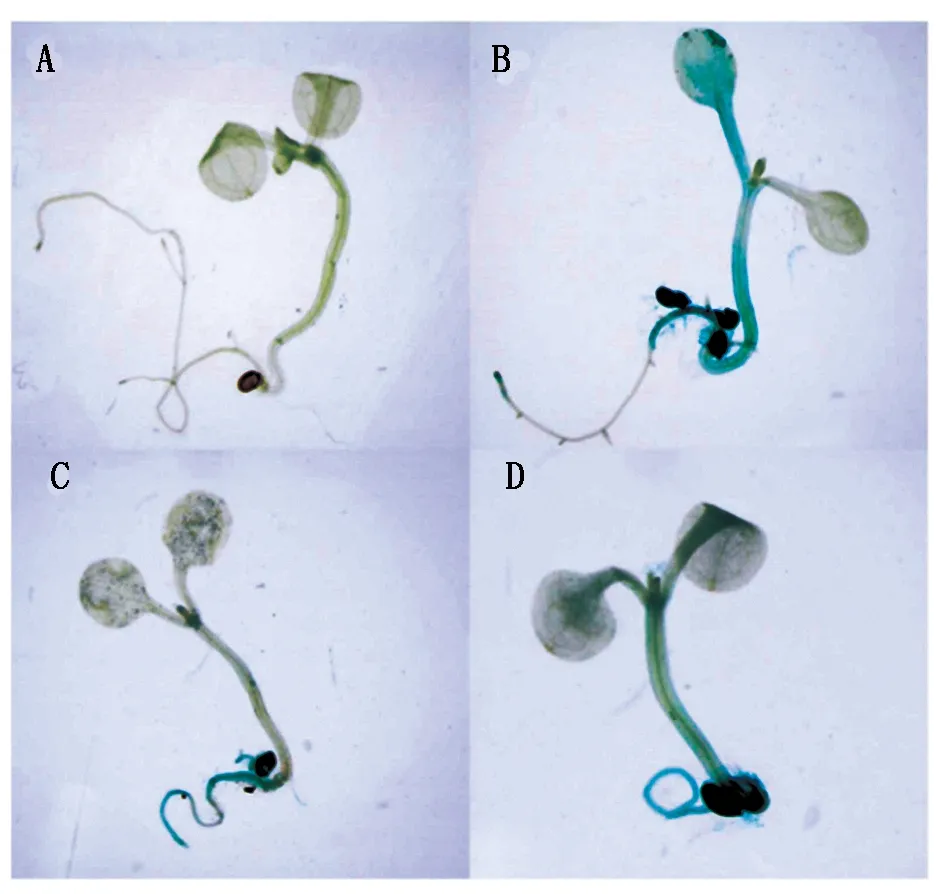
A.野生型擬南芥;B.含pBI121載體擬南芥;C.含晚花啟動子重組質粒的轉基因擬南芥;D.含早花啟動子重組質粒的轉基因擬南芥。
3 結論與討論
在基因表達調控中基因啟動子中的順式作用元件起著重要作用,基因中不同的啟動子特征決定了啟動子驅動基因不同的表達特征[18]。開花對植物而言是生長發育過程中最為重要的階段之一,植物開花也就意味著植物從營養生長向生殖生長過渡[19]。對油菜開花基因的研究能夠更好地了解油菜發育過程,為提高油菜產量提供理論依據。
本研究克隆了BnaFIL基因啟動子序列,并對該序列進行了啟動子順式作用元件分析,結果顯示,在早花材料和晚花材料中啟動子的順式作用元件都相同,但是不同開花時期的材料還是存在SNP位點;啟動子序列中包含了參與光響應的部分保守DNA模塊、核心啟動子必備元件TATA-BOX和CAAT-BOX、與分生組織表達有關的順式作用的調控元件CAT-BOX以及光敏反應元件,由此推斷,該啟動子的表達受光照的影響較大,該啟動子還含有與分生組織表達相關的順式作用元件,也可推測,該啟動子對油菜開花相關的分生組織有相應影響。由于該基因的啟動子反應元件以及SNP位點主要集中在1 300 bp以內,因此,試驗主要以長度為1 300 bp的啟動子進行研究。為了進一步探究BnaFIL基因啟動子序列上的SNP位點是否對BnaFIL基因的驅動有影響,本研究構建了BnaFIL基因啟動子表達載體pBnaFIL-pBI121,鑒定結果表明,表達載體成功轉入土壤農桿菌GV3101,為下一步試驗奠定了良好的基礎。
目前,國內外有關FIL基因對開花時期的研究還較少,但對FIL基因所屬的YABBY家族研究較多。YABBY基因主要調控植物的開花以及側枝發育等[20-22]。本研究通過構建BnaFIL基因啟動子表達載體,將載體通過農桿菌花序浸染的方法成功轉入擬南芥中,獲得了早花啟動子重組質粒陽性轉基因株系和晚花啟動子重組質粒陽性轉基因株系。之后利用GUS基因染色的特性,對啟動子的表達效果進行了檢測,最終在不同的轉基因擬南芥植株中均發現了GUS基因的表達,從而可以斷定早花材料啟動子的驅動基因表達的效果比晚花材料啟動子的驅動效果要好。該結論進一步驗證了早花材料中BnaFIL基因的表達量較晚花材料中BnaFIL基因的表達量更高。由于BnaFIL基因中的SNP位點位于內含子上,內含子不參與蛋白質的編碼,因此,對該基因啟動子上的SNP進行研究,且結果顯示早花材料與晚花材料中啟動子的表達效果存在一定差異,由此推斷,該基因在不同材料中的表達可能是由于啟動子的驅動效果決定的,從而對油菜開花早晚進行調控。

