早期動脈粥樣硬化中炎癥細胞的分布情況
王 隱,趙庭瑞,鄒 瑤,于 超,王婷婷
(重慶醫科大學藥學院,重慶 400016)
根據《中國心血管健康與疾病報告2019概要》,我國現患心血管病的人數約有3.30億,患病率及死亡率仍處于上升階段;同時,無論在農村還是城市,其死亡率都居于首位,高于腫瘤和其他疾病[1]。心血管疾病的根本病因是動脈粥樣硬化,動脈粥樣硬化是一種全身慢性炎癥性疾病,其發病機制非常復雜,與炎癥、高脂血癥及血流動力學改變等密切相關[2]。目前的研究表明[3],免疫系統在動脈粥樣硬化的發生和發展中起關鍵性作用。在疾病發展的過程中,攜帶膽固醇的低密度脂蛋白觸發炎癥反應,引起T細胞活化和抗體產生等,將免疫細胞轉化為促炎或抗炎的表型,并引導不同免疫細胞之間的相互作用,最終影響斑塊的穩定性,并引起臨床癥狀,如心肌梗塞和中風。
在動脈粥樣硬化發生、發展過程中,局部微環境會發生一系列復雜的變化,并伴有多種免疫細胞的浸潤[4]。免疫系統包括固有免疫系統和適應性免疫系統,固有免疫細胞包括中性粒細胞、單核巨/噬細胞、自然殺傷細胞、肥大細胞等,適應性免疫細胞主要包括T淋巴細胞和B淋巴細胞。Th17細胞作為CD4+T細胞的亞群之一,在類風濕關節炎等多個炎性疾病中可以分泌IL-17等細胞因子發揮重要作用[5],Tc17細胞作為CD8+T細胞的亞群之一,也有相同作用。在動脈粥樣硬化發生發展過程中,眾多免疫細胞涉及其中,這些細胞的生成、成熟及分裂分化等生命過程發生在不同的組織器官,不同階段的細胞在疾病進程中有不同的功能,因此了解細胞在動脈粥樣硬化小鼠全身免疫系統微環境中的分布至關重要。目前關于免疫應答在動脈粥樣硬化中的作用研究主要集中于研究各種免疫細胞在動脈粥樣硬化中晚期的作用[6],而在對早期動脈粥樣硬化中除巨噬細胞外的其他炎性細胞浸潤情況研究較少。因此,本研究運用高脂飼料喂養ApoE-/-小鼠,構建早期動脈粥樣硬化模型,檢測早期動脈粥樣硬化小鼠的主動脈、外周血、脾臟和骨髓中各種免疫細胞的浸潤情況及表型,以期闡明早期動脈粥樣硬化中主要的固有免疫細胞和適應性免疫細胞的分布情況。
1 材料與方法
1.1 研究對象高脂飲食(含0.15%的膽固醇,MD12015,購自江蘇美迪森生物醫藥有限公司)喂養4周的雄性ApoE-/-小鼠(6只,6w,C57BL/6背景,購自北京華阜康生物科技有限公司,北京市實驗動物質量合格證許可證號SCXK(京)2014-0004)作為實驗組,正常飲食(購自重慶騰鑫生物技術有限公司)喂養4周的同等大小的雄性C57BL/6小鼠[6只,從重慶醫科大學動物中心獲得,實驗動物生產許可證SCXK(渝)2018-0003]作為對照組。所有小鼠都是在特定的無病原體條件(IVC環境)下飼養。所有動物實驗均由重慶醫科大學動物倫理與實驗委員會審核批準。
1.2 實驗材料實驗試劑:抗小鼠CD45抗體(103114;103155)、Ly6G抗體(127605)、CD11b抗體(101225)、CD117抗體(105823)、FcεRIα抗體(134307)、NK1.1抗體(108736)、F4/80抗體(123108)、CD80抗體(104714)、CD3抗體(100222)、CD4抗體(100433)、CD8抗體(140416)購自美國Biolegend公司,抗小鼠CD163抗體(2006514)、IL-17A抗體(2142931)購自美國invitrogen公司,膠原酶Is(C1639),膠原酶XI(C5138),Ⅰ型DNA酶(10104159001)和透明質酸酶(H3506-100MG)購自美國Sigma-Aldrich公司,紅細胞裂解液(RT122-02)購自天根生化科技(北京)有限公司,中性樹脂(1118D021)、飽和油紅O染液(G1260)及Masson三色染色試劑盒(G1340)購自北京索萊寶科技有限公司,蘇木精(ZLI9610)購自北京中杉金橋生物技術有限公司,Fixation/Permeabilization Kit(554714)購自美國BD公司,cell activation cocktail (with Brefeldin A,423303)購自美國Biolegend公司,RPMI1640培養基(21870076)購自美國Gibco公司,組織固定液(含1%DEPC,AR1069)購自武漢博士德生物工程有限公司,胎牛血清(A6500-3011)購自德國Cegrogen公司,異戊巴比妥鈉(Phenobarbital Sodium Salt,57-33-0)購自北京Notlas公司,PBS磷酸鹽粉劑(B040100-0005)購自生工生物工程有限公司,肝素鈉鹽(A603251-1001)購自生工生物工程有限公司,低密度脂蛋白膽固醇(LDL-C)測定試劑盒(0302105-000464-00)、高密度脂蛋白膽固醇(HDL-C)測定試劑盒(0302105-000463-00)、總膽固醇(TC)測定試劑盒(0302105-000448-00)、甘油三酯(TG)測定試劑盒(0302105-000449-00)均購自深圳邁瑞生物醫療電子股份有限公司。
實驗儀器:流式細胞儀(Cytoflex S,美國BECKMAN COULTER公司),光學顯微鏡(718026,日本Nikon公司),生化分析儀(BS-220,深圳邁瑞生物醫療電子股份有限公司),純水儀(F0MB10660,美國Millipore公司),低溫離心機(Microfuge 20R,美國BECKMAN COULTER公司)。
1.3 組織樣本處理將ApoE-/-和C57小鼠用200 μL異戊巴比妥鈉(3.75 g·L-1)腹腔麻醉后,用含肝素鈉的聚丙乙烯管采集小鼠眼眶血并處死。心臟穿刺,用無菌2% PBS-肝素鈉溶液完全灌注,沖洗心臟及所有血管中的血液。切除心臟并用組織固定液固定。收集脾臟、主動脈(包括胸主動脈和腹主動脈)、股骨和脛骨于無菌PBS溶液中。將主動脈剪成小塊,轉移至酶混合物工作液(包含各25 μL 450 kU·L-1的膠原酶Is、125 kU·L-1的膠原酶XI、60 kU·L-1的Ⅰ型DNA酶和60 kU·L-1的透明質酸酶的預冷PBS溶液)中,37 ℃下消化1 h[7];從股骨和脛骨收集骨髓。消化后的主動脈、骨髓以及脾臟分別經研磨棒和200目鋼網加工制成單細胞懸液,便于后續流式細胞染色。離心外周血,2 000 r·min-1,5 min,取上層血清用于血脂水平檢測,下層血細胞則用于流式細胞染色。將心臟進行石蠟包埋或冰凍制成切片,厚約7 μm。
1.4 血脂水平檢測使用生化分析儀和相應的檢測試劑盒測定小鼠血清血脂水平,包括總膽固醇、總甘油三酯、低密度脂蛋白-膽固醇和高密度脂蛋白-膽固醇。
1.5 流式細胞染色及分析細胞表面分子流式染色:分別用PE/Cy7標記的CD45抗體,FITC標記的Ly6G抗體,APC/Cy7標記的CD11b抗體,Percp/Cy5.5標記的CD117抗體,PE標記的FcεRIα抗體,BV650標記的NK1.1抗體,FITC標記的F4/80抗體,APC標記的CD80抗體,PE標記的CD163抗體標記主動脈、脾臟和骨髓組織單細胞懸液以及新鮮外周血細胞中的中性粒細胞CD45+(Ly6G+CD11b+)、肥大細胞CD45+(CD117+FcεRIα+)、自然殺傷細胞(CD45+NK1.1+)、巨噬細胞(CD45+F4/80+)、M1型巨噬細胞(CD45+F4/80+CD80+)及M2型巨噬細胞(CD45+F4/80+CD163+),4 ℃放置30 min后,100 μL staining buffer(含1%FBS的PBS溶液)洗滌1次,1 800 r·min-1離心5 min,50 μL胎牛血清封閉30 min;100 μL staining buffer洗滌1次,1 800 r·min-1,離心5 min;100 μL組織固定液(含1% DEPC)固定,4 ℃,20 min;100 μL staining buffer洗滌1次,1 800 r·min-1離心5 min;棄上清,150 μL PBS溶液重懸細胞,待上機;外周血染色后需先裂解其中紅細胞再進行固定。細胞內因子染色:將主動脈、脾臟和骨髓組織單細胞懸液以及新鮮外周血細胞用cell activation cocktail (with Brefeldin A)刺激6 h,用BV605標記的CD45抗體,APC/Cy7標記的CD3抗體,BV650標記的γδ TCR抗體和PE/Cy7標記的CD8抗體分別標記不同組織器官中的T細胞(CD45+CD3+),CD4+T細胞(CD45+CD3+CD8-γδ T-)和CD8+T細胞(CD45+CD3+CD8+γδ T-),4 ℃放置30 min后,100 μL staining buffer洗滌1次,1 800 r·min-1離心5 min,50 μL胎牛血清封閉30 min;100 μL staining buffer洗滌1次,1 800 r·min-1,離心5 min;Fixation and Permeabiliation solutionn固定通透20 min,100 μL wash buffer (1×Perm/Wash solution)洗滌1次,1 800 r·min-1離心5 min,APC標記的IL-17A抗體標記CD4+T細胞和CD8+T細胞分泌的IL-17,4 ℃放置30 min后,100 μL wash buffer洗滌1次,1 800 r·min-1離心5 min;棄上清,150 μL PBS 溶液重懸細胞。流式細胞儀檢測分析各樣本中免疫細胞的比例。流式門控策略如Fig 1所示。
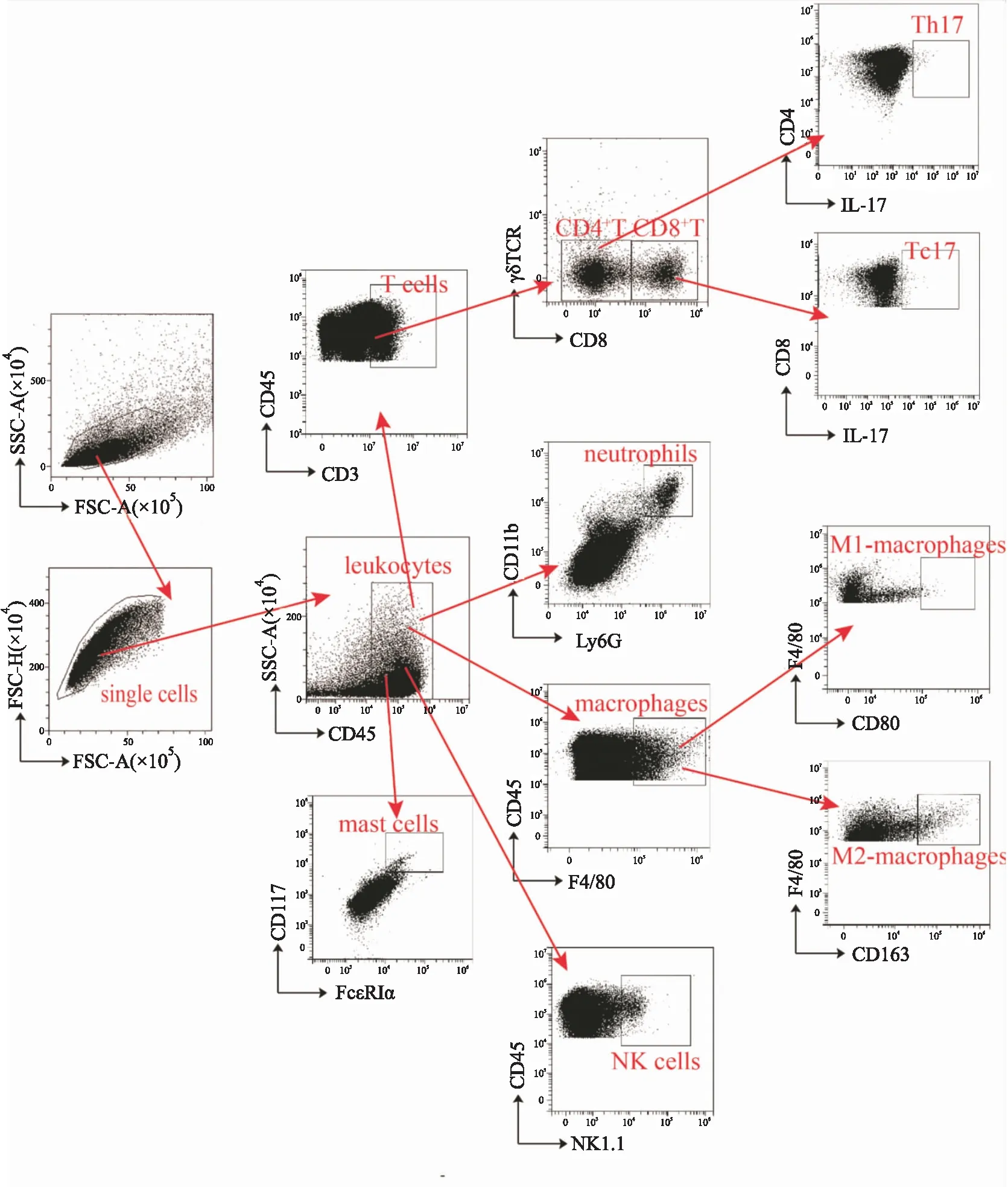
Fig 1 Gating strategy of flow cytometry
1.6 組織切片染色心臟冰凍切片油紅O染色:室溫復溫30 min,油紅O染色工作液(油紅0染料 ∶超純水=3 ∶2,體積比),37 ℃,30 min。棄去染液,超純水洗去多余染液;60%異丙醇脫色30 s,超純水終止分化;蘇木精染液復染細胞核1 min,超純水返藍;中性樹脂封片,光學顯微鏡下觀察染色結果。心臟石蠟切片Masson染色:二甲苯脫蠟2次,每次10 min,酒精梯度水化各5 min,Weigert鐵蘇木精染色液染色5~10 min,酸性乙醇分化液分化5~15 s,水洗,Masson藍化液返藍3~5 min,水洗,純水洗1 min,麗春紅品紅染色液染色5~10 min,弱酸工作液(純水 ∶弱酸溶液=2 ∶1),磷鉬酸溶液洗1~2 min,用配置好的弱酸工作液洗1 min,直接入苯胺藍染色液中染色1~2 min,弱酸工作液洗1 min,95%乙醇快速脫水,無水乙醇脫水3次,二甲苯透明3次,中性樹膠封固,光學顯微鏡下觀察染色結果。

2 結果
2.1 早期動脈粥樣硬化小鼠模型的構建及評價通過高脂飼料喂養ApoE-/-小鼠4周,建立早期動脈粥樣硬化小鼠模型,在血管部位有粥樣斑塊合并病變,管腔輕度梗阻,血管平滑肌細胞無明顯遷移或受累[8]。油紅O染色顯示,與C57小鼠相比,ApoE-/-小鼠主動脈根部斑塊面積明顯增加(Fig 2A,2B);而膠原纖維含量(Fig 2C,2D)沒有差異。運用生化分析儀檢測小鼠血脂水平發現,ApoE-/-小鼠的血脂(包括總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C)和高密度脂蛋白膽固醇(HDL-C)明顯高于C57小鼠(Fig 2E)。以上結果表明動脈粥樣硬化小鼠模型構建成功。

Fig 2 Validation of a mouse model of atherosclerosisA, B:Comparison of Oil red O staining and plaque area size in mouse aortic root. C, D:Masson′s staining and collagen content quantification in mouse aortic root. E:Serum lipid levels of n=6). *P<0.05, **P<0.01 vs C57.
2.2 早期動脈粥樣硬化小鼠主動脈中浸潤的免疫細胞的檢測及分析收集小鼠整條主動脈,制成單細胞懸液,運用流式細胞術檢測其中炎性細胞浸潤情況。結果顯示:ApoE-/-小鼠主動脈中浸潤的中性粒細胞、肥大細胞、自然殺傷細胞、巨噬細胞的比例均明顯高于C57小鼠;進一步分析巨噬細胞的表型發現,具有促炎作用的M1型巨噬細胞在ApoE-/-小鼠主動脈中浸潤明顯增加;而具有抗炎作用的M2型巨噬細胞的比例無明顯變化(Fig 3A,3B)。進一步分析T細胞及其亞型發現,ApoE-/-小鼠主動脈中浸潤的CD3+T細胞(Fig 3C,3D)、IL-17+CD4+T細胞(Th17細胞)(Fig 3E,3F)及IL-17+CD8+T細胞(Tc17細胞)(Fig 3G,3H)的比例均較C57小鼠主動脈中明顯升高。以上結果說明在早期動脈粥樣硬化小鼠的主動脈中,不管是固有免疫細胞還是適應性免疫細胞,均有不同程度的浸潤增加。提示免疫細胞在早期動脈粥樣硬化斑塊中發揮潛在作用。
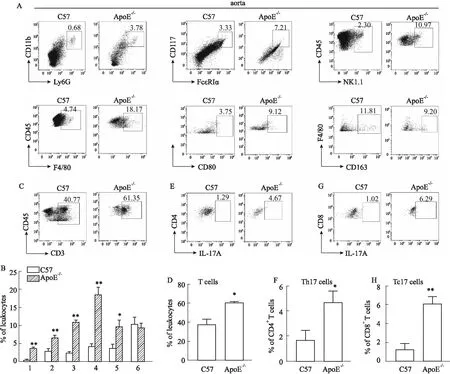
Fig 3 Infiltrating immune cells and phenotypes in aorta of mice with early atherosclerosisDetection and quantification of innate immune cells (A, B), T cells (C, D), Th17 cells (E, F) and Tc17 cells (G, H) in aorta. n=6). 1:neutrophils;2:mast cells;3:NK cells;4:macrophages;5:M1-macrophages;6:M2-macrophages.*P<0.05, **P<0.01 vs C57.
2.3 早期動脈粥樣硬化小鼠外周血中免疫細胞的檢測及分析血液在心臟和血管腔循環流動,可以參與運輸、防御、調節人體滲透壓等過程。血液中的白細胞豐富,既可以殺滅細菌、病毒等病原體,也參與形成慢性疾病的炎性狀態。對ApoE-/-小鼠和C57小鼠外周血進行流式染色,結果發現:ApoE-/-小鼠外周血中性粒細胞、肥大細胞、自然殺傷細胞和單核細胞的比例與C57小鼠相比,均有升高趨勢,其中肥大細胞和自然殺傷細胞比例顯著升高(Fig 4A,4B);進一步分析單核細胞表型,結果顯示ApoE-/-小鼠外周血中M1樣單核細胞比例有升高趨勢,M2樣單核細胞比例有下降趨勢。小鼠外周血T細胞及表型分析顯示:ApoE-/-小鼠外周血中中T細胞和Th17細胞的比例顯著增加,而Tc17細胞也呈現增加的趨勢(Fig 4C-H)。
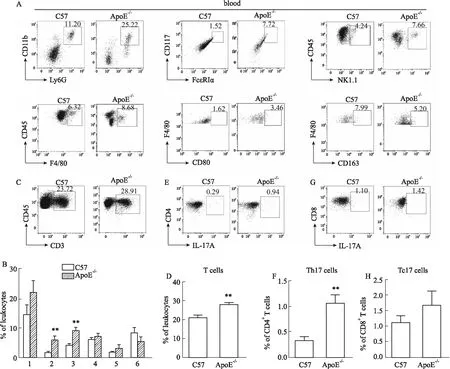
Fig 4 Immune cells and phenotypes in peripheral blood of mice with early atherosclerosisDetection and quantification of innate immune cells (A, B), T cells (C, D), Th17 cells (E, F) and Tc17 cells (G, H) in blood. n=6).1:neutrophils;2:mast cells;3:NK cells;4:monocytes;5:M1-monocytes;6:M2-monocytes. **P<0.01 vs C57.
2.4 早期動脈粥樣硬化小鼠脾臟中浸潤的免疫細胞的檢測及分析脾臟作為次級淋巴器官,其白髓由密集的淋巴細胞組成,是機體發生特異性免疫應答的主要場所;紅髓是免疫細胞發生吞噬作用的主要場所;邊緣區有較多巨噬細胞,是脾內捕獲、識別抗原,誘發免疫應答的重要部位,因此脾臟是動脈粥樣硬化病變炎性細胞的重要應答器官。對ApoE-/-小鼠和C57小鼠脾臟單細胞懸液的流式結果分析發現:小鼠脾臟中浸潤的中性粒細胞、肥大細胞和巨噬細胞比例在兩組小鼠中無差異;而ApoE-/-小鼠脾臟中自然殺傷細胞和M1型巨噬細胞比例明顯高于C57小鼠中(Fig 5A,5B)。T細胞的分析結果顯示:ApoE-/-小鼠脾臟中浸潤的T細胞(Fig 5C,5D)和Th17細胞(Fig 5E,5F)比例有上升趨勢,Tc17細胞(Fig 5G,5H)比例明顯增加。

Fig 5 Immune cells and phenotypes in spleen of mice with early atherosclerosisDetection and quantification of innate immune cells (A, B), T cells (C, D), Th17 cells (E, F) and Tc17 cells (G, H) in spleen. n=6).1:neutrophils;2:mast cells;3:NK cells;4:macrophages;5:M1-macrophages;6:M2-macrophages. *P<0.05, **P<0.01 vs C57.
2.5 早期動脈粥樣硬化小鼠骨髓中浸潤的免疫細胞的檢測及分析骨髓是免疫細胞的生成器官,紅骨髓除了具有活躍的造血功能外,還具有防御、免疫、創傷修復等功能。骨髓細胞成分復雜,包括各種血細胞系的不同發育階段的細胞,如占40%~60%的粒細胞系,約20%的巨核細胞系等。在對ApoE-/-小鼠和C57小鼠骨髓單細胞懸液的流式結果分析發現:ApoE-/-小鼠和C57小鼠骨髓中生成的中性粒細胞和單核細胞比例無明顯差異;雖然ApoE-/-小鼠骨髓中肥大細胞和自然殺傷細胞比例明顯高于C57小鼠,但總體比例偏低(Fig 6A,6B)。兩組小鼠間T細胞、Th17細胞和Tc17細胞比例均無統計學差異(Fig 6C-H)。

Fig 6 Immune cells and phenotypes in bone marrow of mice with early atherosclerosisDetection and quantification of innate immune cells (A, B), T cells (C, D), Th17 cells (E, F) and Tc17 cells (G, H) in bone marrow. n=6). 1:neutrophils;2:mast cells;3:NK cells;4:monocytes;5:M1-monocytes;6:M2-monocytes. **P<0.01 vs C57.
3 討論
本研究通過流式細胞術檢測分析發現,在早期動脈粥樣硬化小鼠的主動脈和外周血中,除了單核/巨噬細胞的浸潤增加,其他固有免疫細胞包括中性粒細胞、肥大細胞和自然殺傷細胞等的比例也有顯著增加的趨勢;進一步分析單核/巨噬細胞的表型發現,主動脈和外周血中的單核/巨噬細胞以發揮促炎作用的M1型表型為主;而在發生適應性免疫應答的脾臟中,固有免疫細胞的數量較少且在動脈粥樣硬化小鼠和正常小鼠中無差異;此外,在免疫細胞的生成器官骨髓中,固有免疫細胞的比例在兩組小鼠中也無差異。并且在早期動脈粥樣硬化小鼠中,部分適應性細胞——T細胞、Th17細胞和Tc17細胞在主動脈、外周血和脾臟的比例明顯增加,而在骨髓中的比例無顯著變化。以上結果表明,在動脈粥樣硬化發生的早期,動脈壁的脂質沉積主要促進了固有免疫細胞的募集和促炎作用的增強,而并未影響其在骨髓中的生成。在脂蛋白相關抗原及固有免疫細胞的共同作用下,適應性免疫系統中的T細胞活化并增殖,進一步促進了血管壁炎性微環境的形成。
動脈粥樣硬化是一種由富含膽固醇的巨噬細胞在大中動脈壁異常積聚,導致的脂質代謝異常和先天性和適應性免疫對修飾性脂蛋白和受損血管壁成分的免疫反應引起的復雜慢性炎性疾病。在動脈粥樣硬化發生、發展過程中,多種免疫細胞的浸潤局部微環境[4]。斑塊中免疫細胞的浸潤往往預示著其在其他組織器官的浸潤情況同樣發生了變化。目前的研究表明,免疫細胞在動脈粥樣硬化中的作用各異。在患有高脂血癥和動脈粥樣硬化的患者以及動脈粥樣硬化的實驗動物模型中發現循環單核細胞數量增加,并且與斑塊大小和斑塊分期相關[9]。單核細胞一旦滲入動脈壁,它們就會分化為巨噬細胞,巨噬細胞被認為在動脈粥樣硬化的發生、發展中發揮著關鍵作用。在動脈粥樣硬化患者破裂的斑塊和小鼠動脈粥樣硬化模型中,都發現了大量巨噬細胞浸潤[10]。在動脈粥樣硬化斑塊局部多種促炎因子和抗炎因子的作用下,巨噬細胞的抗炎和促炎表型也處于不斷的動態變化中[10]。在促炎細胞因子如IFN-γ、LPS等的作用下,巨噬細胞表現為促炎的M1表型,釋放大量炎性介質如IL-1β、IL-6、TNF-α等,維持血管的慢性炎癥狀態進而促進動脈粥樣硬化進展。而在IL-4、IL-13等抗炎細胞因子的作用下,巨噬細胞表現為抗炎的 M2 表型,通過釋放IL-10、TGF-β等免疫抑制分子,促進局部炎癥的消退和組織的修復,從而發揮保護作用。巨噬細胞除了分泌細胞因子,還表達多種趨化因子,巨噬源性的CCL3和血小板來源的CCL5等趨化因子可以參與中性粒細胞的募集[11],募集而來的中性粒細胞不僅可以參與炎癥細胞組織重塑,還能促進其他白細胞進入血管外組織的炎癥部位。除此之外,在炎性環境下,中性粒細胞還具有抗原呈遞細胞特性。在類風濕性關節炎患者中,中性粒細胞表面的MHC Ⅱ類分子表達上升并增加其抗原呈遞能力,導致T淋巴細胞激活[12]。固有免疫細胞除了中性粒細胞、單核/巨噬細胞,還包括自然殺傷細胞、肥大細胞等。肥大細胞是存在于黏膜和結締組織中的多能白細胞,人冠狀動脈病理學研究表明,肥大細胞不僅存在于動脈粥樣硬化斑塊中,且與非破裂的斑塊相比,其數量在破裂的斑塊中明顯升高,影響纖維帽的穩定性[13]。早期研究發現,在動脈粥樣硬化斑塊中有大顆粒狀的淋巴細胞(自然殺傷細胞)浸潤,當小鼠體內CD47缺乏,可引起自然殺傷細胞、T細胞等細胞的激活,增加斑塊形成,從而加劇動脈粥樣硬化[14]。因此,動脈粥樣硬化過程中涉及的固有免疫細胞及其作用的多樣性表明了動脈粥樣硬化研究的復雜性及必要性。
適應性免疫細胞,主要包括T細胞、B細胞,也是免疫細胞的組成部分。較多研究已證明活化的T細胞在動脈粥樣硬化斑塊中持續存在,CD4+T細胞和CD8+T細胞分別被MHC Ⅱ類分子和MHC Ⅰ類分子提呈的抗原激活,會分化為功能不同的輔助T細胞亞型-Th1細胞、Th2細胞、Th17細胞、調節性T細胞(Treg)、濾泡輔助T細胞(Tfh)以及殺傷T細胞亞型-Tc1細胞、Tc2細胞、Tc17細胞等。動脈粥樣硬化是一種已知的Th1性疾病。斑塊中的許多CD4+T細胞會表達與Th1細胞相關的促炎細胞因子γ-干擾素(IFN-γ)、IL-2、IL-3、TNF-α等,這些細胞因子可以激活巨噬細胞、T細胞和其他細胞因子,從而加劇炎癥反應[15]。此外,在動脈粥樣硬化斑塊中,相當大比例的T細胞表達Th2相關細胞因子IL-4、IL-5和IL-13。在一項研究中,Th2細胞相關細胞因子IL-4拮抗Th1反應并減少了病灶的形成,而據報道耗竭IL-4對動脈粥樣硬化具有保護作用[16]。同樣,Th17細胞在動脈粥樣硬化中的作用也存在爭議:Th17細胞的主要細胞因子IL-17作用于血管內皮細胞、平滑肌細胞、巨噬細胞等,誘導促炎因子如IL-6、粒細胞集落刺激因子(GM-CSF)和趨化因子如CCL2、CXCL1、CXCL8、CXCL10分泌增加,募集中性粒細胞和單核細胞等到達斑塊部位,影響斑塊的穩定性并增大血管壁損傷范圍[17];而其他研究則報道,IL-17通過抑制IFN-γ和血管內皮細胞黏附分子1(VCAM-1)等的產生,減少單核細胞和T細胞在損傷部位的聚集,并誘導血管平滑肌細胞產生Ⅰ型膠原等,從而控制損傷的發展并維持斑塊的穩定性[18]。IL-17來源于多種免疫細胞,其中包括Th17細胞和Tc17細胞。這些研究中不同的發現反映了不同T細胞亞群在動脈粥樣硬化中有迥異作用。
免疫應答在動脈粥樣硬化發生、發展的各個階段都發揮重要作用。但目前各種免疫細胞在中晚期動脈粥樣硬化階段的作用研究較為全面[6],本研究系統地闡明了多種免疫細胞在早期動脈粥樣硬化中的分布情況,對深入了解動脈粥樣硬化發生發展的免疫學機制奠定了基礎;在全面而細致地研究動脈粥樣硬化炎性微環境形成的機制及具體的作用機制方面具有重要意義。

