MANF對內質網應激誘導小腸上皮細胞損傷的保護作用
陳 瀅,周 南,王 杰,倪倩倩,趙 倩
(1. 安徽醫科大學護理學院;2.安徽醫科大學基礎醫學院;3. 中國科學技術大學附屬第一醫院產科; 4. 安徽醫科大學第一附屬醫院新生兒科,安徽 合肥 230032)
內質網(endoplasmic reticulum, ER)是蛋白質折疊、翻譯后修飾以及分泌性蛋白和膜蛋白轉運的場所。環境和/或宿主的諸多因素可以造成ER應激,繼而觸發未折疊蛋白反應(unfolded protein reponse, UPR)[1]。此時細胞會產生一系列的保護反應,通過抑制蛋白的翻譯、降解錯誤折疊蛋白以及促進錯誤蛋白的重新折疊,從而恢復ER的穩態。但如果錯誤折疊蛋白超出了ER的清除能力,便會誘發持續的ER應激,導致細胞凋亡,甚至細胞死亡[2]。
腸黏膜屏障是機體抵擋外來侵襲的一道重要防線。由于各種急慢性刺激,如病原菌入侵、缺血再灌注、膳食代謝物和毒素的影響等,均可導致腸上皮屏障的損傷,造成腸源性感染誘發腸道炎癥,繼而引起腸上皮細胞凋亡或壞死,甚至發展為全身炎癥反應綜合征,直至患者死亡[2]。研究表明,多種細胞因子及其介導的信號傳導途徑參與腸道炎癥的發生和發展。其中,杯狀細胞、潘氏細胞等具有強大分泌功能的腸上皮細胞,其蛋白質合成和加工的負荷較重,對ER應激尤為敏感。近年來的研究表明,ER應激參與腸上皮屏障功能的調節,是腸道炎癥發生的重要發病機制之一[5-6]。
中腦星形膠質細胞源性神經營養因子(mesencephalic astrocyte-derived neurotrophic factor, MANF)是一個高度保守的可溶性蛋白,分子量約為18 ku。運用微陣列技術篩選與ER應激相關的基因發現,MANF是對ER應激最為敏感的基因[7]。之后,多項研究均證明MANF在ER應激相關疾病中具有明確的保護作用[8-12]。腦缺血可觸發ER應激并增強MANF的表達,重組人MANF可促進神經元的增殖,防止神經元凋亡[8-9]。ER應激相關蛋白在胰腺細胞特異性MANF缺陷小鼠中表達上調,重組MANF能促進胰腺β細胞的增殖,可能成為糖尿病再生治療的潛在靶點[10]。此外,我們前期的研究還表明,炎癥可以觸發ER應激,促進MANF定位于細胞核,干擾p65與其靶基因啟動子結合,抑制NF-κB通路激活,從而抑制炎性滑膜細胞增殖[11]。MANF還可以通過抑制NF-κB/Snail信號通路,在肝臟ER應激與炎癥的關系中發揮重要作用,可能是肝癌的潛在治療靶點[12]。
但是MANF在腸道炎癥中的作用尚無報道。由于MANF與ER應激密切相關,且ER應激是腸道炎癥發生發展的重要分子機制之一。本實驗擬在正常人小腸上皮細胞系FHs 74 Int中過表達MANF,并用ER應激誘導劑TM或TNF-α刺激,探究MANF對ER應激誘導的腸道上皮細胞損傷的保護作用。
1 材料與方法
1.1 材料
1.1.1細胞株及質粒 細胞系FHs 74 Int購自北納生物公司;pEGFP-C2-MANF質粒為安徽醫科大學沈玉先教授課題組惠贈;pEGFP-C2載體質粒為本課題組保存。
1.1.2試劑 轉染試劑Lipofectamine 2000、ECL發光液(美國Thermo Fisher Scientific公司);DMEM培養基(美國HyClone公司);Tunicamycin(上海生工);TNF-α(美國MCE公司);MANF、cleaved caspase-3、CHOP、Bip、β-actin抗體(英國Abcam公司);Bcl-2、Bax抗體(中國proteintech公司);CCK8試劑盒(上海碧云天);PE Annexin Ⅴ凋亡檢測試劑盒 (美國BD公司)。
1.1.3儀器 超凈工作臺(江蘇蘇靜集團);電泳儀、凝膠成像系統(美國BIO-RAD公司);CytoFLEX分析流式細胞儀(美國Beckman Coulter公司)
1.2 方法
1.2.1MANF過表達正常人小腸上皮細胞FHs 74 Int細胞 參照Lipofectamine 2000說明書將MANF-GFP質粒轉染FHs 74 Int細胞,同步轉染空載體GFP為對照。轉染24 h后熒光顯微鏡觀察各組轉染效率。
1.2.2免疫印跡法(Western blot) 用裂解液裂解細胞,提取總蛋白,金屬浴煮沸樣品10 min,上樣15 μL至SDS-PAGE膠電泳,槽式濕轉法轉移蛋白至NC膜,封閉緩沖液封閉1 h后分別用MANF、Bip、CHOP、cleaved-caspase-3、β-actin等抗體于4 ℃冰箱過夜,二抗在室溫條件下孵育1 h后蛋白顯影。
1.2.3CCK8檢測細胞增殖 將FHs 74 Int細胞按相應組別接種于96孔培養板中,按說明書加入CCK8溶液,孵育1 h,上機測定OD值。
1.2.4流式細胞術(flow cytometry)檢測細胞凋亡 分別收集相應組別的FHs 74 Int細胞。以1 000 r·min-1轉速收集細胞沉淀,PBS清洗2遍。將10×Binding buffer用雙蒸水稀釋成1×Binding buffer,用1×Binding buffer將FHs 74 Int細胞重懸為1×109L-1細胞懸液。吸取100 μL加入流式管中,按照說明書添加5 μL的PE Annexin Ⅴ和7-AAD至各組樣品管,用移液器充分混勻后,室溫避光孵育15 min,上機前補加400 μL 1×Binding buffer用于檢測。

2 結果
2.1 ER應激可誘導小腸上皮細胞內MANF表達增多在正常人小上皮細胞FHs 74 Int細胞培養基中給予ER應激誘導劑TM (2 mg·L-1) 或TNF-α (0.785 μg·L-1)刺激后,MANF分別從加藥后3 h(Fig 1)和9 h(Fig 2)開始表達增多,并呈時間依賴關系。提示腸上皮細胞內發生ER應激的早期即可以誘導MANF的表達。

Fig 1 TM induced MANF expression in intestinal A: MANF protein levels at indicated time points were assessed by Western blot; B: The gray value was detected for A, *P<0.05, **P<0.01 vs 0 h.

Fig 2 TNF-α induced MANF expression in intestinal A: MANF protein levels at indicated time points were assessed by Western blot; B: The gray value was detected for A, **P<0.01 vs 0 h.
2.2 MANF抑制小腸上皮細胞內的ER應激分別將MANF-GFP與空載體GFP質粒轉染FHs 74 Int細胞,觀察到綠色熒光,提示外源性MANF在小腸上皮細胞中成功表達(Fig 3)。轉染后16 h,用TM刺激細胞24 h后觀察ER應激指標。結果顯示,過表達MANF可以減少TM刺激后的ER應激相關蛋白Bip、CHOP的表達(Fig 4),提示MANF具有抑制ER應激的作用。
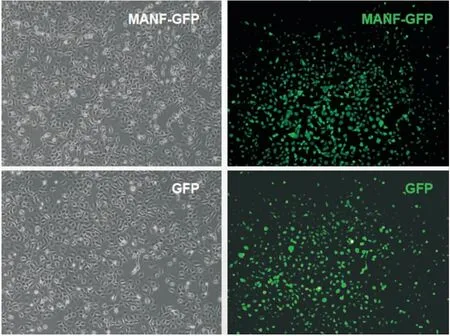
Fig 3 Successful expression of exogenous MANF in intestinal epithelial cells Cell status was observed under a microscope (Left panel), and the expression of green fluorescent protein was observed under a fluorescence microscope (right panel) (magnification 200×).

Fig 4 MANF protected intestinal epithelial cells A: ER stress related proteins were detected via Western blot; B: The gray value was detected for A, **P<0.01 vs GFP+TM.
2.3 MANF促進腸上皮細胞增殖用TM誘導腸上皮細胞發生ER應激后,CCK8細胞增殖實驗發現細胞增殖能力減弱,并呈現劑量依賴性關系(Fig 5)。過表達MANF后可明顯提高小腸上皮細胞的增殖活性(Fig 6)。結果表明腸上皮細胞中過表達MANF可以促進細胞增殖。
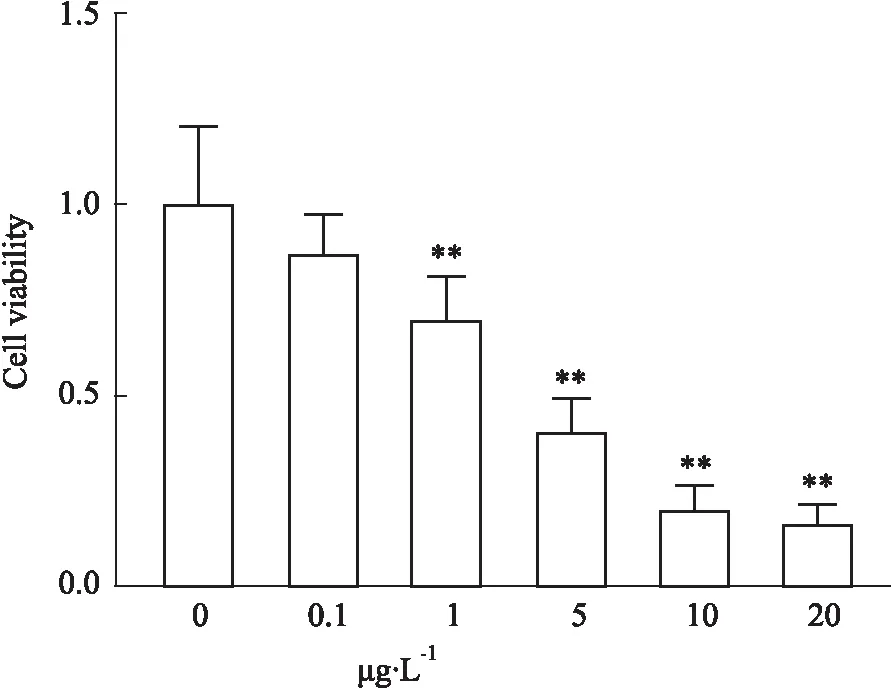
Fig 5 ER stress had effects on proliferation of The CCK8 assay showed that TM inhibited cell viability in a dose-dependent manner. **P<0.01 vs control.

Fig 6 MANF promoted proliferation of intestinal epithelial cells1:GFP+DMSO; 2:MANF-GFP+DMSO; 3:GFP+TM; 4:MANF-GFP+TM. The influence of MANF on intestinal epithelial cell proliferation was detected by CCK8 assay. **P<0.01 vs GFP+DMSO; ##P<0.01 vs GFP+TM.
2.4 MANF抑制ER應激誘導的小腸上皮細胞的凋亡Western blot結果顯示,轉染MANF-GFP質粒可以顯著降低TM誘導后FHs 74 Int細胞中促凋亡蛋白cleaved-caspase-3和Bax的生成,提高抗凋亡蛋白Bcl-2的表達(Fig 7);flow cytometry顯示,TM刺激后,GFP組發生凋亡的細胞比例(27.9±0.535 4),高于MANF-GFP組發生凋亡的細胞比例(17.93±0.495 7)(Fig 8)。結果表明過表達MANF可以抑制ER應激誘導的小腸上皮細胞的凋亡。

Fig 7 MANF inhibited TM-induced ER stress-mediated A: The expression of apoptosis-related proteins was detected by Western blot; B: The gray value was detected for A. **P<0.01 vs GFP+TM.

Fig 8 MANF inhibited TM-induced ER stress-mediated A: Representative flow cytometry density plots of apoptosis rates of intestinal epithelial cells; B: Statistical bar chart of A. 1:GFP+DMSO; 2:MANF-GFP+DMSO; 3:GFP+TM; 4:MANF-GFP+TM. **P<0.01 vs GFP+DMSO;##P<0.01 vs GFP+TM.
3 討論
功能失調的ER應激和UPR是腸道炎癥的發病原因之一。因此,以減輕ER應激為靶點的藥物可能是治療腸炎的有效選擇[13]。本研究表明,MANF可以明顯抑制小腸上皮細胞內的ER應激,促進腸上皮細胞的增殖能力并減少其凋亡。
MANF是一種對ER應激敏感的可溶性分泌蛋白[7]。在腦缺血的早期即可上調表達,甚至早于ER應激的標志性蛋白CHOP[8]。本研究發現,誘導FHs 74 Int細胞發生ER應激后,內源性的MANF分別從TM處理后3 h和TNF-α處理后9 h開始表達增多,再次證明ER應激早期即可以誘導MANF的表達。
有研究表明[14-15],MANF的表達上調是對ER應激的適應性反應,MANF的表達有助于緩解UPR。UPR信號轉導作用主要依賴PERK、IRE1和ATF6 3種ER跨膜蛋白。在穩態情況下,Bip結合并封閉上述3個信號分子,使其保持于非激活的狀態,并穩定在ER膜上。但Bip和非折疊蛋白有更強的親和力,當ER中滯留非折疊蛋白時,Bip則會同其結合,并釋放PERK、IRE1和ATF6,繼而激活UPR的3條信號通路。PERK和ATF6均可誘導CHOP的表達,故一般認為Bip和CHOP均為ER應激的標志蛋白[1, 16]。本研究發現,給予ER應激誘導劑后,Bip和CHOP的表達增多。相較轉染空載體的對照組,MANF可以明顯抑制ER應激相關蛋白Bip和CHOP的表達,表明MANF發揮抑制ER應激的作用。
當ER應激持續加重,則會通過激活caspase-12和CHOP途徑誘導細胞的凋亡。ER應激可以激活caspase-12,繼而切割caspase-9,使caspase-3激活,導致細胞凋亡[17]。在腸炎模型中,與全身缺失CHOP的小鼠相比,野生型小鼠腸黏膜中有大量凋亡細胞,提示CHOP基因表達上調加重了細胞凋亡和結腸炎的發生[18]。在本研究中,我們用Bcl-2, Bax和cleaved-caspase-3以及Annexin Ⅴ和7-AAD凋亡流式檢測來表征細胞凋亡的水平,發現MANF可以抑制ER應激誘導的細胞凋亡。同時我們還觀察到ER應激抑制腸上皮細胞增殖,并呈現劑量依賴的關系,提示ER應激越嚴重,對上皮細胞的增殖抑制作用越明顯,但過表達MANF可明顯緩解此現象。
以上結果提示,MANF在腸上皮細胞發生ER應激的早期即可明顯上調,并具有抑制ER應激,促進腸上皮細胞增殖,抑制其凋亡的保護作用。從而發揮腸黏膜屏障保護和抑制腸道炎癥的潛在治療作用。然而MANF影響ER應激發生的具體分子機制尚待闡明。本研究為MANF促進腸上皮細胞功能修復提供一定的理論依據。

