溫陽化濁通絡方對系統性硬化病小鼠Sema3A/Nrp1信號通路的影響
李穎利,卞 博,劉東嬌,趙晨光,郝元森,韓 立,卞 華,郭克磊
(南陽理工學院 1.張仲景國醫國藥學院、2.河南省張仲景方藥與免疫調節重點實驗室,河南 南陽 473004)
系統性硬化病(systemic sclerosis,SSc)是一種以皮膚增厚和纖維化及胃腸道、肺、心、血管等多個系統受累為特征的自身免疫性疾病。SSc的病因及發病機制十分復雜,目前認為病因與遺傳和環境因素有關,發病機制包括血管病變、免疫系統功能失調、纖維化及3者間的相互作用,共同導致了SSc的發生和發展[1]。毛細血管和小動脈等微血管的損傷和內皮細胞的活化導致的血管病變是SSc進程中最早出現的病變[2]。近年研究發現,Sema3A/Nrp1途徑的異常調節與血管病變過程密切相關,Sema3A/Nrp1軸已成為血管病變相關疾病的治療靶點。
中醫藥治療SSc有較好效果,藥理研究機制以抗纖維化為主[3]。本課題組基于肺脾腎-皮毛相關理論指導創立溫陽化濁通絡方治療SSc具有較好臨床療效,前期研究發現溫陽化濁通絡方能夠降低SSc患者血漿內皮素-1(endothelin-1,ET-1)、血管性血友病因子(von Willebrand factor,vWF)水平、循環內皮細胞數量,降低SSc患者甲襞血管管攀形態、血管流態、襻周狀態的積分;溫陽化濁通絡方還可抑制SSc模型小鼠血清VEGF、結締組織生長因子(connective tissue growth factor,CTGF)和ET-1的表達水平[4-6]。說明溫陽化濁通絡方具有保護血管,改善甲襞微循環障礙的作用,但其機制還不清楚。本研究通過建立SSc小鼠模型,觀察溫陽化濁通絡方對SSc小鼠Sema3A/Nrp1信號通路的影響,探討其治療SSc的作用機制,為SSc的防治提供理論依據。
1 材料與方法
1.1 實驗動物SPF級C57BL/6N♀小鼠60只,體質量(18~20) g,7~8周齡,購自浙江維通利華實驗動物技術有限公司,動物生產許可證號SCXK(浙)2019-0001,所有動物的飼養及實驗操作均符合實驗動物福利及倫理要求。
1.2 藥物注射用鹽酸博來霉素(批號19033911,1.5萬U)購自瀚暉制藥有限公司;Sema3A抑制劑EGCG(純度99.87%,HY-13653)購自美國MedChemExpress;溫陽化濁通絡組方藥材黃芪30 g、黨參15 g、桂枝9 g、淫羊藿12 g、積雪草15 g、白芥子9 g等購自河南省張仲景大藥房。溫陽化濁通絡組方藥液制備方法如下:將所有組方藥材混合用蒸餾水浸泡30 min,置于陶瓷中藥煎鍋內武火煎煮開后煎30 min,過濾并收集藥液,再次加入蒸餾水煎30 min,合并兩次濾液濃縮至藥液濃度相當于生藥2.8 kg·L-1,于-20 ℃ 冰箱保存備用。依據人和小鼠每公斤體重劑量折算系數計算,溫陽化濁通絡方低、中、高劑量組的給藥劑量分別為21、42、84 g·kg-1。
1.3 主要試劑與儀器4%多聚甲醛固定液(P0099)、蘇木精伊紅(HE)染色試劑盒(C0105S)、DAB顯色試劑盒(P0203,上海碧云天);BCA蛋白測定試劑盒(A53226)、ECL化學發光試劑盒(34577,美國Thermo Fisher)哺乳動物蛋白抽提試劑盒(CW0889,北京康為世紀);GAPDH鼠單抗(AC002,武漢愛博泰克),Sema3A兔多抗(DF8609)、VEGFA兔多抗(AF5131,江蘇親科),Nrp1鼠單抗(sc-5307,美國Santa Cruz),HRP標記羊抗兔二抗(5220-0336)、羊抗鼠二抗(074-1806,美國KPL);小鼠Sema3A ELISA試劑盒(CSB-EL020980MO,武漢華美生物);石蠟切片機(CUT6062,德國SLEE),包埋機(TKY-BMB,湖北泰康醫療),組織脫水機(MTM,德國SLEE),倒置顯微鏡(IX71,日本OLYMPUS),組織細胞破碎儀(Bullet Blender STORM,美國Next Advance),全功能酶標儀(Synergy H1,美國BioTek),蛋白電泳儀(Mini-PROTEAN 3)、凝膠成像系統(Gel Doc XR+,美國Bio-Rad)。
1.4 模型構建及實驗分組將60只小鼠隨機分為對照組(Control)、模型組(SSc model)、Sema3A抑制劑組(EGCG)、溫陽化濁通絡方低(Low dose)、中(Medium dose)、高(High dose)劑量組,每組各10只。對照組連續皮下注射4周PBS 0.1 mL·d-1,其余各組給予200 mg·L-1的博萊霉素(用pH 7. 4的PBS稀釋) 0.1 ml·d-1皮下注射連續4周,建立SSc模型[7]。
1.5 給藥方法對照組和模型組小鼠給予生理鹽水0.3 mL·d-1灌胃連續4周;Sema3A抑制劑組采用腹腔皮下注射10 mg·kg-1·3d-1,連續注射4周;溫陽化濁通絡方低、中、高劑量組灌胃劑量分別為21、42、84 g·kg-1·d-1,連續給藥4周。
1.6 皮膚組織病理學檢測取背部造模部位皮膚,4%多聚甲醛固定、石蠟包埋、切片、脫水,HE染色,封片,光學顯微鏡下觀察皮膚病理改變。每組內每張切片隨機挑選3個100倍視野進行拍照。應用Image-Pro Plus 6.0軟件以100倍標尺為標準,選取合適的視野,每張切片測量5處皮膚真皮層厚度(μm),并求出平均值。
1.7 免疫組化法檢測皮膚組織VEGFA表達將4%多聚甲醛固定的小鼠皮膚取出進行蠟塊包埋、切片置載玻片,脫蠟至水,EDTA進行抗原修復,3% BSA室溫孵育30 min,滴加VEGFA(1 ∶100)一抗,洗滌,加二抗(1 ∶200),洗滌后DAB顯色封片于顯微鏡下觀察拍攝。每組內每張切片隨機挑選3個200倍視野進行拍照,應用Image-Pro Plus 6.0軟件分析陽性的累積光密度值(IOD)以及組織的像素面積(AREA),并求出平均光密度值IOD/AREA(Mean Density)。
1.8 Western blot法檢測皮膚組織Sema3A、Nrp1及VEGFA蛋白表達給藥4周后,取小鼠背部皮膚,加入哺乳動物蛋白抽提試劑進行組織勻漿,冰浴裂解,離心后取上清液,BCA蛋白定量試劑盒定量上清中蛋白濃度,取30 μg待測蛋白加入上樣緩沖液,煮沸10 min;SDS-PAGE電泳后轉至硝酸纖維素膜,5% BSA封閉1 h,加入Sema3A、Nrp1、VEGFA一抗孵育2 h,TBST洗滌5次,加入對應HRP標記兔、鼠二抗孵育2 h,TBST洗滌5次,ECL試劑顯影后使用凝膠成像分析系統拍照,ImageJ軟件分析蛋白條帶的灰度值,蛋白相對表達量=目的蛋白條帶灰度值/GAPDH蛋白條帶灰度值。
1.9 ELISA法檢測血清Sema3A水平末次灌胃后半小時,麻醉小鼠通過眼眶動脈采血,收集血液放入不含抗凝劑的試管中,4 ℃靜置2~3 h,以2 500 r·min-1離心10 min,取上層血清,按照ELISA試劑盒操作步驟檢測各組血清中Sema3A的水平。

2 結果
2.1 HE染色檢測各組小鼠皮膚組織病理變化Fig 1結果顯示,與對照組比較,SSc模型組真皮層可見炎性細胞浸潤,毛囊、汗腺等結構減少,血管壁增厚,局部可見成纖維細胞增生,炎性細胞浸潤;與模型組比較,溫陽化濁通絡方低、中、高劑量組和抑制劑組小鼠真皮層炎性細胞浸潤減少。如Fig 2所示,與對照組相比,模型組真皮層明顯增厚(P<0.01);與模型組相比,EGCG組真皮厚度明顯減弱(P<0.01),低、中、高劑量溫陽化濁通絡方處理后真皮層厚度均變薄(P<0.05)。

Fig 1 HE staining of mouse skin tissues (×100)
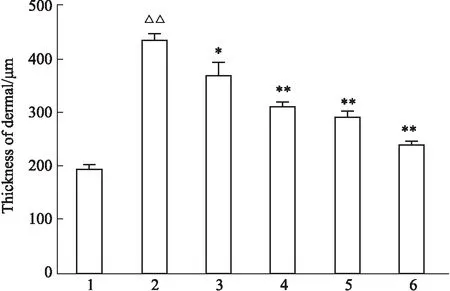
Fig 2 Effect of WYHZTLF on dermal thickness n=5)1:Control;2:SSc model;3:Low dose;4:Medium dose;5:High dose;6:EGCG. △△P<0.01 vs Control; *P<0.05, **P<0.01 vs SSc model
2.2 免疫組化法檢測各組小鼠皮膚組織VEGFA蛋白表達如Fig 3、4所示,與對照組比較,SSc模型組VEGFA蛋白表達增加(P<0.05);與模型組比較,EGCG組VEGFA蛋白表達明顯降低(P<0.05),溫陽化濁通絡方低、中、高劑量組VEGFA蛋白表達均降低,中、高劑量組差異具有顯著性(P<0.05)。

Fig 3 Immunohistochemistry of VEGFA in mouse skin tissues (×200)
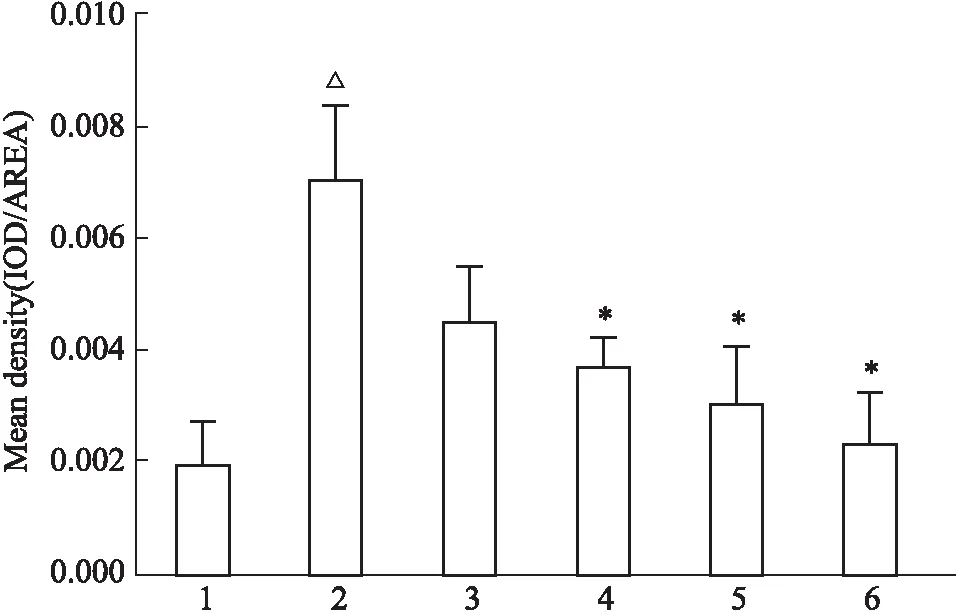
Fig 4 Effect of WYHZTLF on VEGFA protein 1:Control;2:SSc model;3:Low dose;4:Medium dose;5:High dose;6:EGCG. △P<0.05 vs Control; *P<0.05 vs SSc model
2.3 Western blot檢測小鼠皮膚Sema3A、Nrp1及VEGFA蛋白表達結果如Fig 5所示,與對照組比較,SSc模型組Sema3A、VEGF蛋白表達明顯增加(P<0.05,P<0.01),Nrp1蛋白表達明顯減弱(P<0.01);與模型組相比,溫陽化濁通絡方低、中、高劑量組Sema3A、VEGFA蛋白表達均降低,差異具有顯著性(P<0.05,P<0.01),Nrp1蛋白表達均增強,高劑量組差異具有顯著性(P<0.05),EGCG組Sema3A表達降低(P<0.05),VEGFA表達顯著降低(P<0.01),Nrp1蛋白表達明顯增強(P<0.05)。

Fig 5 Effect of WYHZTLF on Sema3A, Nrp1 and VEGFA protein expression n=5)A: Western blot results for Sema3A、Nrp1 and VEGFA. B, C, D;The relative protein expressions levels of Sema3A, Nrp1 and VEGF A. 1:Control;2:SSc model;3:Low dose;4:Medium dose;5:High dose;6:EGCG. △P<0.05,△△P<0.01 vs Control; *P<0.05, **P<0.01 vs SSc model
2.4 ELISA檢測血清Sema3A表達水平結果如Fig 6所示,與對照組相比,SSc模型組血清Sema3A水平明顯增加(P<0.01);與模型組相比,溫陽化濁通絡方低、中、高劑量組血清Sema3A水平均降低,差異具有顯著性(P<0.01),EGCG組血清Sema3A水平顯著降低(P<0.01)。
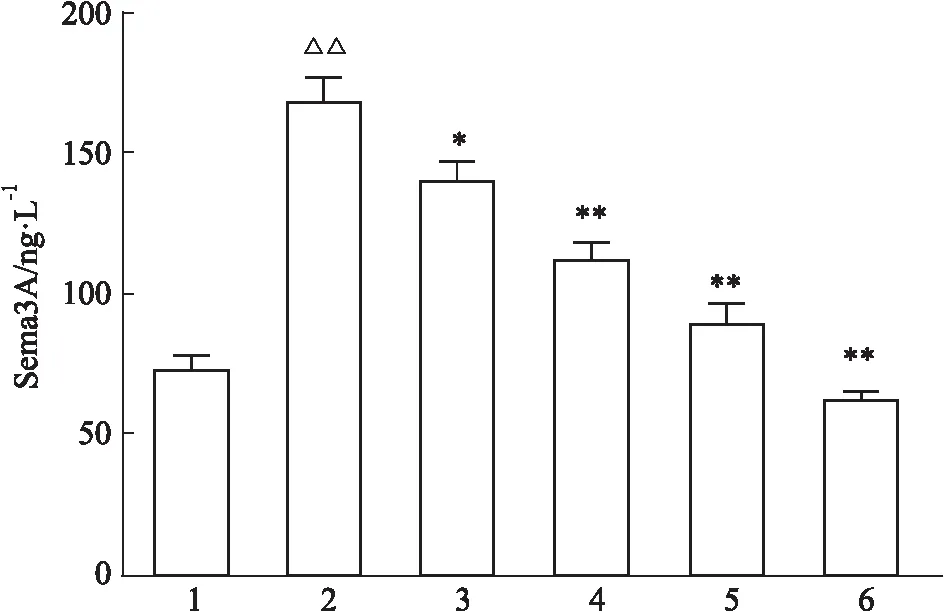
Fig 6 Mouse serum levels of Sema3A determined 1:Control;2:SSc model;3:Low dose;4:Medium dose;5:High dose;6:EGCG.△△P<0.01 vs Control; *P<0.05,**P<0.01 vs SSc model
3 討論
信號素家族蛋白Sema3A及其受體Nrp1在免疫調節、細胞凋亡、細胞遷移和血管生成等過程中發揮關鍵作用,以Sema3A/Nrp1為靶點的針對自身免疫性疾病的治療已成為當今研究的熱點[8]。Sema3A是分泌性的糖蛋白,其發揮功能必須與受體Nrp1結合才能協同胞內信號轉導。Nrp1在脊椎動物中結構高度保守,其主要表達于動脈內皮細胞,Nrp1的胞外段不同結構域可分別與Sema3A或VEGFA結合介導信號傳導[9]。
Sema3A及其受體Nrp1相互作用通路的改變,參與了SSc患者血管系統的重塑。研究發現SSc患者血清Sema3A水平較正常人高表達,可能參與新生血管生成機制的調節導致SSc血管生成的紊亂[10]。同時,研究發現SSc患者血清和皮膚Nrp1的表達水平顯著降低,并且較低水平的循環Nrp1與NVC異常的嚴重程度和指(趾)端潰瘍的存在有關,而血管內皮細胞沉默Nrp1基因及用SSc患者血清處理的血管內皮細胞都能夠導致血管生成受損,結果表明Nrp1缺陷在SSc血管生成中發揮關鍵作用[11]。本研究通過建立SSc小鼠模型,發現模型小鼠皮膚組織Sema3A蛋白上調表達,Nrp1蛋白下調表達,提示Sema3A/Nrp1信號軸可能參與了SSc疾病進程,這與上述研究結果相一致;給與溫陽化濁通絡方治療后,Sema3A蛋白下調表達,Nrp1蛋白上調表達,提示溫陽化濁通絡方可能通過調節Sema3A/ Nrp1改善SSc血管生成紊亂。然而也有研究顯示Sema3A在SSc患者血清中表達較正常人低,此外,血清Sema3A低表達水平與疾病持續時間及SCL-70抗體陽性負相關[12]。這與前述文獻結果不一致,Sema3A水平在SSc患者中差異表達,可能與分析的患者數量少或患者處于不同的疾病分期等原因有關,與本文結果不一致,可能是因為SSc小鼠模型與SSc患者之間的差異造成的,Sema3A在SSc中的表達及作用機制還需大量臨床病例數據及實驗去進一步證實。
VEGF是調節血管生成的一個重要因子,其通過參與血管新生及血管形成、維護血管正常狀態及完整性等生物過程在SSc進程中發揮作用[13]。研究表明,SSc患者真皮和表皮中VEGFA的表達水平顯著增加,不同疾病階段的血清中VEGF也顯著上調表達,但病史時間長的患者體內血管數量卻是減少的,尤其是小血管的數目,高水平VEGFA的持續刺激可引起血管生成異常及炎癥反應的發生[14]。而VEGFA需要通過與Sema3A受體Nrp1和酪氨酸激酶受體VEGFR-1、VEGFR-2結合才能夠發揮其生物學功能,但這兩者在SSc患者皮膚的內皮細胞中均上調表達[15]。同時,Sema3A與VEGF165之間存在競爭性結合Nrp1,高濃度的Sema3A可競爭性結合Nrp1,在內皮細胞中減少Nrp1與VEGF165的結合,從而抑制血管內皮細胞的黏附,進而抑制血管增生[16]。本研究免疫組化及WB結果顯示,VEGFA在SSc模型小鼠皮膚組織及微血管內上調表達,溫陽化濁通絡方治療后,VEGFA下調表達,提示溫陽化濁通絡方可能通過下調VEGFA的表達調節SSc血管生成異常。
綜上所述,VEGFA及Sema3A/Nrp1途徑的異常調節與SSc血管病變過程密切相關,溫陽化濁通絡方可通過下調Sema3A、VEGFA表達,上調Nrp1表達改善SSc血管病變。但血管生成調節過程異常復雜,溫陽化濁通絡方通過Sema3A/Nrp1調節SSc血管生成的詳細機制及其是否還通過調節其它信號通路發揮治療SSc的作用是本課題組有待深入研究的方向。

