基于雙五氟芐基硫醚的氣相色譜-質譜法測定大鼠腦組織中的H2S
王 秀,汪 生,陳志武
(安徽醫科大學 1.基礎醫學院藥理教研室,2.科研實驗中心,安徽 合肥 230032)
硫化氫(hydrogen sulfide,H2S)被認為是繼一氧化碳(carbon monoxide,CO)和一氧化氮(nitric oxide,NO)之后發現的第三種內源性氣體信號分子[1],多年的科學研究揭示腦組織中存在生理濃度的H2S,并參與了心血管系統和神經系統等機體的生理功能調節和病理過程。內源性H2S主要由酶促反應產生,可通過胱硫醚-β-合成酶(l-cystathionine-β-synthetase,CBS)和胱硫醚-γ-裂解酶(l-cystathionine-γ-lyase,CSE)催化半胱氨酸(l-cysteine,L-Cys)生成。另外,3-巰基丙酮酸硫基轉移酶(3-mercaptopyruvate sulfurtransferase,3-MST)也可生成H2S[2]。腦組織中含有豐富的H2S合酶,如CBS和3-MST,產生的H2S可起到神經遞質或神經調質的作用,發揮多種生物學效應,如促進海馬長時程增強而參與學習和記憶功能的調劑,抑制神經炎癥反應[3-4],通過抗氧化應激損傷和抗細胞凋亡等產生較強的神經保護作用[4-6]。
在H2S的神經生物學作用研究中,腦組織中H2S的檢測是至關重要的。目前,測定生物樣品中H2S濃度的方法主要有亞甲基藍分光光度法[7]、頂空氣相色譜法[8]、反相高效液相色譜法[9]和熒光探針法[10]。其中,亞甲基藍法簡單快速,是檢測水和非生物性樣品中H2S濃度的最常用的方法。但其敏感性較差,且實驗過程中生成了其他的有色物質,可能對665 nm處檢測的吸收峰產生影響,使測定結果產生誤差;頂空氣相色譜法實驗不成熟,難以用于實踐;反相高效液相色譜法的準確性易受到氧濃度的影響,定量分析有一定難度;熒光探針法具有較高的靈敏度和選擇性,但其穩定性低且成本過高。Kage等[11]報道在堿性條件下,將血液中H2S轉化為硫離子(S2-)后,用五氟卞基溴(pentafluorobenzyl bromide,PFBBr)衍生化成雙五氟芐基硫醚(bispentafluorobenzyl sulfide,C6F5CH2SCH2C6F5),采用氣相色譜-質譜法(gas chr-omatograph-mass spectrometry,GC-MS)檢測C6F5CH2SCH2C6F5來確定H2S濃度。目前認為該方法敏感性和特異性均較好,是檢測血液樣本中H2S的金標準[12]。由于蛋白質中含硫的氨基酸也可產生釋放S2-,并且腦組織比血液含有更多的蛋白質,該方法能否檢測腦組織中H2S尚未見文獻研究報道。因此,本研究優化了腦組織樣品的前處理和PFBBr衍生化反應的條件,建立腦組織中H2S的GC-MS測定方法。
1 材料與方法
1.1 實驗材料
1.1.1儀器 安捷倫7890B-7000D型氣相色譜三重四極桿質譜儀,由美國Agilent公司出品;XW-80C型旋渦混合器,上海醫科大學儀器廠出品;XPE205型分析天平,瑞士ETTLER TOLEDO公司出品;Milli-Q Integral型超純水系統,由美國Millipore公司出品。
1.1.2藥品與試劑 硫氫化鈉(sodium hydrosulfide,NaHS)、甲醇(methanol,HPLC級,純度≥99.9%),購自美國Sigma公司,批號分別為#SHBL6872V和#WXBD4144V;四硼酸鈉(sodium tetraborate,Na2B4O7, 純度>99.5%),購自上海麥克林生化科技有限公司,批號:L11197038;五氟卞基溴(pentafluorobenzyl bromide,PFBBr, 純度為98%)、十四烷基二甲基芐基氯化銨(tetradecyl dimethyl benzyl ammoniumchloride,TDMBA, 純度為99%)和1,3,5-三溴苯(1,3,5-tribromobenzene, TBB, 純度>98%),均購自中國百靈威科技有限公司,批號分別為L950U31、L360U66和L9A0T55;磷酸二氫鉀(potassium dihydrogen phosphate,KH2PO4, 純度≥99.5%)、乙酸乙酯(HPLC級, 純度≥99.8%)購自國藥集團化學試劑有限公司,批號分別為20181209和20200617。
1.1.3實驗動物 健康SD大鼠(SPF級),160~200 g,全部由安徽醫科大學實驗動物中心提供。實驗室內通風良好,飼養溫度為(22±3) ℃。實驗所用動物生產許可證號為:SCXK(皖)2017-001。
1.2 GC-MS測定方法
1.2.1溶液配制 飽和Na2B4O7溶液:稱取1.5 g Na2B4O7,加入到250 mL無氧水中(超純水煮沸10 min,冷卻至室溫),加熱溶解,冷卻至室溫后超聲,取上層清澈溶液。TDMBA溶液:稱取TDMBA 92.0 mg,加入50 mL飽和Na2B4O7溶液中溶解。NaHS標準品溶液:稱取NaHS標準品56.0 mg,加入1 mL飽和Na2B4O7溶液溶解后,稀釋成適當濃度的標準溶液(現配現用)。PFBBr溶液:稱取PFBBr 104.4 mg,加入40 mL乙酸乙酯溶解。內標TBB溶液:稱取TBB 8.0 mg,加入10 mL乙酸乙酯,溶解后得到800 μg·L-1的溶液,臨用時稀釋成4 μg·L-1。飽和KH2PO4:稱取11.0 g KH2PO4,加入到50 mL無氧水中,加熱溶解,冷卻至室溫后超聲,取上層無晶體溶液。
1.2.2測定原理 在堿性條件下,H2S轉化為HS-后,被PFBBr衍生化生成C6F5CH2SCH2C6F5。通過氣相色譜分離和質譜定性后,用C6F5CH2SCH2C6F5的選擇離子質荷比(m/z)與TBB的選擇離子質荷比(m/z)的峰面積比定量分析。
1.2.3色譜條件 采用HP-5MS(30 m×250 μm×0.25 μm)毛細管柱;色譜柱程序升溫:起始溫度為100 ℃,保持1.5 min后,以40 ℃·min-1上升到280 ℃,保持5 min;進樣口溫度為280 ℃;載氣為氦氣,速度為1.0 mL·min-1;分流比為10 ∶1;進樣量0.5 μL。
1.2.4質譜條件 電子轟擊離子源,電子能量20 eV。離子源溫度為230 ℃,接口溫度為280 ℃,四極桿溫度為150 ℃,采用MRM模式。內標TBB的一級母離子是314(m/z),定量離子對為m/z 314→235,定性離子對為m/z 207→191。目標衍生物C6F5CH2SCH2C6F5的一級母離子是394(m/z),定量離子對為m/z 394→181,定性離子對為m/z 181→161。
1.2.5腦組織樣品的處理和衍生化反應 大鼠10%水合氯醛腹腔注射麻醉后,斷頭取腦,稱取0.1 g雙側大腦皮質組織浸入0.9 mL飽和Na2B4O7溶液中勻漿90 s。吸取200 μL腦組織勻漿液,加入1倍量甲醇沉淀蛋白,震蕩混勻1 min,離心10 min(12 000 r·min-1,4 ℃)。
取300 μL離心的上清液加入到玻璃試管中,依次加入0.8 mL TDMBA溶液、0.5 mL PFBBr溶液和1.0 mL TBB溶液,震蕩混勻2 min。置搖床(250 r·min-1,25 ℃)中反應1 h,加入1.0 mL飽和KH2PO4溶液,震蕩混勻1 min,吸取上層有機相離心10 min(12 000 r·min-1),過0.22 μm有機微孔濾膜,以待進行后續的GC-MS檢測。
1.2.6方法學驗證 在預實驗確定的最佳實驗條件下,依據《中華人民共和國藥典》關于分析方法驗證指導原則進行方法學驗證,分別考察GC-MS測定H2S方法的選擇性、線性關系與檢測限、準確度與精密度、回收率、基質效應以及穩定性等。
1.3 大鼠NaHS給藥后,腦組織中H2S濃度的測定將SD大鼠按隨機原則分為4組,即生理鹽水(NS)對照組、NaHS 1.4、2.8和5.6 mg·kg-13個劑量組,每組6只大鼠,雌雄各半。各組大鼠分別尾靜脈注射NS或各劑量NaHS,0.5 h后,斷頭取腦,分離雙側腦皮質組織并按“1.2.5 腦組織樣品的處理和衍生化反應”方法處理后,待GC-MS檢測。

2 結果
2.1 色譜分離和質譜定性
2.1.1色譜分離 取64 μmol·L-1的NaHS標準品溶液和NaHS終濃度為64 μmol·L-1的大鼠腦勻漿各200 μL,按前述方法經PFBBr衍生化后,進行GC-MS檢測分析。如Fig 1所示,NaHS標準品溶液和加NaHS的大鼠腦勻漿中TBB波峰和C6F5CH2SCH2C6F5波峰的峰形良好,內標出峰時間均為4.8 min,C6F5CH2SCH2C6F5出峰時間均為5.4 min。
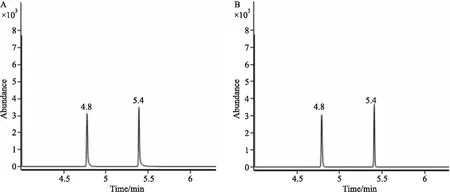
Fig 1 Chromatogram of TBB and C6F5CH2SCH2C6F5TBB was used as internal control. Retention time was 4.8 min for TBB and 5.4 min for C6F5CH2SCH2C6F5. A: 64 μmol·L-1 NaHS standard solution; B: Rat brain homogenate spiked with NaHS at a final concentration of 64 μmol·L-1.
2.1.2質譜定性 如Fig 2所示,TBB特征離子有m/z 314和m/z 235,C6F5CH2SCH2C6F5特征離子有m/z 394和m/z 181。參考文獻的方法[13],選擇m/z 314→235子離子對定量測定TBB和m/z 394→181子離子對定量測定C6F5CH2SCH2C6F5。

Fig 2 Mass spectra of TBB and C6F5CH2SCH2C6F5TBB was used as internal control. A: TBB; B: C6F5CH2SCH2C6F5
2.2 衍生化反應條件的優化
2.2.1PFBBr濃度 配制1、5、10和20 mmol·L-1的PFBBr系列濃度溶液,分別與含100 μmol·L-1NaHS的腦勻漿液衍生化反應后進行GC-MS檢測分析。結果如Fig 3A所示,PFBBr濃度在1~10 mmol·L-1范圍內時,C6F5CH2SCH2C6F5與TBB峰面積比隨PFBBr濃度增加而增大(P<0.01)。加入20 mmol·L-1PFBBr溶液進行衍生化反應時,峰面積比略有減小,但無統計學意義。因此,本文后續實驗的衍生化反應采用10 mmol·L-1的PFBBr。
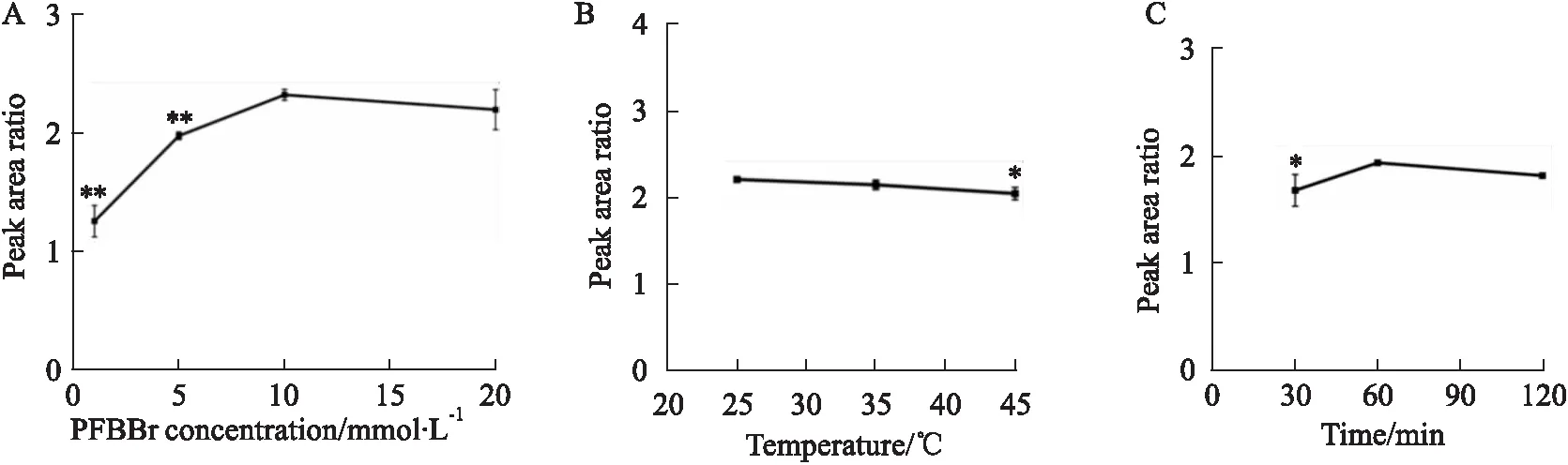
Fig 3 Optimization of derivatization reaction n=3)A: PFBBr concentration (**P<0.01 vs 10 mmol·L-1); B: Temperature of derivatization reaction(*P<0.05 vs 25 ℃); C: Time of derivatization reaction.(*P<0.05 vs 60 min).
2.2.2衍生化反應溫度和時間 為確定衍生化反應的最佳溫度,將10 mmol·L-1的PFBBr加入含100 μmol·L-1NaHS的腦勻漿液中分別置25、35和45 ℃ 3個溫度下進行60 min的衍生化反應后進行GC-MS檢測分析。Fig 3B顯示,25 ℃時C6F5CH2SCH2C6F5與TBB峰面積比最大,35 ℃時的峰面積比與25 ℃時的相比略有減小,但差異無統計學意義。45 ℃時的峰面積比與25 ℃時的相比明顯減小(P<0.05)。
將10 mmol·L-1的PFBBr加入含100 μmol·L-1NaHS的腦勻漿液中于25 ℃下分別反應30、60和120 min后進行GC-MS檢測分析。Fig 3C表明反應進行60 min時,C6F5CH2SCH2C6F5與TBB峰面積比最大。衍生化反應30 min與反應60 min相比,峰面積比明顯減小(P<0.05)。衍生化反應120 min與反應60 min相比,峰面積比差異無統計學意義。因此,本文后續實驗在25 ℃中進行60 min的衍生化反應。
2.3 方法學驗證
2.3.1水溶液中H2S的測定
2.3.1.1 選擇性 分別取不加內標TBB的飽和Na2B4O7溶液(用乙酸乙酯代替TBB)、加TBB的飽和Na2B4O7溶液和加TBB的64 μmol·L-1NaHS標準品溶液各200 μL,衍生化反應后進行GC-MS檢測分析。Fig 4色譜圖顯示,加TBB的飽和Na2B4O7溶液和NaHS標準品溶液均出現了明顯的TBB特征波峰,NaHS標準品溶液出現了明顯的C6F5CH2SCH2C6F5波峰,TBB與C6F5CH2SCH2C6F5的保留時間分別為4.8 min和5.4 min,兩者分離完全,峰形良好。不加TBB的飽和Na2B4O7溶液既未出現TBB波峰,也未出現C6F5CH2SCH2C6F5波峰。結果表明本方法對H2S的測定具有明顯的選擇性。
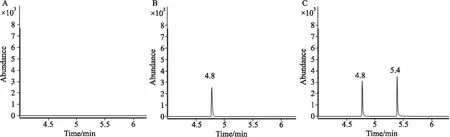
Fig 4 Selectivity of method for detecting H2S in aqueous solution(GC-MS method)Peak at 4.8 min was for internal control TBB and peak 5.4 min was for C6F5CH2SCH2C6F5. A: Chromatogram of Na2B4O7 solution without TBB; B: Chromatogram of Na2B4O7 solution with TBB; C: Chromatogram of 64 μmol·L-1 NaHS standard solution with TBB.
2.3.1.2 線性關系與檢測限 配制濃度分別為1、10、25、50、75和100 μmol·L-1的NaHS標準品溶液,按“1.2.5”項下處理后進行GC-MS檢測。以NaHS的濃度為自變量(x),測得的C6F5CH2SCH2C6F5與TBB峰面積比為因變量(y)做線性回歸分析。得到回歸方程為Y=0.02169X-0.0015(R2=0.9995),線性范圍為1~100 μmol·L-1。按信噪比S/N≥3,測得本方法檢測限(limit of detection,LOD)為0.3 μmol·L-1。
2.3.1.3 準確度與精密度 配制濃度分別為10、50和100 μmol·L-1的NaHS標準品溶液,每個濃度平行6個樣品,連續測定3 d。根據當日隨行標曲,計算得到各樣品濃度。參照標示濃度,利用公式可得準確度和日內、日間精密度。如Tab 1所示,該方法的準確度為-1.41~5.82,日內、日間精密度均<15%,表明本方法測定水溶液中H2S具有良好的準確度和精密度。

Tab 1 Accuracy and precision of method for detecting H2S in aqueous solution and rat brain tissues(n=6)
2.3.1.4 穩定性 配制10、50和100 μmol·L-1的NaHS標準溶液樣品,每一濃度平行3個樣品,分別考察NaHS標準品溶液在室溫25 ℃下保存24 h和衍生化產物C6F5CH2SCH2C6F5在室溫25 ℃下保存24 h時的穩定性。如Tab 2結果顯示,NaHS溶液的穩定性為44.08%~64.43%,其穩定性不好。C6F5CH2SCH2C6F5的穩定性為93.41%~98.66%,且RSD<15%,表明C6F5CH2SCH2C6F5在室溫下具有良好的穩定性。
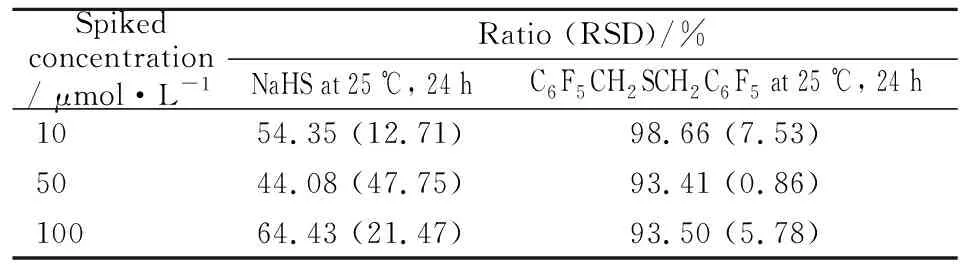
Tab 2 Stability of method for detecting H2S in aqueous solution(n=3)
2.3.2大鼠腦組織中H2S的測定
2.3.2.1 選擇性 分別取空白大鼠腦勻漿液、空白大鼠腦勻漿液(樣品處理過程中不加甲醇沉淀蛋白)和NaHS終濃度為64 μmol·L-1的大鼠腦勻漿液各200 μL,按上述優化條件衍生化反應后進行GC-MS檢測。Fig 5顯示3組樣品中均出現了C6F5CH2SCH2C6F5波峰,未加甲醇的腦勻漿樣品中C6F5CH2SCH2C6F5與TBB峰面積比明顯地大于加甲醇的腦勻漿樣品(P<0.01),加NaHS的腦勻漿樣品中C6F5CH2SCH2C6F5與TBB峰面積比也明顯地大于加甲醇的腦勻漿樣品(P<0.01)。結果表明該方法對測定腦組織中的H2S有明顯的選擇。

Fig 5 Selectivity of method for detecting H2S in rat brain tissue(GC-MS method)Peak at 4.8 min was for internal control TBB and peak 5.4 min was for C6F5CH2SCH2C6F5. A: Chromatogram of blank rat brain homogenate(with methanol); B: Chromatogram of blank rat brain homogenate(without methanol) ; C: Chromatogram of rat brain homogenate spiked with NaHS at a final concentration of 64 μmol·L-1 (with methanol); D: Differences of peak area ratio of C6F5CH2SCH2C6F5 to TBB between blank rat brain homogenate , undeproteinized blank rat brain homogenate and the rat brain homogenate spiked with NaHS at a final concentration of 64 μmol·L-1 n=3). **P<0.01 vs the blank+methanol group.
2.3.2.2 線性關系與檢測限 在空白大鼠腦勻漿液中加入NaHS標準品溶液,配制NaHS終濃度分別為0.25、1、4、16、64、256 μmol·L-1的系列腦組織樣品,衍生化反應后進行GC-MS分析。以NaHS終濃度為自變量(x),加入NaHS后增加的C6F5CH2SCH2C6F5與TBB峰面積比為因變量(y),進行線性回歸分析。得回歸方程為y=0.021 11x+0.002 5(R2=0.999),線性范圍為0.25~256 μmol·L-1。按信噪比S/N≥3,測得本方法檢測限(limit of detection,LOD)為0.1 μmol·L-1。
2.3.2.3 準確度與精密度 配制NaHS終濃度分別為16、64和256 μmol·L-1的腦勻漿樣品,每個濃度平行配制6個樣品,連續測定3 d。根據當日隨行標曲,計算得到各樣品濃度。參照標示濃度,利用公式可得準確度和日內、日間精密度。如Tab 1所示,準確度為-7.27~4.20,日內、日間精密度均<15%。結果表明該方法測定腦組織中H2S也具有良好的準確度和精密度。
2.3.2.4 回收率 以加入NaHS標準品后腦組織勻漿液中增加的C6F5CH2SCH2C6F5與TBB峰面積比,按照上述線性回歸方程計算回收率。結果如Tab 3所示,含NaHS 16、64和256 μmol·L-1的腦組織樣品的測定回收率均在90%以上,表明該方法測定的回收率良好。

Tab 3 Recovery, matrix effect and stability of method for detecting H2S in rat brain tissues
2.3.2.5 基質效應 配制NaHS終濃度分別為16、64和256 μmol·L-1的腦勻漿樣品,每個濃度平行配制6個樣品,測得加入NaHS后增加的C6F5CH2SCH2C6F5與TBB峰面積比為A1。另用飽和Na2B4O7溶液配制NaHS濃度為16、64和256 μmol·L-1樣品,每個濃度平行配制3個樣品,計算得各濃度C6F5CH2SCH2C6F5與TBB峰面積比均數為A2。按公式M=A1/A2×100%計算基質效應M。如Tab 3所示,該方法測得M在93.12%~97.63%之間,表明本方法無明顯的基質效應。
2.3.2.6 穩定性 配制NaHS終濃度分別為16、64和256 μmol·L-1的腦勻漿樣品,每個濃度平行配制3個樣品,衍生化反應后立即進行GC-MS檢測分析,得到C6F5CH2SCH2C6F5與TBB峰面積比。將反應產物于室溫25 ℃放置24 h后,再次測定峰面積比,計算其穩定性。結果如Tab 3所示,3個濃度的NaHS腦組織樣品的衍生化產物在室溫25 ℃保存24 h的穩定性在93.49%~97.15%之間,表明該方法測定在常溫下較為穩定。
2.4 靜脈注射NaHS對大鼠腦皮質組織中H2S濃度的影響本實驗中大鼠腦皮質組織中基礎H2S濃度通過測定NS組大鼠腦皮質組織C6F5CH2SCH2C6F5與TBB峰面積比,根據NaHS標準品溶液制備的標準曲線求得。結果如Fig 6所示,大鼠腦組織中基礎H2S濃度為(11.84±0.38) μmol·L-1。靜脈注射1.4、2.8和5.6 mg·kg-1NaHS后,腦組織中的H2S濃度呈劑量依賴性增加,2.8 mg·kg-1與5.6 mg·kg-1組大鼠腦組織中的H2S濃度與NS對照組相比有顯著性差異。結果表明外源性H2S可透過血腦屏障進入腦組織。

Fig 6 Effect of intravenous injection of NaHS on H2S concentration in rat brain n=6)**P<0.01 vs NS.
3 討論
H2S為多種細胞產生、釋放的內源性氣體[1],可參與調節體內許多生理功能和一些病理過程。當pH為7.4時,體液中的H2S約40%以氣體形式存在,60%以HS-形式存在,但pH為9.5時,主要以HS-形式存在[14]。弱堿性的飽和Na2B4O7溶液不僅可促進H2S轉化成HS-,還可提供HS-與PFBBr衍生化反應所需的堿性環境[15]。衍生化反應生成的硫衍生物C6F5CH2SCH2C6F5熱穩定、揮發性強、具有強電子捕獲性,適用于GC-MS法檢測H2S。
在GC-MS法檢測C6F5CH2SCH2C6F5來定量腦組織H2S中,HS-與PFBBr的衍生化反應條件是十分重要的。本研究對衍生化反應中PFBBr的濃度、反應的時間和溫度進行了優化,發現衍生化反應中的PFBBr最適濃度為10 mmol·L-1,最適反應時間和反應溫度分別為60 min和25 ℃。
本研究對C6F5CH2SCH2C6F5的GC-MS法檢測水溶液和大鼠腦組織中H2S的方法學均進行了研究。研究結果表明該方法不僅對水溶液中H2S的檢測具有明顯的選擇性、良好的準確度和精密度,對大鼠腦組織中H2S的檢測也同樣具有選擇性和良好的準確度、精密度。本文在實驗中觀察到,未加甲醇沉淀蛋白的空白大鼠腦組織中C6F5CH2SCH2C6F5與TBB峰面積比明顯地大于加甲醇的空白大鼠腦組織樣品(P<0.01)。可能是由于腦組織中含有大量的蛋白質,蛋白質中含硫的氨基酸釋放S2-,使測定的峰面積比增加。因此,腦組織樣品處理時應加入甲醇沉淀蛋白,盡可能減小蛋白質的S2-對H2S測定產生影響。文獻報道大鼠腦組織中H2S的濃度在幾十到一百多微摩爾每升,該方法檢測腦組織中H2S的線性范圍為0.25~256 μmol·L-1,LOD為0.1 μmol·L-1,并且不存在明顯的基質效應,可滿足腦組織中H2S的檢測。因此,C6F5CH2SCH2C6F5的GC-MS法是檢測腦組織中H2S的一種可靠、有效的方法。
在該方法檢測腦組織中H2S的穩定性研究中,將樣品H2S衍生成C6F5CH2SCH2C6F5后在室溫25 ℃下保存24 h,檢測穩定性良好。在水溶液中H2S檢測穩定性研究中,觀察到樣品衍生化生成的C6F5CH2SCH2C6F5在室溫25 ℃下保存24 h,檢測也具有良好的穩定性。但樣品直接在25 ℃下保存24 h,則檢測穩定性較差,這可能與C6F5CH2SCH2C6F5穩定性好,而樣品H2S易于揮發溢出有關[16]。因此,應用C6F5CH2SCH2C6F5的GC-MS法檢測H2S時,應在采樣后盡快或衍生反應完成24 h內完成檢測,可減少因H2S揮發導致的影響。
本文采用了C6F5CH2SCH2C6F5的GC-MS法檢測了大鼠腦組織中H2S。檢測結果表明健康SD大鼠腦皮質組織中基礎H2S濃度約為(11.84±0.38) μmol·L-1,明顯低于文獻報道的亞甲基藍法測定的大鼠腦內H2S濃度在50~160 μmol·L-1范圍[17]。是否由于亞甲基藍法在665 nm處檢測H2S時,易受到其它物質的干擾,造成檢測值偏高,而C6F5CH2SCH2C6F5的GC-MS法檢測H2S具有良好的選擇性,前處理時去除了大部分蛋白,更接近體內H2S真實濃度,當然這還有待于今后進一步的研究證實。同時,本文也觀察到靜脈注射NaHS后,大鼠腦皮質組織中的H2S濃度呈劑量依賴性增加,這不僅驗證了C6F5CH2SCH2C6F5的GC-MS法可以檢測腦組織中H2S,也表明外源性H2S可透過血腦屏障進入腦組織。
綜上所述,本文成功建立了C6F5CH2SCH2C6F5的GC-MS法檢測腦組織中H2S的方法,為腦組織中H2S的定量測定提供了一個可靠、有效的方法,并證明外源性H2S可透過血腦屏障進入腦組織。

