鼻咽癌患者循環腫瘤細胞ERCC1基因表達與放化療療效及預后的相關性
王偉鋒 張卓 李云冬 顧安琪 于亞捷 蔡奕錚 鄧曉聰
(海南省腫瘤醫院 1放療科一區,海南 海口 570300;2頭頸外一科)
鼻咽癌是臨床常見的惡性腫瘤,在以鼻咽癌為代表的頭頸鱗狀細胞癌(HNSCC)中,順鉑聯合放療是局部晚期頭頸癌的基礎治療方案之一,但該方案的毒性反應較大,且部分患者出現耐藥或放療抗拒而療效難盡人意;臨床迫切需要特異性靶標來預測放療抗拒或順鉑治療的耐藥性,從而優化治療方案,降低毒性反應,提高治療效果。由于鉑類藥物的作用靶點是DNA,故DNA 修復能力的不同將直接導致個體間腫瘤細胞對鉑類藥物敏感性的差異〔1〕;DNA切除修復交叉互補基因(ERCC)1基因定位于染色19q13.2-13.3,作為核苷酸切除修復途徑系統的關鍵基因,其與DNA修復系統密切相關〔2〕。ERCC1參與鉑類耐藥及放療抗拒的發生;腫瘤組織中ERCC1表達量增高,鉑類聯合放療的PFS更差〔3,4〕,ERCC1的表達量與腫瘤的放射抗拒關系密切。隨著循環腫瘤細胞檢測技術應用于臨床,對于頭頸部腫瘤患者可以通過檢測外周血循環腫瘤細胞(CTC)獲取ERCC1基因表達情況,從而及時調整治療方案,以期獲得更好的療效,本研究利用成熟的CTC檢測技術,通過檢測鼻咽癌患者CTC細胞ERCC1基因表達情況,預測療效并在治療后隨訪評估其表達程度與患者預后的關系。
1 材料與方法
1.1患者一般資料 海南省腫瘤醫院2018年2~12月就診的鼻咽癌初治患者42例,男37例,女5例,年齡18~70歲;中位年齡為46歲;均經過鼻咽鏡活檢確診,臨床分期中Ⅱ期5例、Ⅲ期25例、Ⅳ期12例。患者均進行影像學檢查〔鼻咽部及頸部磁共振成像(MRI)+增強,鼻咽部及頸部CT+增強;胸部CT,上腹部彩超,全身骨掃描,腦部MRI或全身單光子發射計算機斷層成像術(SPECT)/CT〕;入院時采血行血常規、生化、腫瘤標志物等血液學檢查。納入標準:(1)患者均行鼻咽部活檢病理明確為鼻咽癌,患者影像學未發現遠處轉移,臨床TNM分期:Ⅱ~Ⅳ期;(2)美國東部腫瘤協作組(ECOG)評分≤2分;(3)白細胞計數≥4×109/L,血紅蛋白≥90 g/L,血小板≥100×109/L;(4)谷丙轉氨酶、谷草轉氨酶小于1.5倍的正常值上限,肌酐清除率≥60 ml/min。排除標準:(1)既往有惡性腫瘤病史或本次診斷為雙原發腫瘤;(2)之前接受過放療、化療或手術等其他抗腫瘤治療;(3)孕婦或哺乳期婦女;(4)原發灶或淋巴結行手術治療(活檢除外)。
1.2CTC分離及ERCC1基因檢測 患者均在開始治療前采血行CTC檢測并檢測ERCC1基因的表達情況,并作為基線特征記錄;患者在完成誘導化療后即放療前進行第2次采血行CTC檢測,在完成全部放療后進行第3次采血行CTC檢測。患者血樣采集后送由深圳益善生物技術股份有限公司進行檢測,CTC檢測利用CanPatrolTM二代CTC檢測技術,運用納米技術分離CTC,實現單細胞CTC和成團的細胞微團(CTM)的分離、鑒定和分型。先用免疫磁珠負向去除5 ml外周血中白細胞,然后通過納米膜過濾檢出CTC。CTC細胞分離后采用納米技術全面分離所有類型CTCs,其中CTC富集效率≥80%。每個CTC細胞利用熒光原位雜交(FISH)分型,采用多重mRNA原位分析技術用來標記ERCC1基因。
1.3化療 患者均按照2017年鼻咽癌國際臨床靶區勾畫指南〔5〕推薦治療方案,行誘導化療后并接受放化療同步治療。誘導化療期間,TP方案如下:多西紫杉醇(多西他賽,0.5 ml/20 mg;深圳萬樂藥業生產)75 mg/m2,靜脈滴注,d1;順鉑(10 mg/支;山東羅欣藥業生產) 100 mg/m2,靜脈滴注,d1;21 d為1個周期;化療前均予以水化等預處理,誘導化療周期數視患者腫瘤退縮情況及患者耐受情況決定,總療程不超過3個周期,一般不少于2個周期。同步治療方案:順鉑100 mg/m2,21 d為1個周期。患者治療前均需完成規定的影像學檢查明確臨床分期;患者完成誘導化療后進行擇期根治性放療,患者放療時同步順鉑每3 w一次化療(80~100 mg/m2),至放療結束,對于完成全部治療后仍有腫瘤殘留者,予以口服卡培他濱(0.5 g×12片,羅氏制藥)1.00~1.25 g/m2連續口服14 d,21 d為1個周期;服用3個周期。
1.4放射治療 患者均采用頭頸肩熱記憶膜固定,均使用調強放療,6 MV X射線并視情況加用電子線治療,進行靶區勾畫。放療計劃的劑量為:原發灶的大體腫瘤靶區(GTV)劑量66.0~71.4 Gy/(30~33次),頸部轉移淋巴結GTVnd劑量采用66.0 Gy/(30~32次)。高、低危臨床靶區(CTV)劑量分別為60.0 Gy/(30~32次)和54.0 Gy/(30~32次)。對于新輔助化療降期患者,以化療前病灶影像勾畫GTV、GTVnd和CTVnd包膜無受侵者按新輔助化療后實際退縮情況的影像勾畫。包膜受侵者按化療后的影像勾畫,同時包括化療前影像顯示的外侵區域。對于鼻腔內腫瘤突出部分,按化療后實際退縮情況勾畫靶區。完成放療計劃處方劑量后,對于淋巴引流區仍殘留的腫大淋巴結,根據影像學所見淋巴結大小、深度選擇合適能量的電子線單野推量照射,盡量達到消除腫大淋巴結的劑量,最高劑量80 Gy。正常組織劑量限制及處方劑量要求參見放射治療器官限量國際指南〔6〕相關劑量限制標準。
1.5療效評價及隨訪 于2018年3月2日第1例患者完成全部治療后隨訪至2020年12月31日。所有患者治療后隨訪滿2年,最長34個月,中位隨訪時間19個月。所有患者治療結束后第1~3年每3個月復查1次鼻咽及頸部CT/MRI、淋巴引流區彩超并體檢協助、胸部及上腹部CT,必要時行間接鼻咽鏡檢查,了解有無局部復發及常見部位遠處轉移;隨訪結果詳細記錄并統計患者2年總生存率(OS),2年無進展生存(DFS)和局部無復發生存(LRFS),分析不同階段CTC中ERCC1基因不同表達強度〔ERCC1表達陽性率≥75%為高表達(H-ERCC1)組;ERCC1表達陽性率≥25%且<75%為中表達(M-ERCC1)組;ERCC1表達陽性率<25%為低表達(L-ERCC1)組。在分析ERCC1基因表達強度對生存的影響時,為了便于統計學分析,治療的不同階段不表達患者全部按低表達計〕對患者預后的影響。
1.6統計學方法 采用SPSS20.0軟件對數據進行統計學分析。臨床分類資料采用相對數描述,隨訪生存分析采用Kaplan-Meier法繪制生存曲線。OS、DFS和LRFS情況的組間比較采用Log-rank檢驗。
2 結 果
2.1CTC細胞及ERCC1基因表達情況 誘導化療前不同臨床分期患者ERCC1表達陽性率差異有統計學意義(P<0.05)。放療前及放化療后不同臨床分期、誘導化療周期數患者ERCC1表達陽性率差異有統計學意義(P<0.05)。見表1。
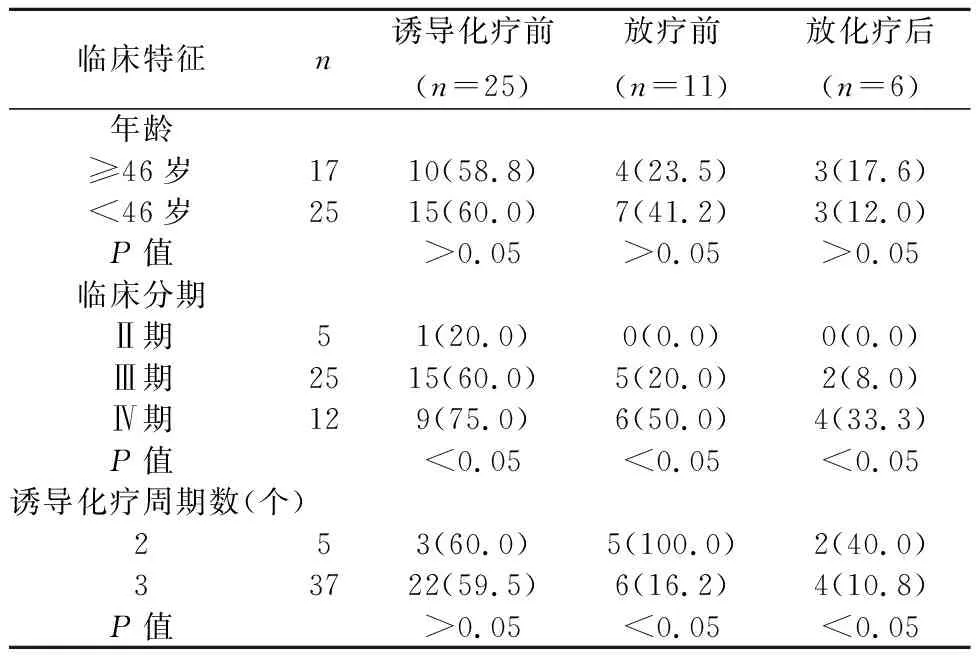
表1 不同臨床特征患者CTC中ERCC1陽性率比較〔n(%)〕
2.2療效分析
2.2.1近期療效 所有患者完成標準方案的放化療;28例(66.7%)出現Ⅲ度放射性口腔黏膜炎,14例(33.3%)出現Ⅱ度放射性口腔黏膜炎;26例(61.9%)患者出現Ⅲ度骨髓抑制;38例(90.6%)患者按期完成擬定的放療計劃,4例(9.5%)患者因放化療相關反應較嚴重,延遲1 w完成放療計劃;完成放療后1個月評估CR者達90.6%(38/42),4例(9.5%)患者完成放療后頸部腫塊仍殘留,完成放療后繼續服用卡培他濱維持治療3個月后,再次復查,頸部殘留腫塊完全消失;治療前合并顱神經癥狀者共計9例(21.4%),完成放療后全部癥狀緩解(100.0%)。
2.2.2遠期療效 1年和2年生存率分別為97.1%、91.4%(圖1);隨訪時間內,死亡患者不足一半,中位生存期尚未成熟;1年DFS和LRFS均為100.0%,2年DFS為100.0%,2年LRFS為92.2%。
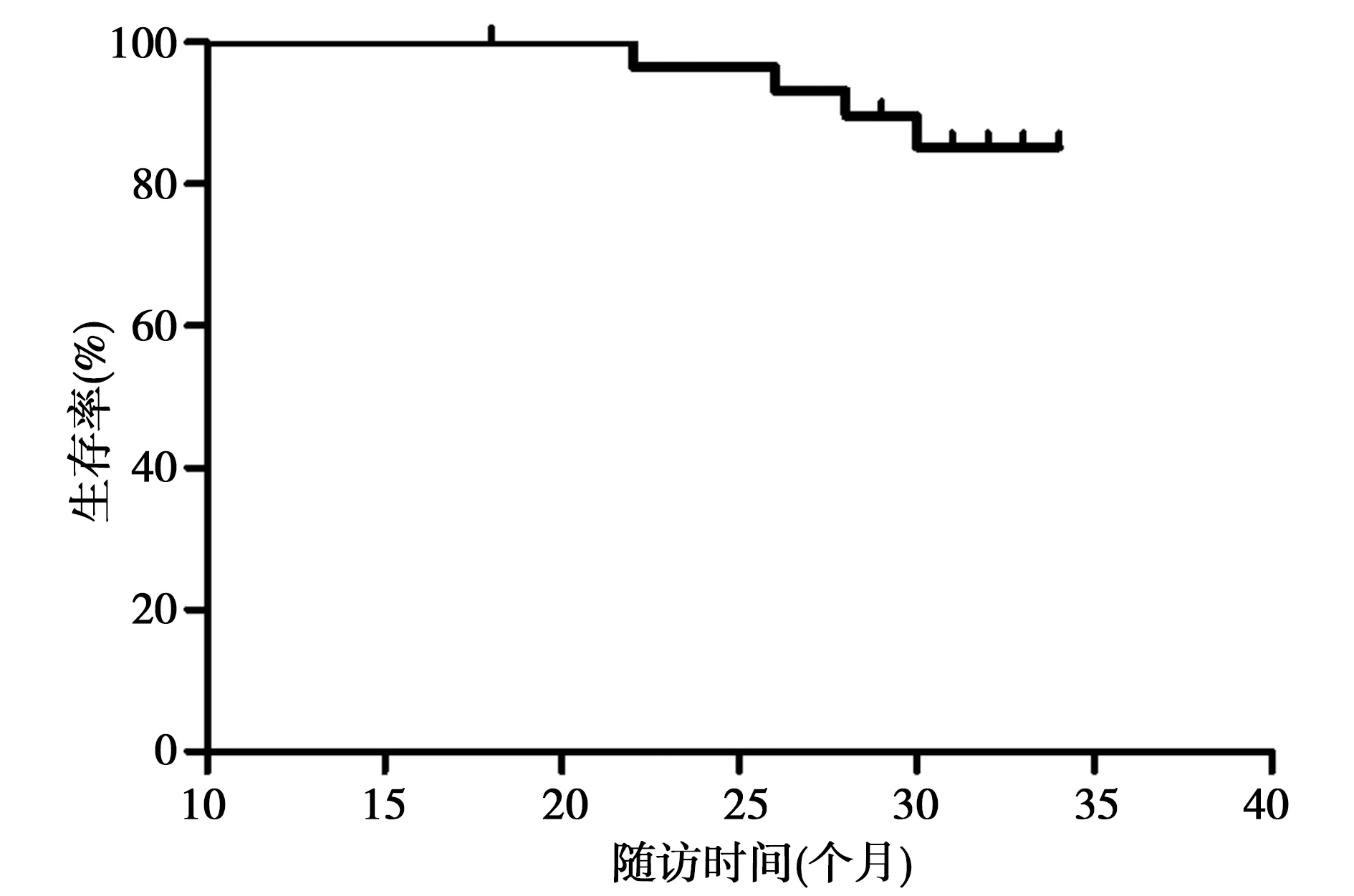
圖1 全部患者總體生存曲線
2.2.3CTC ERCC1表達量對患者生存的影響 誘導化療前,H-ERCC1組、M-ERCC1組、L-ERCC1組1年OS均為100.0%,2年OS分別為:95.2%、97.6%、100.0%,兩兩比較差異均無統計學意義(P>0.05);ERCC1表達強度并不影響患者生存。放療前H-ERCC1組、M-ERCC1組、L-ERCC1組1年OS均為100.0%,2年OS分別為:90.4%、92.8%、100.0%,兩兩比較差異均有統計學意義(P<0.05);結果提示:經誘導化療后,ERCC1基因不同表達強度明顯影響患者生存,低表達或不表達者預后最好;中表達次之,而高表達者預后最差。放化療后,H-ERCC1組、M-ERCC1組、L-ERCC1組1年OS均為:85.7%、90.5%、100.0%,2年OS分別為:80.9%、85.7%、100.0%。高表達者分別與低表達和中表達者比較差異均有統計學意義(P<0.05);而低表達和中表達者生存率比較差異無統計學意義(P>0.05);結果提示:在完成標準的放化療治療后,ERCC1仍有高表達者預后最差,低表達或不表達者及中度表達者不影響患者預后。見圖2。
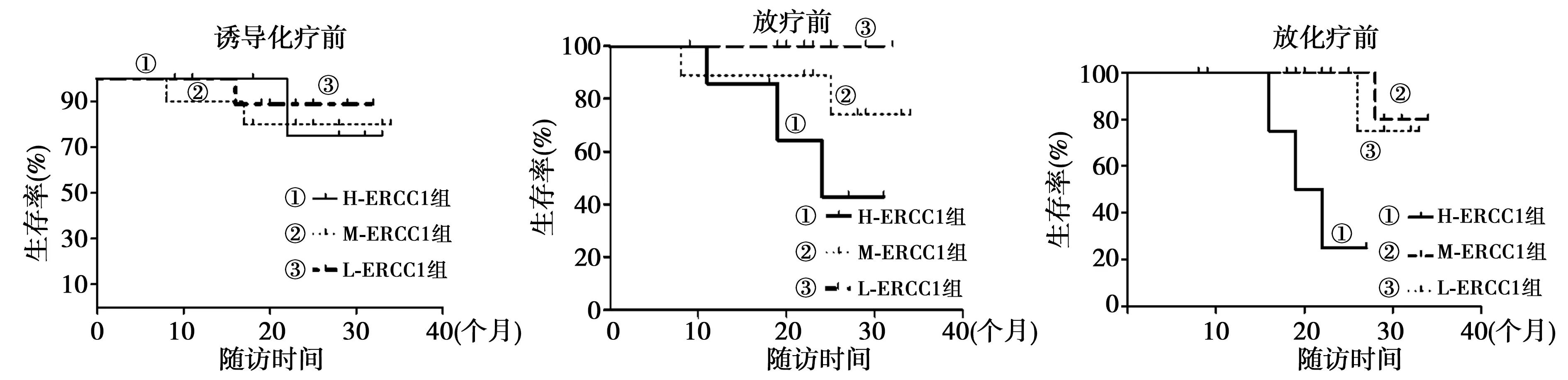
圖2 誘導化療前ERCC1不同表達強度患者生存曲線
3 討 論
鼻咽癌為華南地區最為常見的腫瘤之一;局部晚期鼻咽癌患者占初治鼻咽癌比例較高,其易局部浸潤、常伴有頸部淋巴結轉移,且遠處轉移率較高等特點使其療效仍難令人滿意,局部晚期鼻咽癌患者的治療仍沒有明顯突破,臨床預后仍較差,目前基于影像學診斷的腫瘤TNM分期難以發現及提示早期的微轉移灶;對腫瘤患者進行預后評估是目前CTC臨床應用最廣泛的領域,惡性腫瘤患者治療前后的CTC類型和數目的變化具有重要的預后提示價值。實驗證明CTC的出現與晚期癌癥患者的預后密切相關〔5〕,CTC檢測可隨時獲取用于評估患者的預后。此外,CTC是游離于患者血液中的腫瘤細胞,攜帶了腫瘤的全部基因,可以作為基因檢測的樣本,通過對獲取的CTC進行基因分析,能實時反映腫瘤的基因狀況,清楚地指導患者下一步的藥物選擇,提高治療效果。局部晚期鼻咽癌患者所占新診斷鼻咽癌患者約75%,以鉑類為基礎的誘導化療及鉑類同步放化療已成為局部晚期患者的標準治療方式〔6〕;在以鉑類為基礎的化療治療的腫瘤類型中,ERCC1的表達是腫瘤對順鉑耐藥的關鍵因素;研究表明〔7,8〕,ERCC1不僅參與腫瘤細胞的耐藥過程,還參與細胞的生長、凋亡的過程。謝玲等〔9〕研究發現,石蠟標本ERCC1基因的表達量明顯高于外周靜脈中ERCC1基因的表達,且兩者呈正相關,通過外周血檢測ERCCl基因的表達一樣可以用來研究與癌癥患者臨床特征及放化療療效的關系。
本研究中局部晚期患者占大部分,提示合適強度的誘導化療有助于降低ERCC1的陽性表達率而改善患者的預后,這一結論在后期隨訪的結果可以印證。誘導化療后以順鉑為基礎的同步放化療是局部晚期鼻咽癌的標準治療方案;經過誘導化療及同步放化療后,治療前的不同CTC ERCC1陽性表達率的患者生存無差異;提示局部晚期患者CTC中ERCC1水平表達并不能判斷預后;但是,經過合適的誘導化療后的患者,ERCC1低陽性表達率患者預后最好。ERCC1的表達與多種腫瘤的放射抗拒相關,其基礎理論認為:ERCC1過表達可使停滯在G2/M期的損傷DNA得到迅速修復,而停滯在G2/M期的細胞為放療敏感期〔10〕;這一點在本研究也得到證實,隨訪結果提示:放療前高表達的ERCC1陽性率同步放化療后預后最差;所有患者在完成全部治療后,仍有6例患者CTC中ERCC1高表達而預后最差;此外,中度表達、低表達或不表達者預后無統計學差異,綜合本研究隨訪結果分析,鼻咽癌患者CTC中ERCC1的表達可提示放化療療效,而不同療效影響患者生存。
對于局晚期鼻咽癌高危患者,在標準治療后,是否需要繼續輔助化療仍爭議較大〔11〕,本研究隨訪結果對此有一定的提示意義,鼻咽癌治療失敗大部分是因為發生了遠處轉移,而循環腫瘤細胞是引起遠處轉移的主要因素;在完成標準治療方案后外周循環腫瘤細胞仍存在并高表達ERCC1的患者;可以認定為遠處轉移高風險患者,因此,對于這一部分患者,理論上是需要后續輔助化療以降低遠處轉移率。結合本研究隨訪結果認為:在患者全程治療過程中關鍵時間點檢測CTC的數量及其ERCC1的表達率,可以篩選出遠處轉移高風險的患者,并可以提示患者治療的預后,對于此類高危患者應繼續輔助化療以降低遠處轉移率。但本研究樣本量較少,仍需進一步擴大樣本量以證實研究結果。

