YB-1通過調控Notch/Hes1促進胰腺癌PANC-1細胞增殖和侵襲
王輝 陳明道 夏紅星 李峰 (南華大學附屬南華醫院胃腸外科,湖南 衡陽 421002)
胰腺癌是目前已知惡性程度極高的腫瘤之一,5年生存率不足10%〔1〕,即使是根治性切除患者也不超過20%〔2〕。究其原因,一方面胰腺癌早期診斷困難,多數患者已存在局部進展與遠處轉移,只有少數患者才有手術機會,另一方面其惡性程度極高,治療后容易復發,預后不佳,統計顯示,其術后中位生存期僅為12~25個月〔3〕。Y-box結合蛋白(YB)-1是人體普遍存在由YB基因編碼合成的一類多功能蛋白〔4〕。研究發現在多種惡性腫瘤中YB-1高表達〔5,6〕,并且通過各種相關機制介導腫瘤的侵襲和轉移,并且發現高度表達的YB-1惡性腫瘤預后不佳,但YB-1對胰腺癌的影響機制仍不清楚。本實驗檢測YB-1在人胰腺癌細胞PANC-1中增殖和侵襲的情況,探討其對Notch/Hes1信號通路的調控作用。
1 資料與方法
1.1一般資料 PANC-1腺病毒空載體(Ad-HK)、腺病毒轉染(Ad)-YB-1均購自上海吉凱基因公司。LipofectamineTM2000試劑購自Sigma公司。噻唑藍(MTT)試劑盒、Transwel小室、酶抑制劑RiboLockTMRibonuclease Inhibitor均購自美國Fermentas公司。兔抗人YB-1多克隆抗體和鼠抗人Hes1多克隆抗體購自武漢艾美捷科技有限公司。實驗所需設備及相關試劑由南華大學腫瘤研究所提供。
1.2實驗分組與轉染 實驗分為3組,A組:空白對照組(PANC-1);B組:陰性對照組(PANC-1+Ad-HK組);C組:YB-1過表達組(PANC-1+Ad-YB-1組)。細胞腺病毒載體(LipofectamineTM2000試劑)轉染技術委托上海吉凱基因公司完成。并經細胞轉染效率測定轉染成功率達到60%以上,可以進行下一步實驗。
1.3MTT檢測各組胰腺癌細胞增殖情況 采用10%DMEM配好細胞培養液,各組細胞分別加入96孔板,細胞密度為1×104/孔,溫箱培養,分別在0、24、48、72 h向每組培養孔內加入20 μl MTT液,再培養4 h,加入稀釋的MTT液,二甲基亞砜溶解,酶聯免疫檢測儀在波長為570 nm檢出各孔的OD值,并繪制生長曲線。
1.4細胞劃痕實驗 6孔板分別加入2 ml密度為5×105個/ml的懸浮細胞,溫箱培養,細胞貼壁后用移液器垂直培養面劃“一”字,顯微鏡下觀察0、6、12 h細胞遷移情況。
1.5Transwell侵襲實驗 稀釋基質膠涂抹Trans小室后晾干,加入含有胎牛血清白蛋白(BSA)的培養基在37℃下孵育;細胞懸液制備,并保證PANC-1細胞密度達到5×104/ml;往Transwell小室加入100~200 μl細胞懸液,溫箱中培養24 h,將Transwell小室取出,擦拭小室內質膜,逐步染色、脫色,隨機選取顯微鏡下5個視野并計數,將數據進行統計處理。
1.6Western印跡檢測YB-1和Hes1蛋白表達 裂解液裂解提取蛋白,二喹啉甲酸(BCA)法蛋白定量,十二烷基硫酸鈉-聚丙烯酰氨凝膠電泳(SDS-PAGE),硝酸纖維素膜封閉電泳蛋白后震蕩,分別加入YB-1和Hes1一抗,37℃溫育,再加入相應的二抗,再次37℃溫育,暗室中曝光、顯色、定影、水洗。
1.7統計學分析 采用SPSS20.0軟件進行單因素方差分析、Spearman等級相關性分析。
2 結 果
2.1MTT檢測細胞增殖情況 C組OD值在24、48、72 h時間點明顯高于B組和A組(F=3.63,P=0.04、F=22.05,P<0.01、F=10.33,P<0.01);且隨著時間變化C組OD值增長幅度明顯大于A組和B組(P<0.01),見表1。
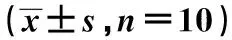
表1 各組胰腺癌細胞在各時間點的增殖能力和遷移距離
2.2各組細胞遷移能力 C組胰腺癌細胞在各時間點遷移距離較A組及B組明顯增大(F0 h=82.98,F6 h=101.46,F12 h=42.84,均P<0.001);且隨著時間變化C組遷移距離增長幅度明顯大于A組及B組(P<0.01),見表1、圖1。

圖1 各組胰腺癌細胞在各時間點遷移距離(×100)
2.3各組細胞侵襲能力檢測 A、B、C組每個視野下穿過小室基底膜的細胞分別為(28.60±2.07)個、(29.63±1.18)個、(59.82±4.92)個,差異有統計學意義(F=148.31,P<0.01),見圖2。

圖2 各組胰腺癌細胞穿透小室基底膜情況(結晶紫染色,×200)
2.4Western印跡檢測各組胰腺癌細胞中YB-1與Hes1蛋白的表達 C組YB-1蛋白表達(0.92±0.02)明顯高于A組(0.56±0.02)和B組(0.48±0.01;F=126.15,P<0.01);C組Hes1蛋白表達(1.34±0.03)明顯高于A組(1.09±0.02)和B組(1.12±0.02;F=98.65,P<0.01),見圖3。
2.5胰腺癌PANC-1細胞中YB-1與Hes1表達的關系 胰腺癌PANC-1細胞中YB-1與Hes1蛋白表達呈正相關(r=0.275,P=0.031)。
3 討 論
YB-1屬于冷休克蛋白超家族的一員,是由YBX1基因編碼,與DNA和RNA結合后參與調控轉錄和翻譯過程,在調節細胞增殖、分化及應激等方面具有重要作用〔7〕。已有研究發現多種惡性腫瘤中YB1呈高表達狀態,其表達水平與腫瘤的增殖、轉移、復發和預后不良密切相關〔8,9〕。
YB-1促進腫瘤增殖的過程極其復雜,有多種因子和機制參與其中,Kotake等〔4〕在人結直腸癌細胞中發現YB-1可通過腫瘤細胞從G1至S期,并可調節細胞周期相關蛋白水平,使腫瘤細胞從G2期至M期,說明YB-1可通過調控腫瘤細胞周期促進腫瘤增殖。Corinna等〔10〕發現YB-1通過磷酸化介導上皮間充質轉化(EMT),從而促進黑素瘤細胞的侵襲與轉移,由此推斷誘導EMT也是YB-1參與腫瘤侵襲和轉移的途徑之一。本研究結果說明YB-1參與胰腺癌PANC-1細胞的發生與發展,YB-1促進胰腺癌PANC-1細胞的增殖可能是通過腫瘤細胞的遷移與侵襲實現的。
Notch信號通路在腫瘤的發生發展中直接調控腫瘤的增殖、凋亡和分化的作用,同時也可通過其他信號通路來調控機體生物學功能〔11〕,在哺乳動物中,Notch信號通路存在4個受體(Notch 1~4)和5個配體(Jaggde1~2,Delta-like1,Delta-like3和Delta-like4),當配體Jaggde/Delta激活,Notch經過一系列水解反應,激活下游靶基因,參與腫瘤細胞分化、增殖和凋亡〔12〕。研究表明Notch信號通路與包括胰腺癌在內多種惡性腫瘤相關〔13,14〕。本研究與史靜等〔15〕發現肝癌HepG2細胞中YB-1可特異性結合Notch3受體并進一步上調其表達的結果一致,說明胰腺癌PANC-1細胞中YB-1呈高表達,其機制可能通過上調Notch/Hes1信號通路的表達,從而促進胰腺癌細胞的增殖和侵襲。而Shi等〔16〕在對人頭皮基底癌細胞和正常人的毛囊細胞進行對比研究中發現,Notch信號通路活性在基底細胞癌(BCCs)中被抑制,卻在正常的毛囊中高度表達,并且Jagged肽刺激Notch信號后BCCs發生凋亡,提示Notch信號通路在人基底癌發揮了抑癌作用,推斷YB-1在腫瘤中作為癌基因或抑癌基因可能取決于細胞組織來源的不同〔17〕,說明腫瘤的發生發展是多個信號通路交叉對話的復雜過程。
綜上,YB-1蛋白在胰腺癌發生發展中具有一定的促癌作用,具體機制可能是上調Notch/Hes1的表達,提示YB-1可為評估胰腺癌新的生物標志及預后參照提供理論依據,而且通過阻斷Notch/Hes1通路的表達有望成為胰腺癌潛在的治療方法,對胰腺癌的預防也具有重要的臨床指導意義。當然,YB-1蛋白和Notch/Hes1通路抑制劑應用于臨床還需大量基礎實驗的深入研究。

