肺癌切除術患者術后并發急性呼吸窘迫綜合征的危險因素及護理干預
薄霞
鄭州大學第一附屬醫院胸外科 450000
在工業迅速發展、環境污染加重的影響下,肺癌的發病率呈現逐年上升的趨勢,發病率在歐美發達國家男性惡性腫瘤中位列第一〔1〕。目前,臨床治療肺癌的主要手段是手術,盡管隨著醫療衛生事業的發展肺癌的病死率有所降低,患者在生存期上獲益,但術后并發癥仍不容忽視。急性呼吸窘迫綜合征(ARDS)主要表現為肺順應性減低、呼吸窘迫、進行性低氧血癥,是肺癌切除術后嚴重并發癥之一,具有起病急、病情進展迅速、病死率高的特點,不利于術后患者生存質量的改善。有研究顯示,全肺切除術后與肺葉切除術后ARDS的發生率分別在2.5%~11.4%、1.0%~5.5%,病死率達50%〔2-3〕。不同病因ARDS的發病率也會存在差異,國外關于肺癌術后并發ARDS的危險因素分析的研究并不少見,但我國在該方面的研究涉足尚淺。本研究以265例肺癌切除術的患者為研究對象,回顧性調查分析術后并發ARDS的危險因素,制定相應的護理對策,旨在為今后臨床工作提供參考。
1 資料與方法
1.1 一般資料
調查研究對象為2016年6月至2019年6月于鄭州大學第一附屬醫院接受肺癌切除術且符合納入標準的265例患者。納入標準:①依據中華醫學會發布的“肺癌臨床診療指南”〔4〕中的標準,結合痰細胞學檢查、影像學檢查、纖維支氣管鏡檢查、經術前或術中病理檢查確診者;②符合手術指征;③主刀醫師為該科室的主任醫師;④均予以全麻,術中提供氣管插管、呼吸機輔助通氣;⑤患者與家屬知情研究,簽署同意書。排除標準:①合并嚴重的心、肝、腎功能障礙者,②其他原因引起的ARDS者,③臨床資料不完整者。265例中男196例,女69例;年齡47~79歲,平均(66.43±8.35)歲;左全肺切除術19例,右全肺切除術22例,肺葉切除術155例,肺段切除術69例;TNM分期:Ⅰ期80例,Ⅱ期143例,Ⅲa期42例。
1.2 方法
1.2.1調查工具 采用問卷調查整理患者的一般人口學資料、圍術期有關疾病資料,①一般人口學資料:性別、年齡、吸煙史、TNM分期、肺部疾病史、手術方式、手術時間。②圍術期有關疾病資料:術前放化療史,術中的出血量、雙肺/單肺的通氣量與氣道壓、單肺通氣時間,術后肺功能指標、圍術期輸液量。吸煙史:每日不少于1支,連續吸煙時間不少于1年或曾有規律吸煙史,戒煙時間未多于20年;手術方式:包括開放性與腔鏡手術,將中途轉開放的手術也歸納入前者;肺部疾病史:支氣管擴張、哮喘、矽肺、慢性支氣管炎、慢性阻塞性肺疾病(COPD)等;圍術期輸液量:即為患者在術前與術后12 h內晶體與膠體的累積輸液量;術后肺功能指標:包括FEV1%預測值、DLCO%預測值,即第1秒用力呼氣容積占用力肺活量的百分比、一氧化碳彌散率。③ARDS診斷:參照ARDS柏林定義中的標準〔5〕,起病急,出現頑固性低氧血癥、持續性呼吸窘迫、胸悶、氣短的典型表現;在排除液體過量、左心衰竭后,影像學檢查顯示彌漫性滲出影;氧合指數(PaO2/FiO2)≤200 mmHg。嚴重程度判定:200 mmHg<氧合指數≤300 mmHg提示為輕度;100 mmHg<氧合指數≤200 mmHg之間提示為中度,氧合指數≤100 mmHg提示為重度。
1.2.2調查方法 由科室N2級及以上級別的護士、副主任醫師組成研究組成員,在調查研究開始前組織全體成員參與調查相關知識與技能的培訓;在專業數據分析人員的指導下對整理所得數據進行比較匯總。
1.3 統計學方法
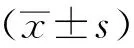
2 結果
2.1 并發ARDS的單因素分析
265例肺癌切除術后的患者中有22例(8.30%)并發ARDS,243例(91.70%)未并發;在22例患者中有14例為中度ARDS,8例為重度。術前放化療史、術中雙肺與單肺通氣量、單肺通氣時間、單肺氣道壓、手術時間及圍術期晶體輸液量、FEV1%預測值、DLCO%預測值在并發ARDS與未并發的患者間差異均有統計學意義(均P<0.05),見表1。
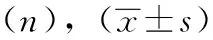
表1 并發ARDS的單因素
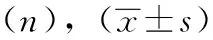
續表1 并發ARDS的單因素
2.2 并發ARDS的多因素分析
將單因素分析中與肺癌切除術后并發ARDS有關的因素進行自變量賦值,放化療史、單肺通氣時間、手術時間、圍術期晶體輸液量、FEV1%預測值是肺癌切除患者術后并發ARDS的危險因素,見表2。
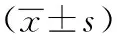
表2 并發ARDS的多因素
3 討論
3.1 肺癌切除術后并發ARDS的狀況
ARDS是一種由各種肺內或肺外因素導致的、以急性彌漫性和炎癥性肺損傷為特點的急性呼吸衰竭疾病。有報道表明,胸部手術后并發呼吸系統疾病的發生率在16.2%~18.0%,其中ARDS是肺癌切除術后較為嚴重的并發癥,是增加圍術期死亡率的主要因素之一〔6〕。ARDS發病急、進展快,這為臨床治療與護理增加了難度,并發后若未盡早識別、采取合理措施,病死率極高。因此,如何識別并有效管理引起肺癌根治術后并發ARDS的危險因素是目前臨床關注的重點項目之一。本研究顯示,肺癌切除術后并發ARDS與未并發的患者術前放化療史、術中雙肺與單肺通氣量、單肺通氣時間與氣道壓、手術時間、圍術期晶體輸液量、FEV1%預測值、DLCO%預測值存在顯著差異。梁鋅等〔7-8〕研究表示,肺切除術后并發ARDS可能與術中單肺通氣階段健側肺部機械通氣性損傷、術側肺部反復復張、容量負荷增加、手術應激促使炎癥介質釋放等因素相關。李紅等〔9〕、闞強波和王俊峰〔10〕研究提到,肺癌術后肺部血流動力學和毛細血管滲透壓改變與并發ARDS密切相關。
3.2 肺癌切除術后并發ARDS的危險因素
放化療史、單肺通氣時間、手術時間、圍術期晶體輸液量、FEV1%預測值是肺癌切除術患者術后并發ARDS的危險因素。具體分析如下:①放化療史:術前采用放化療治療的肺癌患者術后并發ARDS的可能性是未采取患者的1.265倍,可能是因為雖然術前通過放化療能夠殺滅癌細胞,但與此同時自身免疫系統也會受到抑制,導致肺癌患者出現自身免疫系統紊亂的問題,持續的胃腸道反應也會使患者出現營養不良,對手術、麻醉的耐受性差,增加術后并發ARDS的危險性〔11〕。②手術時間:手術時間≥3 h的肺癌切除術患者術后并發ARDS的可能性高于時間<3 h的患者。盧山等〔12〕研究中提到,隨著手術時間的延長,機體受到的創傷越大、吸收的麻醉藥物越多,因蘇醒時間延長導致的生理改變對心肺重要器官的損害程度越重。因此,手術護理配合工作要求準確、迅速、零失誤,盡可能地縮短手術耗時,預防術后ARDS。③晶體輸液量:術前與術后12 h內的晶體輸液量是肺癌切除術后并發ARDS危險因素之一。有文獻報道,在圍術期每增加0.5 L輸液量,術后并發ARDS的危險性將會增加17%〔13〕。分析原因,可能是因為行切除術后,機體呈高動力狀態,患者肺部毛細血管的滲透壓會有一定程度的增高,若晶體輸入過量將會引起肺水腫,導致并發ARDS的風險增加。因此,肺癌圍術期的液體管理對預后有重要意義,在不具備肺毛細血管楔壓(PCWP)、中心靜脈壓(CVP)等手段檢測時應注意患者尿量、血壓、心率等指標的動態變化情況。④單肺通氣時間、FEV1%預測值:有研究提到,肺癌切除術后FEV1%預測值每下降5%,并發ARDS的危險性將會增加10%左右〔14〕。本次調查研究數據顯示,術后并發ARDS患者的FEV1%預測值為低于未并發ARDS患者的預測值,分析原因,可能是因為肺功能不佳的患者往往肺順應性較差,術中造成肺損傷的風險增加;此外,肺癌手術常要求單肺通氣,若單肺通氣時間過長,動脈血氧分壓、血氧飽和度也會受到影響,出現顯著下降的情況,通氣/血流比例失調明顯,導致嚴重低氧血癥,患者FEV1%預測值降低,術后易并發ARDS。對于術前肺功能不佳、手術復雜、耗時較長的患者,臨床醫護工作者應特別關注其術后恢復情況,發現ARDS征象即予以監護與積極治療護理。
3.3 護理對策
針對肺癌切除術后并發ARDS的影響因素,制定有針對性的圍術期護理干預措施。①肺功能維護:FEV1%預測值低將會增加術后并發ARDS的風險,對于仍吸煙的患者,術前責任護士應告知患者吸煙對病情的負面影響、戒煙的目的與重要性;術前指導患者進行有計劃的縮唇呼吸、腹式呼吸鍛煉、有效咳嗽;術后注意保持呼吸道通暢,麻醉清醒后盡早使用鎮痛泵,拔除氣管插管當日可協助患者取半坐臥位、翻身。為避免因使用呼吸機帶來的肺損傷,對于肺健康的患者,責任護士應與醫生溝通,在病情允許的前提下,將潮氣量由常規的每公斤體重10~12 ml調整為6~8 ml。②圍術期輸液量管理:合理管理圍術期液體量,避免液體過多加重肺組織水腫,也不可因嚴格限制補液量引起組織灌注不足。綜合考慮患者病情、出入量、輔助檢查結果,制定合理的術后24 h補液計劃,早期勻速滴入;術后予以床旁胸部CT、胸部正位檢查與肺損傷評分,發現肺滲出較嚴重的患者應對液體量嚴格控制;結合CVP、PCWP、平均動脈壓、血壓、尿量、心率等監測液體管理效果,保持出入量負平衡以實現肺部保護目的。③營養支持:有研究顯示,與腸外營養支持比較,腸內營養支持在提升免疫球蛋白水平方面的作用明顯〔15〕。腸內營養經門靜脈系統作用吸收,早期為肺癌切除術患者提供腸內營養能夠促進患者術后營養狀態恢復的速度,改善免疫功能,責任護士應向患者與家屬講解腸內營養對改善預后的重要性、操作步驟、注意事項等,同時,注意口腔衛生的護理。
ARDS是肺癌切除術后較為嚴重的并發癥,本研究顯示放化療史、單肺通氣時間、手術時間、圍術期晶體輸液量、FEV1%預測值是術后并發ARDS的危險因素,臨床工作中應做好圍術期管理,術前進行風險評估,盡早預防與識別危險因素,降低肺癌切除術后ARDS的發生率與病死率,改善預后。
利益沖突所有作者均聲明不存在利益沖突

