基于學科大概念促思維發展的單元復習課教學
黃鳳翔 汲叢家




摘要:以“水溶液中的離子反應與平衡”為例,基于學科大概念設計單元復習課。依據要符合課程標準、要能提綱挈領聯接其它小概念、能夠落實思維方法等三個原則提煉出本章節大概念“化學平衡在溶液體系中的應用”。在此大概念的統領下,經梳理知識、定性分析、定量分析等三環節的課堂教學,將水溶液中的離子平衡知識結構化。既幫助學生在具體的情境下解決問題,形成學科思維方法,又促進化學核心素養的提升,讓學習真實地發生,實現復習課功能。關鍵詞:學科大概念;單元復習課;水溶液中的離子反應與平衡;思維方法
文章編號:1008-0546(2022)07-0064-05中圖分類號:G632.41文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2022.07.016
一、引言
學科大概念是近年我國學者研究的熱點。其包括三個層面的內容:一是學科大概念具有一定抽象性,是其他概念的聯接。王喜斌指出:學科大概念是能反映學科本質,能將學科關鍵思想和相關內容聯系起來的關鍵的、特殊的概念[1]。二是學科大概念具有結構化的特點。《普通高中課程方案(2017年版)》(下稱“新方案”)要求我們“進一步精選學科內容,重視以學科大概念為核心,使課程內容結構化,以主題為引領,使課程內容情境化”。三是學科大概念對核心素養的形成能起到關鍵作用。新方案指出學科大概念能促進學科核心素養的落實。
相比常規的單元復習,用學科大概念的思想來進行單元復習課的教學設計,有很大的優勢。常規的單元復習課大多數是羅列知識清單,缺少對學生思維的指導。而大概念教學需要對不同知識進行關聯,從而精準掌握知識的本質,同時還可以提高課堂效率[2]。本文以“水溶液中的離子反應及平衡”復習課為例,闡述學科大概念如何應用于單元復習課的教學中。
二、基于學科大概念的單元復習教學實踐
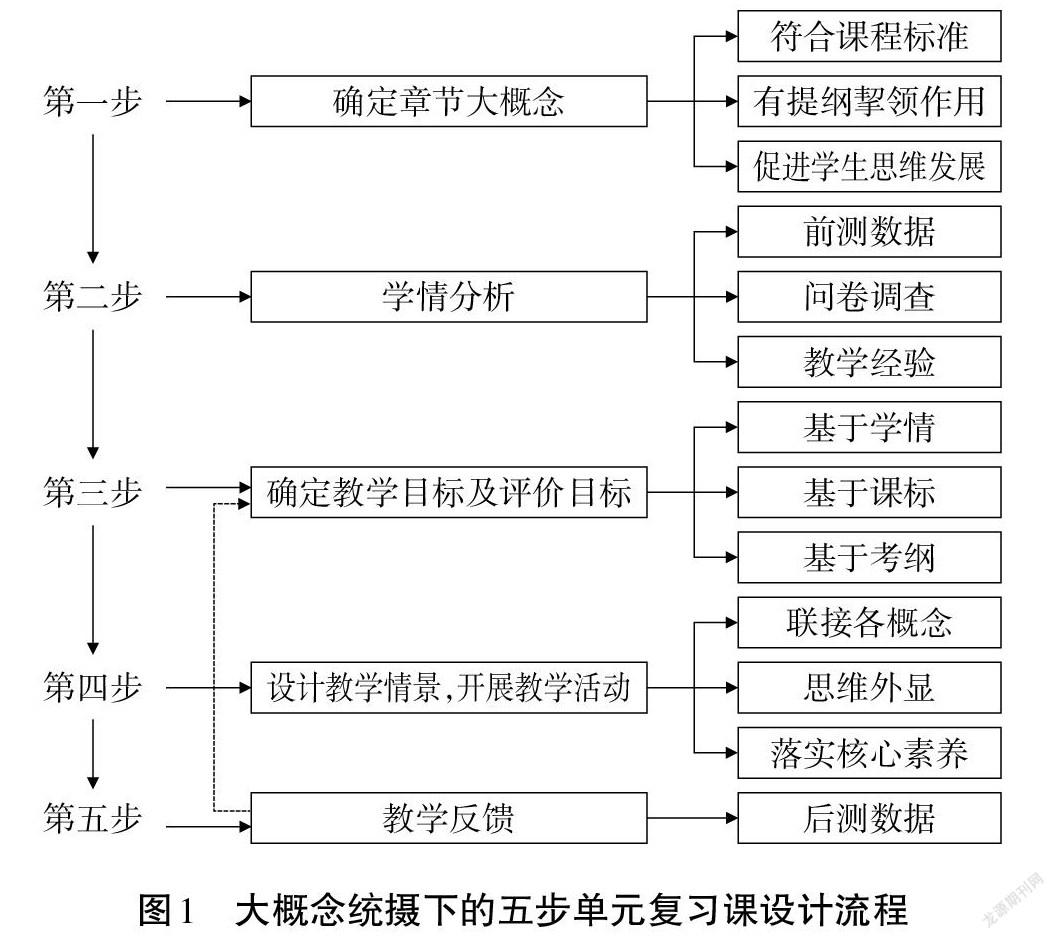
本文闡述的基于大概念單元復習課設計流程,按照五步進行。第一步,確定章節大概念。要提煉出教學內容所蘊含的學科大概念需要遵循三個原則,首先要符合課程標準;其次要提綱挈領,聯接其他小概念;再次要能夠落實思維方法培養。第二步,學情分析。精準的學情分析,有助于明確學生的認識發展點,也是制定教學目標的依據和實現精準教學的保障。為了確保學情分析結果的“精準”,需要運用技術手段分析前測數據、問卷調查數據,再結合以往教學經驗進行研判。第三步,確定教學目標及評價目標。在精準判斷學情的基礎上,結合課標、考綱精準確定教學目標及評價目標,即明確單元復習課教學之后學生應該達到的認識水平。第四步,設計教學情境,開展教學活動。教學情境需有利于讓學生思維外顯,將學科大概念與基本概念聯接起來,然后通過開展教學活動落實化學核心素養。第五步,教學反饋。即評估教學效果,實現“教、學、評”一體化,評價結果不僅是本節課終點,還是下節課的起點,從而實現“教、學、評”水平的不斷上升。大概念下的五步單元復習課設計流程見圖1。
1.確定章節大概念,構建知識結構圖
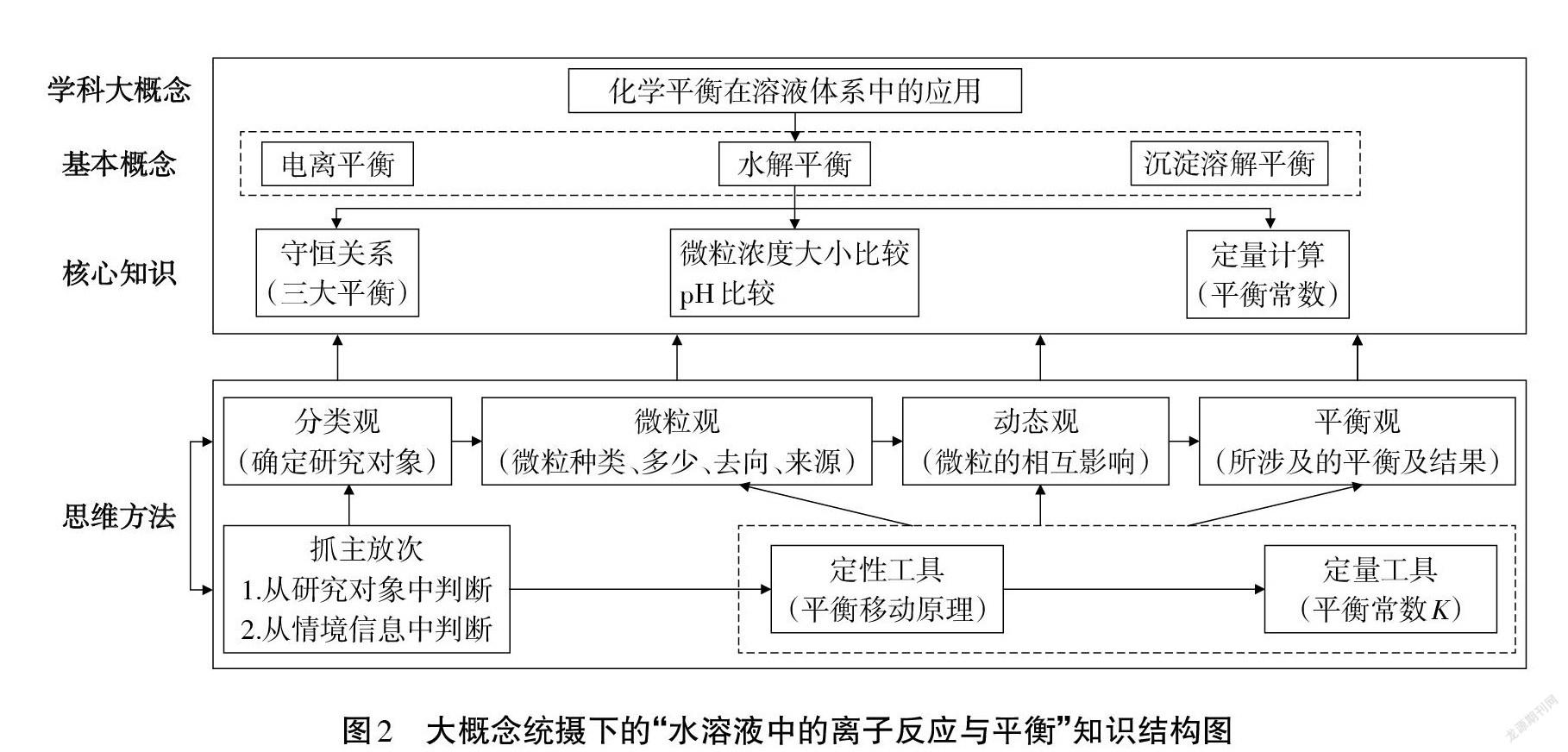
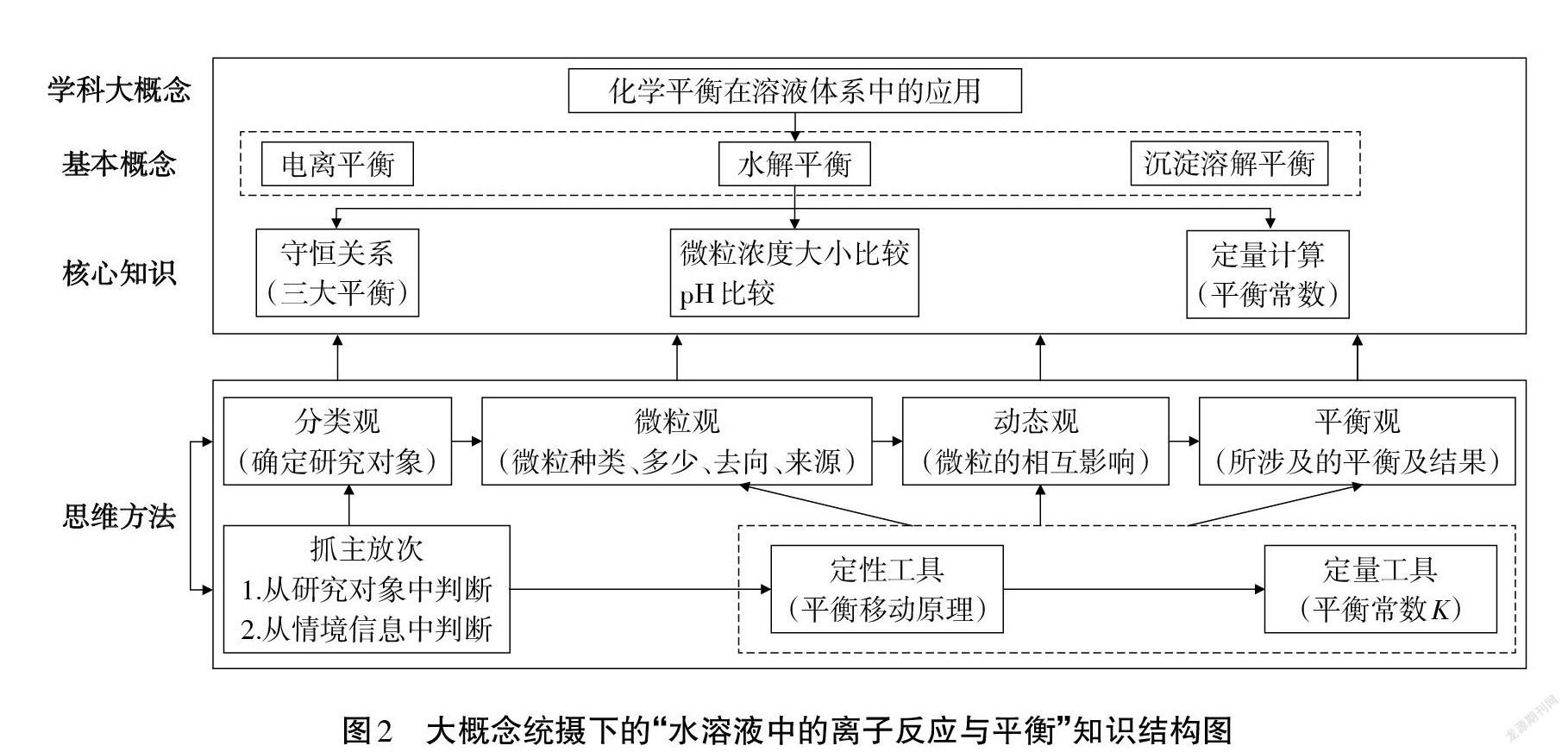
高考對“水溶液中的離子反應及平衡”的考查,偏重離子平衡的微觀過程和對于整個溶液系統的整體分析,利用化學平衡的一般思路,解決溶液中的復雜問題[3]。此章節研究的環境是:水溶液;研究的內容是:離子平衡;理論依據是:化學平衡移動原理及平衡常數。也就是用化學平衡原理來解決溶液體系中的離子平衡,實則是化學平衡的應用,因此,此章節內容涵蓋在“化學平衡在溶液體系中的應用”這一學科概念之下。該概念聯接其它內容,起提綱挈領作用,且能夠落實分類觀、微粒觀、動態觀、平衡觀等化學思維方法。因此確定為此章節的大概念,以這一大概念為統領,可提煉出圖2所示的知識結構圖,該結構圖呈現出學科大概念統攝下的基本概念、核心知識及解決此類問題的思維方法。
2.精準獲取學生學情,明確學生的認識發展點
“水溶液中的離子反應與平衡”是中學化學基本理論的一個重要部分,也是學生整個中學階段的難點。本章內容比較抽象,綜合性強,難點和易混淆點較多,因此學生的迷思概念也比較多。結合前測及問卷調查數據,可以確定學生主要存在以下認識障礙:
第一,對于化學平衡、電離平衡、水解平衡、沉淀溶解平衡的理論體系缺乏整體認識,對其適用對象沒有清晰的定位(電解質存在電離平衡還是水解平衡?出現混亂)。
第二,面對多種平衡共存時,分不清平衡的主次,導致分析問題時思維混亂。
第三,對電解質溶液的分析沒有形成良好的思維習慣和分析技能,習慣定性思維而欠缺定量思維。
第四,綜合分析問題的能力不強,不能熟練運用宏觀與微觀、定性與定量等化學學科思維方法去分析具體問題。
3.確定單元復習教學目標及評價目標,評判學生應該達到的認識水平
(1)教學目標
①通過課前梳理氨水、碳酸飲料、飽和 BaCO3溶液中存在的平衡,明確溶液中的三大平衡體系的研究對象及離子行為;并通過分析含 NaHCO3晶體的飽和溶液在水里的行為,鞏固從物質分類的角度抽取各種平衡的思維方法,落實微粒觀、變化觀。
②以NaHCO3溶液滴入FeCl3溶液、CaCl2溶液為載體,根據溶液中存在的平衡,預測宏觀現象、實驗檢驗、理論分析,在分析解決問題的過程中落實了一個思想:對于多平衡體系,要結合具體的情境抓住主要矛盾,透析問題的本質;并構建了用平衡原理解決分析問題的思維模型;落實宏觀辨識、微觀探析和證據推理、模型建構核心素養。
③通過從定量角度分析 NaHCO3、NH4HCO3溶液的酸堿性,明確研究水溶液體系中的平衡除了有定性工具——平衡移動原理,還有定量工具——K。
(2)評價目標
①通過分析不同的電解質存在的平衡,診斷學生的分類觀、微粒觀及變化觀。
②通過分析混合體系,診斷學生證據獲取能力,結合具體的情境抓住主要矛盾,透析問題本質的能力,并感受動態平衡思想的形成過程。
③通過分析電解質溶液的酸堿性,診斷學生從定量角度分析問題的能力。
4.設計教學情境,進行教學活動,落實化學核心素養,優化學生思維方法
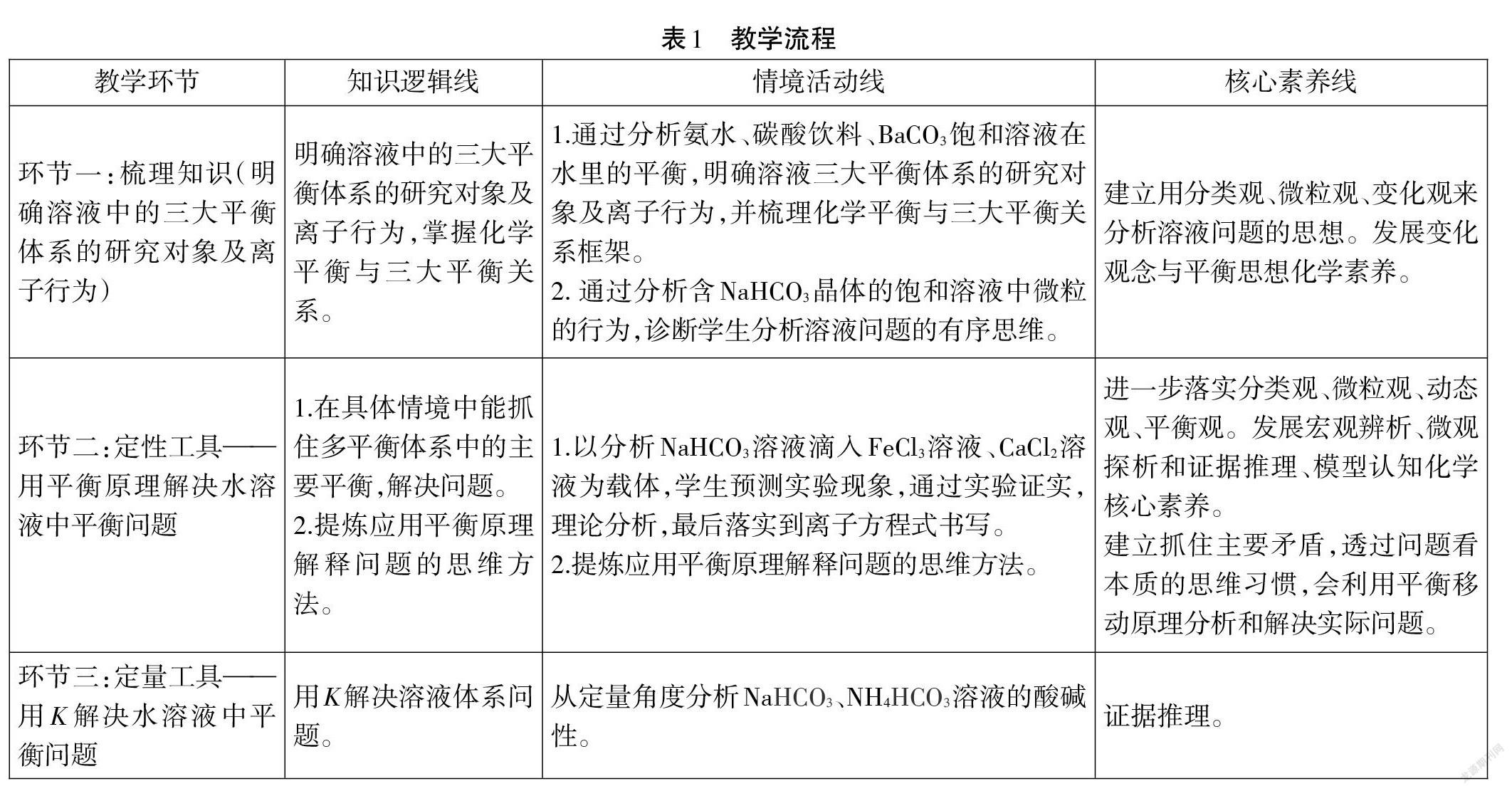
課堂教學流程見表1。
教學實錄如下。
(1)環節一:梳理知識,鞏固從物質分類的角度抽取各種平衡的思維方法,落實微粒觀、變化觀。
【學習任務1】分析氨水、碳酸飲料、飽和BaCO3溶液中存在的主要平衡。
【學生出現的問題】氨水體系存在:NH4(+)+H2ONH3· H2O+H+情況;碳酸飲料體系存在:HCO 3(-)+ H2OH2CO 3(-)+OH-情況;飽和 BaCO3漏寫 CO3(2)-的水解平衡。
【引導】先把電解質進行分類,氨水和碳酸飲料的溶質都屬于弱電解質,存在的主要平衡是電離平衡, NH4(+)及HCO 等微粒在體系中含量很少3(-),故不再分析其存在的水解平衡。飽和 BaCO3存在溶解平衡,同時 BaCO3是強電解質,在水里完全電離,故體系中存在著相對較大量的CO 故體系中應存在CO3(2)-的水解平衡。
【歸納、梳理】分析溶液中微粒行為的思維方法:溶質分類→抽取對應的平衡(溶質是弱電解質,對應的是電離平衡;溶質是鹽,對應的是水解平衡;溶質是難溶電解質或是飽和溶液,對應的是溶解平衡)→抓主放次。水溶液中三大平衡及對象,三大平衡與化學平衡的關系如圖3所示。
【課堂檢測1】一份含NaHCO3晶體的飽和溶液中,存在什么平衡?按主次順序分別寫出各個平衡。
【學生情況】有了思維方法:溶質分類→抽取對應的平衡→抓主放次,學生分析思路沒問題,但出現了 NaHCO3(s)=Na+(aq)+HCO3(-)(aq)情況。
【引導】這是混淆了電離反應式和沉淀溶解平衡。
設計意圖:以典型電解質為載體梳理電離平衡、水解平衡、沉淀溶解平衡的研究對象,對知識點進行適當的整合,消除以往對三種平衡認識上的誤區和盲點。讓學生明確溶液中的三大平衡體系的研究對象及離子行為,并通過NaHCO3體系作為課堂檢測,評價學生是否具備有序分析溶液問題的思維方法。選擇 NaHCO3晶體飽和溶液的原因,是因其剛好囊括三類平衡。首先,從分類角度來看,屬于電解質(含晶體的飽和溶液),存在溶解平衡;又可歸屬為鹽,存在水解平衡;還可歸屬為弱電解質(HCO3(-)),存在電離平衡。
(2)環節二:定性工具——用平衡原理解決水溶液中平衡問題。
【學習任務2】根據實驗現象,分析NaHCO3飽和溶液在條件變化時的離子行為(見表2)。
【演示實驗】見圖4。
【討論1】表2中條件的變化,對NaHCO3飽和溶液產生什么影響?【討論2】主要影響哪個平衡?如何影響?
【學生答題情況】根據實驗現象,部分同學能夠正確分析實驗1 的沉淀是 Fe(OH)3,實驗2 的沉淀是 CaCO3,從而能夠正確得出實驗1 主要影響 HCO3(-)的水解平衡;實驗2主要影響 HCO3(-)的電離平衡,對應的離子方程式為:3HCO3(-)+Fe3+ =Fe (OH)3 ↓ +3CO2↑;2HCO3(-)+Ca2+=CaCO3↓+ H2O+CO2↑。
出現問題一:認為沉淀是Fe2(CO3)3,離子方程式:6HCO3(-)+2Fe3+=Fe2(CO3)3↓ +3H2O+3CO2↑;出現問題二:認為沉淀是 Ca(OH)2,離子方程式為:2HCO3(-)+ Ca2+=Ca(OH)2 ↓+2CO2↑。
【學生討論得出結論】問題1:Fe2(CO3)3沉淀不存在,Fe3+與 CO3(2)-在溶液中存在雙水解,最后生成沉淀 Fe(OH)3;問題2:Ksp [Ca(OH)2]>>Ksp (CaCO3),所以沉淀CaCO3更容易析出,沉淀2是CaCO3更合理。
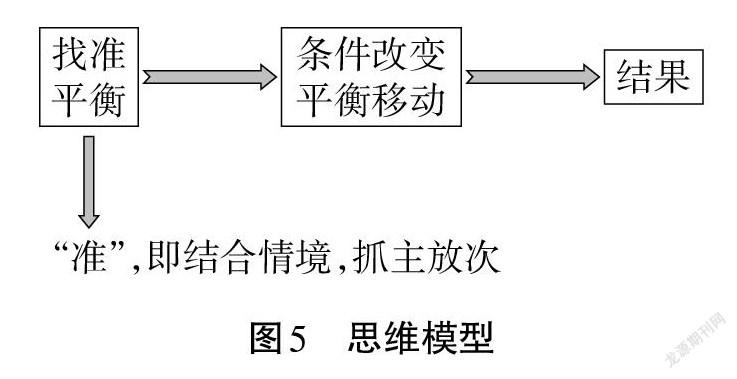
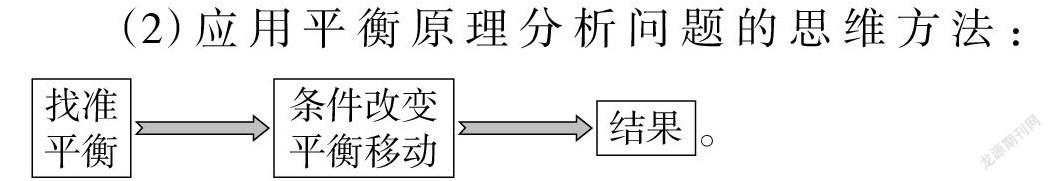
【歸納、梳理】第一,對于多平衡體系,要結合具體的情境抓住主要矛盾,透析問題的本質。
第二,提煉出應用平衡原理解釋問題的思維方法(見圖5):
【課堂檢測2】向0.1 mol · L-1 NH3· H2O 中加入 NH4Cl 晶體,溶液的pH變小,請結合化學平衡移動原理解釋原因。
【學生情況】大部分學生能根據圖5所示模型,正確分析原因。但出現個別答案:氨水中存在電離平衡 NH3· H2ONH +OH 加入的NH4Cl 晶體顯酸性,H+與OH-結合,使得OH-濃度減小,溶液的pH變小。
【學生評價】加入NH4Cl,該物質是強電解質,完全電離出NH4(+),而體系中的 H+是NH4(+)微弱水解得到的產物,故c(NH4(+))>>c(H+),因此NH 對NH4(+)3 · H2O 電離的影響大于H+,出現多個影響因素時,要抓主放次。
設計意圖:大概念統攝下的教學,充分暴露學生問題,使學生思維外顯,有利于深入理解知識的本質;建立良好的邏輯思維習慣,利用平衡觀和平衡移動原理分析和解決實際問題,在分析解決問題的過程中落實了一個思想:對于多平衡體系,要結合具體的情境抓住主要矛盾,透析問題的本質;此外構建了用平衡原理解決分析問題的思維模型;落實宏觀辨識、微觀探析和證據推理、模型認知核心素養。
(3)環節三:定量工具——用K 解決水溶液中平衡問題。
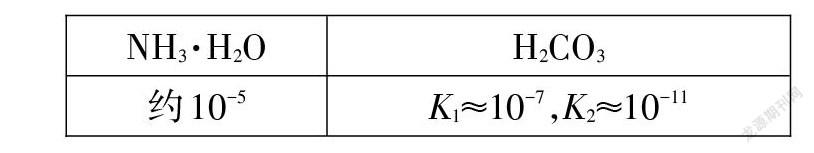
【學習任務3】已知下列物質的電離常數:
(1)NaHCO3溶液顯(),通過計算說明;
(2)NH4HCO3溶液顯(),通過計算說明。
【思路評析】求酸式鹽的酸堿性,第一步,準確判斷電離常數;第二步,計算水解常數;第三步,比較電離常數和水解常數大小,誰大顯誰性。以 NaHCO3溶液為例,Ka=Ka2≈10-11;Kh=Kw/Ka1≈10-7;Kh>Ka,而HCO3(-)水解顯堿性,故NaHCO3溶液顯堿性。
【實驗驗證】用pH試紙測定NH4HCO3溶液的pH。
設計意圖:通過從定量角度判斷物質的酸堿性,明確研究水溶液體系中的平衡除了有定性工具——平衡移動原理,還有定量工具——K。通過實驗驗證落實證據推理素養。
課堂總結:(1)水溶液體系學習的方法:找平衡(抓主放次),定性、定量兩種工具分析水溶液中平衡問題。
(2)應用平衡原理分析問題的思維方法:
學生領悟第三章學習的靈魂:找平衡(抓主放次),定性工具分析,定量工具分析。
三、教學效果與反思
1.教學效果
通過訪談,學生認為通過大概念教學后,對水溶液體系的分析思路更清楚。有以下三點收獲:①尋找水溶液體系的平衡,根據:溶質分類→抽取對應的平衡→抓主放次。②用平衡原理分析問題時,找準平衡的依據是根據題干信息;分析影響因素,而同時存在多個影響因素時要抓主放次(量大影響大或從結果逆向分析影響因素)。③明確K 的分析思路。平衡移動原理無法解決的問題,需用到平衡常數K,K 也是解決問題的工具。
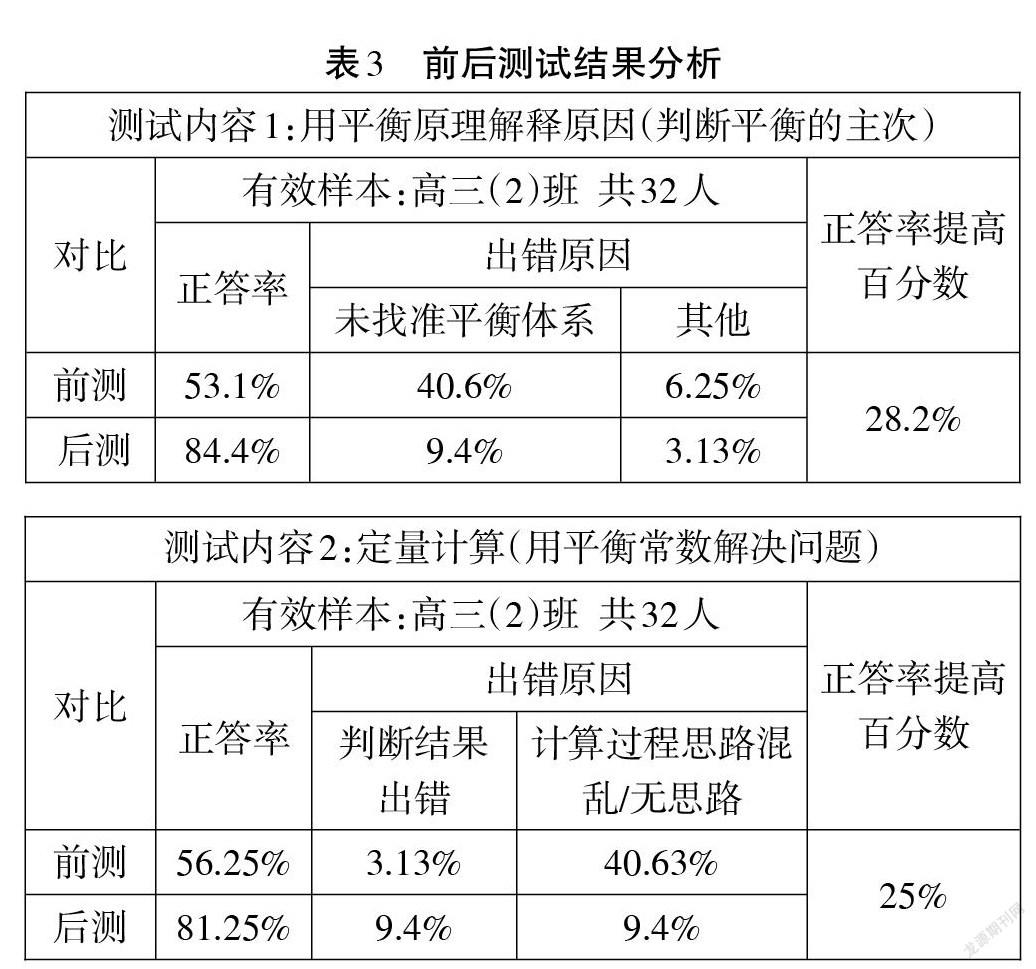
本案例采取前后測對比。測試結果表明:第一,通過大概念教學后,學生在使用平衡原理解釋問題的題型上進步明顯,正答率提高了28.2%。原來這類題型的錯因主要體現在未能正確找準體系的平衡,教學后,學生能夠在多平衡體系里,正確判斷主平衡。第二,定量計算能力進步明顯,正答率提高25%。通過教學后,此類題型的分析思路清晰。結果分析見表3。
2.教學反思
(1)“雙新雙減”背景下,基于大概念的教學可以實現“減負、提質、增效”的目的
“雙新”即新課堂新教材;“雙減”即減輕校內作業負擔,減輕校外輔導機構文化課的輔導。雙減后,教育的分層決定于課堂,高效的課堂至關重要,促思維發展的課堂才是高效的課堂。學科大概念是指向具體學科知識背后的更為本質、更為核心的概念或思想,因此,基于大概念的教學能提升學生思維能力,減輕學生的學習負擔,提高課堂質量,從實踐可看出教學效果顯著。
(2)大概念教學促學生思維能力發展
2019人教版選擇性必修1第三章“水溶液中的離子反應及平衡”,教材內容的編排順序按照“弱電解質的電離→水的電離和溶液的酸堿性→鹽類的水解→難溶電解質的溶解平衡”這樣的框架,學生關注單一知識點的學習,難以突出化學平衡理論的指導作用,學生對這些知識整合在一起的思考要薄弱些,難以建立起對水溶液體系的整體認識框架,面對綜合題時常常弄不清楚這是一個什么溶液體系,該用哪個平衡進行分析。為了彌補各知識點在新授課學習時相對孤立的不足,在進行單元復習教學時,基于學科大概念,以典型電解質為載體梳理電離平衡、水解平衡、沉淀溶解平衡的研究對象,對知識點進行適當的整合,消除以往對三種平衡認識上的誤區和盲點;從定性角度(平衡原理)、定量角度(使用平衡常數K)來指導水溶液中離子平衡的學習;在分析問題時落實了一個思想:對于多平衡體系,要結合具體的情境找準主要矛盾,透析問題的本質;搭建用平衡原理解決分析問題的思維模型。
參考文獻
[1] 王喜斌.學科“大概念”的內涵、意義及獲取途徑[J]. 教學與管理,2018(24):86-88.
[2] 黃建萍.基于學科大概念的生物單元教學設計研究[D].南昌:南昌大學,2020.
[3] 胡久華,袁麗琴,王瀾,丁芬,郇樂,趙榮梅.基于學生認識發展點的高三水溶液復習教學研究[J]. 化學教育,2014,35(13):46-51.

