煙草倍半萜合酶基因NtTPS21的克隆及功能鑒定
楊 晴,劉少華,楊長青,耿銳梅,張 釗,劉東陽,楊愛國*,李依婷*
煙草倍半萜合酶基因的克隆及功能鑒定
楊 晴1,2,劉少華1,楊長青1,耿銳梅1,張 釗3,劉東陽4,楊愛國1*,李依婷1*
(1.中國農業科學院煙草研究所,青島 266101;2.中國農業科學院研究生院,北京 100081;3.云南省煙草公司曲靖市公司云南 曲靖 655000;4.四川省煙草公司涼山州公司,四川 涼山 615000)
萜類化合物在植物生長發育、脅迫響應以及抵御病原菌侵染過程中發揮重要作用,克隆煙草倍半萜合酶基因并研究其功能可為煙草萜烯合酶的功能鑒定及抗病育種提供理論依據。本研究從普通煙草紅花大金元中克隆獲得了一個倍半萜合酶基因,通過生物信息學分析、表達模式分析、酶學性質分析以及NtTPS21代謝產物的體外抑菌試驗等方法,鑒定的生物學功能。結果表明,開放閱讀框為1671 bp,編碼556個氨基酸,具有典型的萜類合酶催化活性位點,與擬南芥倍半萜合酶AtTPS21具有較高同源性。NtTPS21定位于核質中,能夠被煙草青枯病菌感染誘導,且在青枯病抗病品種“巖煙97”中的表達水平顯著高于感病品種“長脖黃”。NtTPS21能夠以法尼基焦磷酸(FPP)為底物,催化合成倍半萜類化合物β-石竹烯,其代謝產物對煙草青枯病菌的生長具有顯著抑制效果,以上結果說明基因及其代謝產物可能與煙草青枯病抗性相關。
煙草;;倍半萜合酶;β-石竹烯;青枯病抗性
青枯病是煙草種植過程中普遍發生、危害嚴重的一種根莖類病害。煙株一旦感染青枯病,煙葉的產量和品質會受到嚴重影響,甚至造成整株死亡,給煙草產業帶來巨大的損失[1-3]。挖掘、鑒定和利用優異的青枯病抗性基因,培育抗青枯病的煙草新品種是防治煙草青枯病最根本和有效的途徑之一。
萜類化合物(又稱類異戊二烯)是自然界中普遍存在的一類天然次生代謝產物,由單個或多個異戊二烯單元組成,其中倍半萜約有7000多種,是萜類化合物中結構數量最多的一類[4-5]。植物體內的倍半萜類化合物大多為揮發性物質,在抵抗昆蟲侵害[6],抑制病原菌活性[7-8]等方面發揮重要作用,是天然植物源農藥的重要來源。大量研究發現,雙環倍半萜類化合物β-石竹烯具有較強的抑菌作用。例如牡荊揮發油(含43.12% β-石竹烯)對大腸桿菌、枯草桿菌、四聯球菌均表現出較強的抑菌效果[9],β-石竹烯對蠟樣芽孢桿菌也具有一定的抗菌活性[10]。在擬南芥中,β-石竹烯由編碼的(E)-β-石竹烯合成酶催化形成,是擬南芥花柱頭釋放的主要揮發性物質。突變可導致擬南芥花柱頭的細菌性丁香假單胞菌DC3000大量生長,而組成型過量表達的轉基因株系對DC3000的抗性顯著高于野生型,表明在植物抵御細菌性病原菌侵害過程中發揮重要作用[11-12]。
煙草基因組中存在著大量萜烯合酶(Terpene synthase, TPS)編碼基因。然而,目前對煙草TPS基因的克隆及其在抵抗病原菌方面的研究報道十分有限。為了挖掘和鑒定煙草中參與青枯病抗性的TPS基因,我們首先利用β-石竹烯標準品對煙草主要細菌性病原菌開展了平板抑菌試驗,結果發現β-石竹烯對煙草青枯病菌具有特異性抑制作用。因此本研究根據擬南芥序列,對煙草中的β-石竹烯合成酶基因進行了分析預測,克隆獲得了煙草β-石竹烯合成酶基因,命名為。通過分析的表達特征,酶學性質以及代謝產物的抑菌作用,鑒定的生物學功能,為后續深入研究萜類次生代謝物在植物抗逆脅迫中的分子調控機制及抗病育種奠定基礎。
1 材料與方法
1.1 試驗材料
普通栽培煙草()品種“紅花大金元”,用于基因克隆;“長脖黃”和“巖煙97”分別為煙草青枯病感病和抗病對照種質,由國家煙草種質資源中期庫提供。Y45青枯菌種由中國農業科學院煙草研究所遺傳育種中心提供。
1.2 方法
1.2.1 材料處理與取樣 (1)正常生長的煙草材料。煙草品種“紅花大金元”種子經消毒處理后播種在裝有滅菌土壤的花盆中,種植于人工氣候室。待煙株生長至5葉期時,收集植株葉部組織,液氮速凍后放置于?80 ℃封存,用于基因克隆。(2)青枯病原菌脅迫處理的煙草材料。煙草品種“長脖黃”和“巖煙97”種子經消毒處理后播種在裝有滅菌土壤的花盆中,種植于人工氣候室,在幼苗長至2片真葉時,更換為霍格蘭營養液進行水培培養,待生長至5葉期時,進行青枯病菌接種處理:將活化的青枯病菌Y45稀釋至600=0.01,直接替換營養液,發病條件為30 ℃,浸泡2 h后將青枯菌倒掉,更換為霍格蘭營養液繼續培養,于接種0、2、3、7 d后收集根及莖部樣品,每個試驗處理設置3個生物學重復,收集的樣品用液氮速凍后?80 ℃保存,用于基因表達特征分析。
1.2.2基因的克隆 將擬南芥AtTPS21的蛋白質序列在煙草數據庫進行同源比對,獲得煙草基因的參考序列信息,設計特異性引物-F(5'-ATGGATTTGAGCAAAGGCTTGC CGG-3')和-R(5'-TTATGGAACAGGATCA ACCAATATT-3')。提取普通煙草紅花大金元葉片總 RNA,反轉錄合成cDNA后作為基因克隆模板。使用引物-F和-R,以煙草葉片cDNA為模板進行PCR擴增,反應體系為:cDNA 2.5 μL、2×Phanta Max Master Mix 25 μL、-F和-R引物各2.5 μL,補充ddH2O至反應體系為50 μL。反應程序為:95 ℃預變性3 min;95 ℃變性15 s,55 ℃退火15 s,72 ℃延伸100 s,共35個循環;72 ℃延伸10 min。PCR產物用1%瓊脂糖凝膠電泳檢測,純化回收后連接到pEASY-Blunt Zero克隆載體。陽性克隆經測序驗證正確,獲得含有序列的克隆質粒Blunt-。
1.2.3 NtTPS21的生物信息學分析 利用ORF finder(http://www.bioinformatics.org/sms2/orf_find.html)軟件分析NtTPS21開放閱讀框及氨基酸序列;利用PSORT II Prediction(https //www.genscript.com/psort. html)預測NtTPS21蛋白的亞細胞定位;使用InterProSca(https//www.ebi.ac.uk/interpro/search/ sequence/)軟件對NtTPS21蛋白保守結構域進行預測,并與其他物種的β-石竹烯合酶進行比對,驗證其保守結構域。利用MEGA7軟件將與擬南芥的34個萜烯合酶進行比對,并通過鄰接(NJ)法構建系統發育進化樹(Bootstrap=1000)。
1.2.4表達模式分析 根據基因的編碼序列設計特異性引物-qF(5'-GCTAAGTTCTATTA CAAGGTGGTG-3)和-qR(5'-AAAGTACAC TCCCAATGCCC-3')。分別提取“長脖黃”和“巖煙97”在接種青枯病后不同時期根部和莖部的RNA并反轉錄為cDNA。以煙草基因為內參,利用2×ChamQ SYBR Color qPCR Master Mix進行qRT-PCR。試驗設置3次生物學重復和3次技術重復,采用2-△△CT方法計算的相對表達量。
1.2.5 NtTPS21的亞細胞定位 將編碼區CDS 序列(去掉終止密碼子)克隆到pBWA(V)HS-GLosgfp表達載體中,構建基因融合綠色熒光蛋白(GFP)的表達載體pBWA(V)HS--GLosgfp。將重組質粒pBWA(V)HS--GLosgfp和對照空載質粒pBWA(V)HS-Glosgfp分別轉入根癌農桿菌GV3101。以空載作為負對照,將含有目標質粒的農桿菌重懸液注射到本氏煙幼葉中進行瞬時侵染,侵染后的煙草黑暗條件下培養12 h,再于正常光照下培養2 d,將侵染部位葉片置于 LEICA TCS SP8 激光共聚焦顯微鏡下觀察,確定熒光融合蛋白的定位。
1.2.6 NtTPS21的原核表達及體外反應鑒定 NtTPS21的原核表達:將克隆到大腸桿菌高效表達載體pET28a中,并轉化BL21(DE3)感受態細胞。陽性菌株用LB培養基培養至600=0.5~0.6,加入異丙基-β-D-硫代半乳糖苷(IPTG),于16 ℃誘導培養17 h后離心收集菌體。菌體經超聲裂解后離心收集上清,進行蛋白凝膠電泳和染色,觀察蛋白誘導情況。
NtTPS21蛋白體外反應:將裂解后的菌體上清加入含有法尼基焦磷酸(FPP)的反應混合緩沖液中,于37 ℃恒溫箱反應1 h后,用正己烷提取反應產物。使用氣相色譜-質譜聯用儀(GC-MS,島津TQ8050)對反應產物進行檢測和成分分析。色譜柱為HP-INNOWAX 毛細管柱(30 mm×0.25 mm× 0.25 μm),進樣口溫度設置為250 ℃,柱室溫度50 ℃起步,以10 ℃/min的速度升溫至250 ℃,保溫5 min,氣化室和檢測室溫度均為250 ℃。
1.2.7 NtTPS21代謝產物的體外抑菌試驗 將重組至pET28a并轉入能夠高效合成FPP的大腸桿菌工程菌株中。陽性的NtTPS21工程菌株經IPTG誘導發酵培養后,通過超聲裂解并用乙酸乙酯萃取濃縮獲得NtTPS21代謝產物。以無水乙醇為溶劑,將NtTPS21代謝產物稀釋至1 g/mL、100 mg/mL、50 mg/mL;將活化的青枯菌均勻地涂于培養基中,待菌液吹干后,均勻地擺放4個6 mm無菌空白藥敏紙片,隨后在每個紙片上依次加入20 μL不同濃度的NtTPS21代謝產物以及對照無水乙醇,待樣品擴散后,于28 ℃培養箱倒置培養12~18 h,觀察測量菌圈大小。
2 結 果
2.1 NtTPS21基因的克隆及生物信息學分析
以普通煙草紅花大金元葉片cDNA為模板,PCR擴增獲得。該基因全長1671 bp,編碼556個氨基酸(等電點:5.28;分子量:64.88 kD)。序列分析結果表明(圖1A),具有3個萜烯合成酶基因家族的保守結構域,其中22-201位氨基酸為萜類合酶N末端結合域(N-terminal domain);233-500位氨基酸為萜類合酶金屬離子結合結構域(metal-binding domain);228-555位氨基酸為萜烯環化酶C端結構域(C-terminal domain)。亞細胞定位預測顯示,在細胞質、細胞核、線粒體和高爾基體中定位的概率分別為60.9%、26.1%、8.7%和4.3%,因此,該蛋白可能是位于核質中。
將擬南芥、番茄、水稻、棉花中已報道的石竹烯合酶與NtTPS21進行多序列比對分析,結果表明,NtTPS21與石竹烯合酶蛋白序列具有較高的相似性,且含有萜類合酶催化活性中心“DDXXD”、“RRX8W”和“NST/DTE”(圖1B)。
為分析NtTPS21與模式植物擬南芥萜烯合酶基因間親緣關系,通過MEGA7軟件對NtTPS21進行系統發育進化樹分析。結果表明,NtTPS21與擬南芥倍半萜合酶AtTPS21聚為同一簇(圖2),推測其具有類似的催化功能。

注:A,NtTPS21的保守結構域預測,其中a代表萜類合酶 N 末端結合域;b代表萜類合酶金屬離子結合結構域;c代表萜烯環化酶C端結構域。B,NtTPS21與其他物種石竹烯合酶的多序列比對,其中方框標注的為萜烯合酶的保守結構域“RRX8W”,“DDXXD”以及“NST/DTE”。AtTPS21:擬南芥石竹烯合酶;SlTPS12:番茄石竹烯合酶;OsTPS3:水稻石竹烯合酶;GhTPS:棉花石竹烯合酶。
2.2 NtTPS21的表達模式分析
“長脖黃”和“巖煙97”分別是煙草青枯病抗病育種研究中典型的感病和抗病對照品種。為明確是否參與煙草抗青枯病原菌脅迫過程,分別對“長脖黃”和“巖煙97”接種青枯病菌,通過qRT-PCR檢測在抗病和感病種質中的相對表達量。結果發現,在“長脖黃”和“巖煙97”中,青枯病菌侵染均能強烈誘導的表達。但是在不同的接種時間點,在抗青枯病品種“巖煙97”中的表達量均顯著高于易感青枯病的“長脖黃”。特別是在莖中,與“長脖黃”相比,在“巖煙97”中表達水平提高了20~80倍(圖3)。以上結果表明可能參與了煙草青枯病的抗性防御過程。
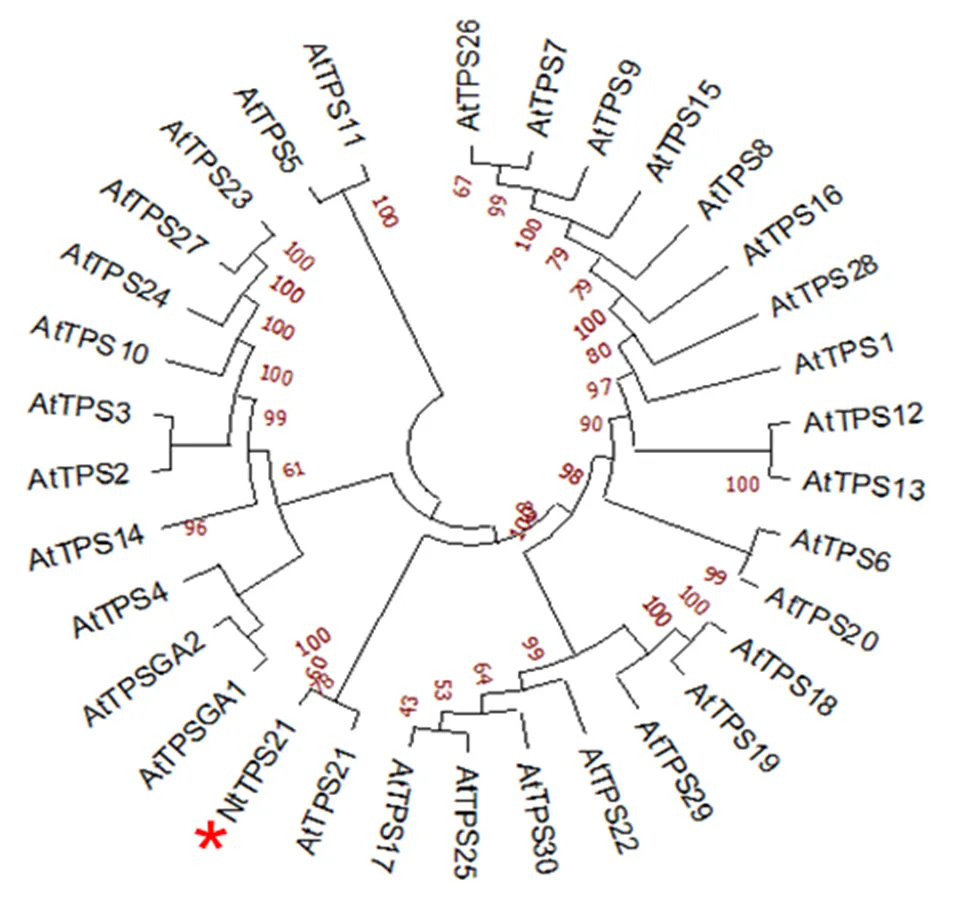
圖2 NtTPS21與擬南芥萜烯合酶家族系統進化分析

注:A,接種青枯病菌不同時間后,根中NtTPS21的相對表達;B,接種青枯病菌不同時間后,莖中NtTPS21的相對表達。不同字母表示在p<0.05水平差異顯著,下同。
2.3 NtTPS21亞細胞定位
基因的亞細胞定位對研究該基因編碼的蛋白及行使功能的場所至關重要。將含有NtTPS21融合綠色熒光蛋白(GFP)的植物表達載體和僅表達GFP的對照載體分別在本氏煙葉片中瞬時表達。通過激光共聚焦顯微鏡觀察發現,NtTPS21編碼的蛋白產物定位于核質中(圖4),這一結果與NtTPS21蛋白的亞細胞定位預測結果一致。
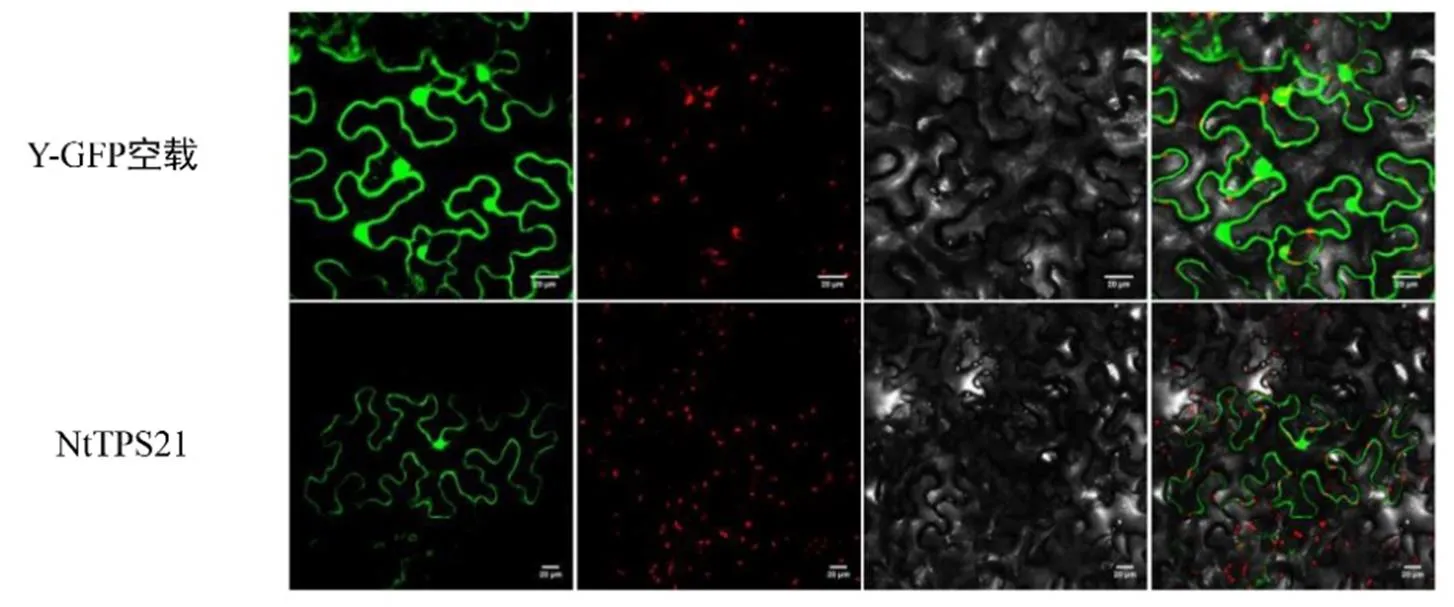
圖4 NtTPS21的亞細胞定位
2.4 NtTPS21的原核表達及酶學功能分析
為了分析NtTPS21的生化功能,將重組質粒-pET28a轉入大腸桿菌BL21(DE3)并用IPTG誘導表達。SDS-PAGE檢測結果表明在相對分子質量為65 kD附近位置出現了特異蛋白帶(圖5),該結果與NtTPS21蛋白的預測大小相一致。
以NtTPS21蛋白粗提物與底物FPP進行體外反應,用GC-MS檢測反應產物。結果發現,NtTPS21的代謝主產物為β-石竹烯(圖6),與β-石竹烯標準品的保留時間和分子碎片質譜數據均一致(圖6,7),表明NtTPS21能夠以FPP為底物生成倍半萜類物質β-石竹烯。
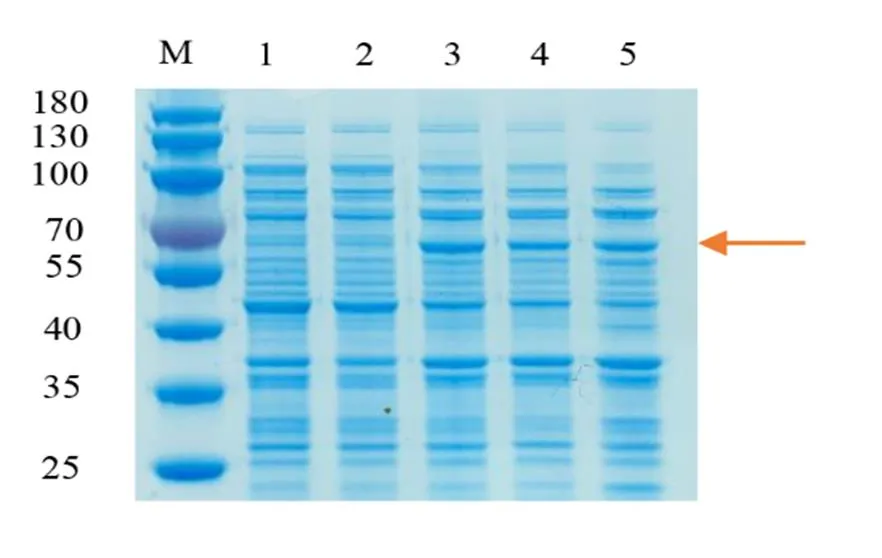
注:M,marker;1~2,0.5mmoL/L IPTG誘導的PET空載;3~4,0.5 mmoL/L IPTG誘導的NtTPS21-PET;5,未經IPTG誘導的NtTPS21-PET。紅色箭頭指示的為誘導出的NtTPS21的蛋白。

注:A,β-石竹烯標準品的GC-MS圖;B,NtTPS21蛋白與FPP底物體外反應產物的GC-MS圖;C,PET空載蛋白與FPP底物體外反應產物的GC-MS圖。
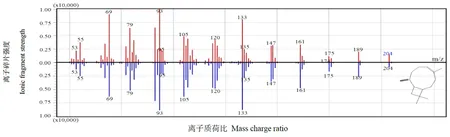
圖7 NtTPS21體外合成產物標準品β-石竹烯GC-MS分子碎片質譜對比圖
2.5 NtTPS21代謝產物對煙草青枯病菌的抑制作用鑒定
為了分析是否與煙草的青枯病抗性相關,將NtTPS21蛋白在能夠高效合成FPP的大腸桿菌工程菌株中誘導表達,獲得NtTPS21的代謝產物。將純化的NtTPS21代謝產物添加到煙草青枯病菌培養基中,通過測量抑菌圈直徑,分析NtTPS21代謝產物對煙草青枯病菌的抑制作用。結果表明,與添加無水乙醇的空白對照相比,NtTPS21的代謝產物對煙草青枯病菌的生長具有顯著抑制作用,并且其抑制強度隨濃度的升高而增強(圖8)。
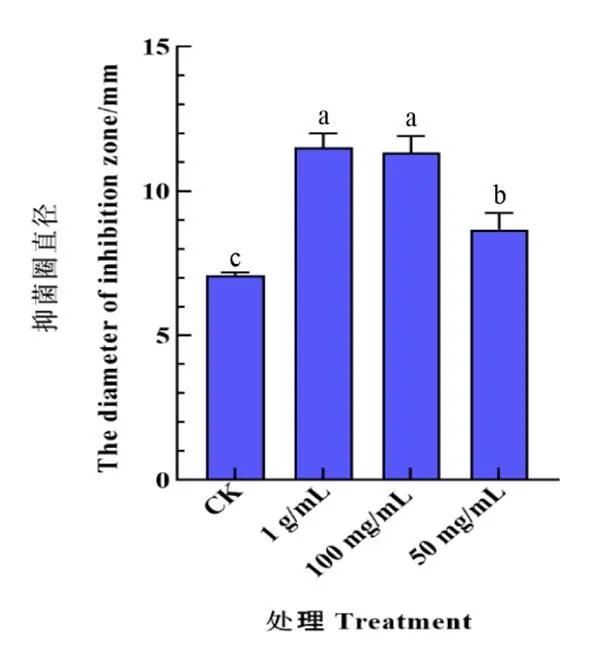
注:β-石竹烯稀釋溶劑為無水乙醇,CK為無水乙醇。
3 討 論
植物倍半萜合酶催化底物FPP釋放焦磷酸基團,形成結構多樣的倍半萜類化合物。本研究從煙草中克隆了一個倍半萜合酶基因,序列分析表明其具有萜類合酶催化活性位點“DDXXD”,“RRX8W”以及“NST/DTE”。“DDXX(D, E)”基序又稱為“α結構域”,是Ⅰ型TPS酶的典型特征,可結合與異戊二烯基二磷酸相互作用的金屬輔因子(Mg2+或Mn2+)底物并促進底物陽離子的形成[13-15]。NtTPS21即為典型的Ⅰ型TPS酶,這與報道的植物中的TPS基因家族中所有單萜、倍半萜和半萜合酶只含有功能α域相一致[16]。對NtTPS21亞細胞定位的預測和試驗均表明,NtTPS21定位于核質中,與大部分倍半萜合酶的亞細胞定位相一致。進化分析結果顯示NtTPS21與擬南芥倍半萜合酶AtTPS21聚為一類,推測其可能參與煙草中倍半萜類化合物的生物合成。體外酶學功能驗證進一步證實了NtTPS21是一個倍半萜合酶,并且能夠以FPP為底物合成β-石竹烯。
β-石竹烯是廣泛存在于植物中一類次生代謝產物,具有一定的抗菌活性,用NtTPS21代謝產物進行平板抑菌試驗,發現其對煙草青枯病菌具有顯著抑制效果,且這種抑制作用與其濃度呈正相關。目前,編碼β-石竹烯的基因已經在擬南芥、番茄、水稻、棉花、葡萄等物種中被分離鑒定,但是煙草中的石竹烯合成酶基因尚未被發現,是否參與煙草青枯病抗性防御過程也不清楚。本研究在煙草中分離鑒定了編碼β-石竹烯合成酶的基因,利用實時熒光定量qPCR技術,分析在接種青枯病菌后不同時間的表達量,結果發現能夠強烈響應青枯病菌侵染。在青枯病抗感種質中,在接種青枯病菌的抗性材料根、莖中的表達量均顯著高于在感病材料中的表達水平,說明可能參與了煙草青枯病菌的抗性防御過程,但具體調控機制還有待進一步研究,今后可通過創制組成型過量表達和定點突變基因的遺傳材料以及生理生化和分子生物學試驗,開展在煙草青枯病抗性防御中的功能機制解析,為煙草青枯病抗病育種提供理論支撐和優異分子靶標。
4 結 論
本研究在煙草中克隆獲得一個定位于核質中的倍半萜合酶基因,具有萜烯合酶典型的保守結構域,與擬南芥具有較高同源性。NtTPS21能夠以FPP為底物合成倍半萜類化合物β-石竹烯。的表達水平受青枯病菌侵染強烈誘導,且在抗病品種“巖煙97”中的表達水平顯著高于感病品種“長脖黃”。NtTPS21的代謝產物能夠顯著抑制青枯病菌的生長。說明可能參與了煙草對青枯病菌的抗性防御過程。
[1] MANSFIELD JOHN, GENIN STEPHANE, MAGORI SHIMPEI, et al. Top 10 plant pathogenic bacteria in molecular plant pathology[J]. Molecular plant pathology, 2012, 13(6): 614-629.
[2] 陳瑞泰,朱賢朝,王智發,等. 全國16個主產煙省(區)煙草侵染性病害調研報告[J]. 中國煙草科學,1997(4):3-9.
CHEN R T, ZHU X C, WANG Z F, et al. A report of investigating and studying tobacco infectious diseases of 16 main tobacco producing provinces(regions) in China[J]. Chinese Tobacco Science, 1997(4): 3-9.
[3] 徐進,顧鋼,潘哲超,等. 福建煙草青枯菌演化型及生化變種鑒定研究[J]. 中國煙草學報,2010,16(6):66-71.
XU J, GU G, PAN Z C, et al. Phylotype identification and biovar determination ofstrains isolated from Fujian province[J]. Acta Tobacaria Sinica, 2010, 16(6): 66-71.
[4] 占愛瑤,由香玲,詹亞光. 植物萜類化合物的生物合成及應用[J]. 生物技術通訊,2010,21(1):131-135.
ZHAN A Y, YOU X L, ZHAN Y G. Biosynthetic pathway and applications of plant terpenoid isoprenoid[J]. Biotechnology Communications, 2010, 21 (1): 131-135.
[5] BOHLMANN J, MEYER-GAUEN G, CROTEAU R. Plant terpenoid synthases: molecular biology and phylogenetic analysis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(8): 4126-4133.
[6] 權軍嫻. 萜類化合物在植物中的作用及其應用[J]. 植物學研究,2013,2(4):106-108.
QUAN J X. The role of terpenoids in plants and its application[J]. Botanical Research, 2013, 2(4): 106-108.
[7] SHANG S Z, ZHAO W, TANG J G, et al. Antiviral sesquiterpenes from leaves of[J]. Fitoterapia, 2016, 108: 1-4.
[8] 范炳芝,王一鑫,廉霄甜,等. 三萜類化合物抗病毒的構效關系及其作用機制研究進展[J]. 化工學報,2020,71(9):4071-4101.
FAN B Z, WANG Y X, LIAN X T, et al. Structure-activity relationships and mechanisms of triterpenoids against virus [J]. Journal of Chemical Industry and Engineering, 2020, 71(9): 4071-4101.
[9] 凌瑋瑋. 牡荊化學成分及其抑菌活性研究[D]. 合肥:安徽農業大學,2010.
LING W W. Constituents and antibacterial activities ofLinn. var.[D]. Hefei: Anhui Agricultural University, 2010.
[10] MOO C L, YANG S K, OSMAN M A, et al. Antibacterial activity and mode of action of β-caryophyllene on bacillus cereus[J]. Polish Journal of Microbiology, 2020, 69(1): 1-6.
[11] LIU M, NIU W, OU L. β-Caryophyllene ameliorates the Mycoplasmal pneumonia through the inhibition of NF-κB signal transduction in mice[J]. Saudi Journal of Biological Sciences, 2021, 28(8): 4240-4246.
[12] HUANG M S, SANCHEZ-MOREIRAS A M, ABEL C, et al. The major volatile organic compound emitted fromflowers, the sesquiterpene (E)-β-caryophyllene, is a defense against a bacterial pathogen[J]. New Phytologist, 2012, 193(4): 997-1008.
[13] CHRISTIANSON D W. Structural and Chemical Biology of Terpenoid Cyclases[J]. Chemical Reviews, 2017, 117(17): 11570-11648.
[14] ZERBE P, BOHLMANN J. Plant diterpene synthases: exploring modularity and metabolic diversity for bioengineering[J]. Trends in Biotechnology, 2015, 33(7): 419-428.
[15] 唐亮,馬香,周志欽. 植物萜類合成酶的進化研究[J]. 南京大學學報(自然科學版),2014,36(4):89-96.
TANG L, MA X, ZHOU Z Q. An evolutionary study of plant terpene synthases[J]. Journal of Nanjing University (Natural Science), 2014, 36(4): 89-96.
[16] GAO Y, HONZATKO R B, PETERS R J. Terpenoid synthase structures: a so far incomplete view of complex catalysis[J]. Natural Product Reports, 2012, 29(10): 1153-75.
Cloning and Functional Characterization of Sesquiterpene Synthase Genein Tobacco
YANG Qing1,2, LIU Shaohua1, YANG Changqing1, GENG Ruimei1, ZHANG Zhao3, LIU Dongyang4, YANG Aiguo1*, LI Yiting1*
(1. Institute of Tobacco Research of CAAS, Qingdao 266101, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. Qujing Tobacco Company of Yunnan Province, Qujing, Yunnan 655000, China; 4. Liangshan Tobacco Company of Sichuan Province, Liangshan, Sichuan 615000, China)
Terpenoids play an important role in plant growth, development, stress response and resistance to pathogen infection. Cloning the sesquiterpene synthase genes of tobacco and studying their function can provide theoretical basis for functional identification and disease resistance breeding of tobacco. In this study, a sesquiterpene synthase genewas cloned from common tobacco variety Honghuadajinyuan, and its function was identified by bioinformatic analysis, expression pattern analysis, enzyme property analysis and bacteriostatic test in vitro of NtTPS21 fermentation products. The results showed that the open reading frame ofwas 1671 bp which encoded 556 amino acids. NtTPS21 had a typical terpene synthase catalytic active site and high homology withsesquiterpene synthase AtTPS21. NtTPS21 was localized in the cytoplasm and could be induced by Granville wilt of tobacco. The expression level ofin the resistant variety “Yanyan 97” was significantly higher than that in the susceptible variety “Changbohuang”. NtTPS21 can catalyze the synthesis of sesquiterpene β -caryophyllene, which has a significant inhibitory effect on the growth of granville wilt. These results indicate thatand its metabolites may be related to the resistence tom.
;; sesquiterpene synthase; β-caryophyllene;m resistance
S572.01
A
1007-5119(2022)03-0039-08
10.13496/j.issn.1007-5119.2022.03.007
中國農業科學院科技創新工程(ASTIP-TRIC01);中央級公益性科研院所基本科研業務費專項(1610232020001);中國煙草總公司四川省公司重點科技項目(SCYC202003)
楊 晴(1998-),女,在讀碩士研究生,研究方向為植物次生代謝調控。E-mail:17806289623@163.com
,E-mail:楊愛國,yangaiguo@caas.cn;李依婷,liyiting@caas.cn
2021-11-21
2022-02-23

