烤煙醇化過程中的代謝物和脂質分析
黃桂紅,謝華利,彭黔榮,彭 興,楊 洋,惠建權,石志發,吳有祥,歐明毅,李 琰*
烤煙醇化過程中的代謝物和脂質分析
黃桂紅1,謝華利1,彭黔榮2,彭 興1,楊 洋2,惠建權2,石志發2,吳有祥2,歐明毅2,李 琰1*
(1.深圳脈圖精準技術有限公司,廣東 深圳 518000;2.貴州中煙工業有限責任公司,貴陽 550009)
為探明煙葉醇化過程中代謝物和脂質的變化規律,本研究采用氣相色譜-質譜聯用儀(GC-MS)和液相色譜-質譜聯用儀(LC-MS)相結合的方法對不同產地煙葉醇化過程中的化學成分進行了代謝組學和脂質組學分析。結果表明,醇化后的煙葉中糖類、氨基酸、脂質和核苷酸等初級代謝產物的相對含量減少,黃酮類、苯衍生物、酚類和萜類化合物等次級代謝產物則增加;進一步研究發現,上述初級代謝產物的變化隨醇化時間(1~7年)的增加而遞減,而次級代謝產物呈現逐年遞增的趨勢。同一品種云煙87(YY87)在不同產地(廣東和湖南)之間化學成分差異較大,主要為氨基酸和膜脂,而醇化后差異減小。綜上所述,代謝組學和脂質組學方法能有效區分醇化和非醇化煙葉,并且能揭示不同醇化程度煙葉的特征及不同產地對煙葉化學成分的影響。
代謝組學;脂質組學;煙葉;醇化;產地
煙草在世界范圍內廣泛種植,其生長對土壤、海拔高度、溫度、降雨量和光照要求嚴格。因此,來自不同地理位置和品種的煙葉制成的卷煙具有獨特的風味[1]。煙葉化學成分是評估煙草質量的主要指標,但鮮有采用經濟、高效的方法盡可能多地對煙葉中的化學成分進行鑒定的研究。
代謝組學和脂質組學作為一種新興的分析方法,可定性和定量分析生物的代謝物和脂質。該技術已應用于監測由于遺傳[2]和環境因素[3]而引起的煙草代謝物的變化。LI等[4]開發出一種GC-MS方法,可通過檢測44個代謝物區分來自津巴布韋和中國云南的煙葉。ZHAO等[5]通過GC-MS和毛細管電泳質譜(CE-MS)技術揭示了云南、河南和貴州烤煙中氨基酸(如苯丙氨酸、亮氨酸和酪氨酸)、糖類(如果糖、海藻糖和蔗糖)和抗氧化類物質(如奎寧酸、綠原酸和抗壞血酸)含量差異。
醇化是煙草生產的關鍵環節,其過程復雜,包括微生物作用、酶作用和化學反應[6-10]。在醇化過程中,微生物和酶由于其潛在的工業應用價值而引起了研究人員的廣泛興趣。王芳等[11]使用從茅臺酒曲中提取的香氣相關微生物處理不同部位的煙葉,發現煙葉中的香氣成分隨之升高。還有研究表明,酶處理可加速碳水化合物、含氮化合物和總揮發性生物堿的降解,最終縮短醇化時間[12]。
目前,通過代謝組學和脂質組學的方法研究烘烤和醇化過程中煙葉化學成分變化的報道較少,且目前文獻中多采用單一方法(GC-MS或LC-MS),其定性的代謝物類型和數量均比較有限。本項目基于GC-MS和LC-MS相結合的方法對煙葉的代謝組和脂質組進行了檢測分析,大大提高了極性代謝物和脂質的檢測能力,并結合Fiehn數據庫和自建數據庫進行代謝物注釋,增強了其鑒定能力。本文探討了醇化與否、醇化時間和產地3個關鍵因素對煙草品質的影響,以期為煙葉開發和利用提供理論基礎。
1 材料與方法
1.1 試劑
甲醇、甲基叔丁基醚、乙腈、異丙醇和超純水(質譜純,德國Merck公司)。甲氧胺鹽酸鹽、N-甲基-N-(三甲基硅基)三氟乙酰胺(MSTFA)、吡啶、皮質醇、氨芐西林、13C山梨糖醇和磷脂酰膽堿[PC(17:0-14:1)]購自美國Sigma Aldrich公司。質量控制標準品也購自美國Sigma Aldrich公司,其中GC-MS所用標準品參考文獻[13],檢測親水性代謝物的超高效液相色譜-質譜聯用儀(UPLC-MS)所用標準品包括脫落酸、壬二酸、兒茶素、赤霉素A3、甘氨酰苯丙氨酸、組氨酸、犬尿氨酸、煙酸、苯乙酰乙酸。檢測親脂性代謝物的UPLC-MS所用標準品SPLASH? LIPIDOMIX? Mass Spec Standard(330820L-1EA)購自美國Avanti公司。
1.2 樣本
從貴州中煙工業有限責任公司收集到來自云南、貴州、河南和福建等地的片煙樣品共19份。
1.3 試驗方法
1.3.2 醇化時間對烤煙代謝組和脂質組的影響 來自貴州遵義地區同一類型的樣本(表2),在室溫分別醇化1~7年,每年取樣1次,每次取3個重復。
表1 煙草樣品信息
Tabel 1 Tobacco samples information

樣本 IDSample ID產地Origin品種Variety存放時間/年Storage time/year是否醇化Aged or not RT_FJ_K326福建K3263是 RT_GZ_NA1貴州未知3是 RT_HN_YY87湖南云煙87(YY87)3是 RT_FJ_CB1福建翠碧一號(CB1)3是 RT_GD_YY87廣東云煙87(YY87)3是 RT_HNS_ZY100河南中煙100(ZY100)3是 RT_LN_NA2遼寧未知3是 RT_YN_NA3云南未知3是 RT_YN_NA4云南未知3是 CT_FJ_K326福建K3263否 CT_GZ_NA1貴州未知3否 CT_HN_YY87湖南云煙87(YY87)3否 CT_FJ_CB1福建翠碧一號(CB1)3否 CT_GD_YY87廣東云煙87(YY87)3否 CT_HNS_ZY100河南中煙100(ZY100)3否 CT_LN_NA2遼寧未知3否 CT_YN_NA3云南未知3否 CT_YN_NA4云南未知3否

表2 煙草樣品醇化時間
1.4 煙葉代謝組和脂質組檢測
1.4.1 樣本制備 將每份樣品的葉片按照表型性狀(如:色澤、葉脈含量)進行分類,剪碎,去主支脈,再從不同分類的樣品中取等份的碎片化的樣品進行混合以減少試驗誤差,隨機分成3份,制備均質樣品。稱取20 mg樣本在液氮中快速冷凍,隨后使用Retsch MM440均質機研磨成均勻粉末。參考文獻[14]對均質樣品進行極性代謝物和脂質提取。含有親脂性代謝物(脂質)的上層轉移到離心管中,用于UPLC-MS檢測(C8-UPLC-MS)。含有親水性代謝物(極性代謝物)的下層轉移并分成2份,分別用于GC-MS和UPLC-MS檢測(C18-UPLC-MS)。
1.4.2 分析條件 氣相色譜質譜聯用儀(GC-MS)分析:樣品經衍生化后[13],注入到配有Rxi?-5Sil MS色譜柱(Restek 30 m * 0.25 mm * 0.25 μm)的氣相色譜系統(7890B,美國Agilent)和飛行時間質譜系統(PEGASUS-BT,美國Leco)檢測。采用高純度氦氣用作載氣,流速為1 mL/min。氣相色譜升溫程序為:初始溫度50 ℃,保持2 min,15 ℃/min連續升溫至330 ℃,保持2 min。進樣口主要參數為:280 ℃,分流進樣(10∶1)。質譜主要參數為:電子電離源(EI),溫度250 ℃,電子能量70 eV;掃描范圍50~500 amu,檢測電壓1.2 kV。
UPLC-MS極性代謝物/脂質分析:將干燥樣品分別加入200 μL水(親水性化合物)或乙腈/異丙醇混合液(/=7/3)(親脂性化合物)重新溶解并上機。兩臺UPLC-MS包括Waters ACQUITY超高效液相色譜系統和Thermo Fisher Q-Exactive質譜儀,配置電噴霧電離源(ESI)。對于親水性化合物分析,使用Waters ACQUITY HSS T3色譜柱(2.1 mm×100 mm,1.8 μm)。對于親脂性化合物,使用Waters ACQUITY BEH C8柱色譜柱(2.1 mm×100 mm,1.7 μm)。流動相組成和ESI參數參考文獻[15]。
1.4.3 質量控制 樣本采用隨機序列,在數據采集序列前中后均插入代謝物混合標準品和質控樣本(QC),以確保儀器狀態良好。QC樣本由試驗所使用的煙葉樣本等量混合而成。
1.5 數據處理與統計分析
GC-MS的數據只保留峰高大于5000的特征峰,原始譜圖進行基線校正并轉換為通用數據表(NetCDF),導入到“R語言”(4.0版本)中分析。應用TargetSearch數據包[16]將保留時間轉換為保留指數(RI),經過峰提取、峰對齊,最后使用Fiehn數據庫進行注釋[17]。
UPLC-MS的數據,僅保留峰高大于100?000的特征峰,并根據自建質譜數據庫進行注釋[18]。將質量準確度[19]低于6×10-6且保留時間(RT)偏差低于0.09 min的特征峰篩選保留用于下一步分析。
何謂統計量?它是指抽樣統計中觀察頻數與期望頻率之間可能存在著差異,統計量的基本想法是對每一個差取平方,然后除以期望頻率再取和,就得到一個統計量,該統計量就稱為統計量,即
數據按煙葉干質量進行均一化處理后,使用MetaboAnalyst 5.0(https://www.metaboanalyst.ca/)進行主成分分析(PCA),并用偏最小二乘判別分析法(PLS-DA)建立模型。PLS-DA通過置換試驗進行驗證。箱型圖由MetaboAnalyst 5.0繪制導出,熱圖由Office Excel繪制。VIP > 1.5和方差分析<0.01的差異物質作為潛在生物標記物進行后續分析。
2 結 果
2.1 煙草代謝組學綜合分析
對同一樣品進行一次提取,同時使用GC-MS,C18-UPLC-MS和C8-UPLC-MS 三個平臺共5次高通量檢測(含LC平臺的正負模式),提高了煙葉中極性代謝物和脂質的覆蓋率。本試驗共檢測到7155個不同的特征峰,結合Fiehn數據庫和自建數據庫注釋得到1039個代謝物,包括脂質、碳水化合物、氨基酸、核苷酸、參與能量代謝的代謝物和次級代謝產物,如黃酮類、苯丙烷類和萜類化合物(圖1)。其中,C8-UPLC-MS平臺檢測到多類脂質,包括脂肪酸(FA)、甘油三酯(TAG)、磷脂酰膽堿(PC)、磷脂酰乙醇胺(PE)和雙半乳糖甘油二酯(DGDG)等。
2.2 醇化對煙葉代謝組的影響
由PCA圖(圖2)可看到,醇化3年的煙葉和冷庫保存(非醇化)的同批煙葉代謝組雖有部分重疊(圖2A),但總體呈分開的趨勢。從PLS-DA模型(圖2B)中可觀察到醇化和非醇化煙葉組在圖中分開(2和2分別為0.90和0.85,預測準確度為0.98)。
差異代謝物(VIP>1.5,<0.01)通過Classyfire(https://cfb.fiehnlab.ucdavis.edu/)進行化學分類,并通過熱圖進一步分析發現(熱圖略,代表性差異物見圖3),與非醇化煙葉相比,醇化煙葉中的大多數代謝物含量降低,例如:氨基酸(色氨酸、賴氨酸、絲氨酸)、核苷酸(鳥苷、脫氧腺苷、3'-AMP、3'-CMP等)、糖類(蔗糖、潘糖、甘露糖等)、多元醇(綠原酸、莽草酸)和黃酮苷(異牡荊素、槲皮素3-O-丙二酰葡萄糖苷)。而大多數黃酮類化合物(沒食子兒茶素、楊梅素、大豆苷)、苯衍生物[4-(甲氨基)苯甲酸、2-氨基苯酚、龍膽酸等]、酚類(辛弗林、3,4-二羥基芐胺等)和新樅酸等次級代謝產物在醇化組中含量增加。上述結果說明,煙葉的代謝物組成在醇化過程中發生了極大變化,初級代謝產物和部分糖類物質的含量呈下降趨勢,而多數次級代謝產物含量增加。

注:LP和LN分別表示C8-UPLC-MS在正離子和負離子模式下獲得的數據。PP和PN分別代表C18-UPLC-MS在正離子和負離子模式下獲得的數據。GC表示來自GC-MS的數據。

圖2 醇化(RT)和非醇化(CT)煙葉的PCA(A)和PLS-DA(B)分析

注:y軸,log2轉換結果。Note: Y axis, log2 conversion result.
2.3 醇化時間對煙葉代謝產物譜的影響
為了進一步比較不同醇化時間(1至7年)煙葉代謝譜的差異,將其代謝組學結果的差異通過PCA分析呈現出來(圖4)。第一個主成分(PC1)貢獻率占40.8%,可以區分醇化時間長短引起的化學成分變化,其中最大的組分變化發生在醇化第二年,之后變化幅度逐年減小。醇化5年及以上的樣品,第二個主成分(PC2)表明其變化較前幾年顯著。潛在的原因可能是,與醇化4年或更短時間的樣品相比,這些樣品因放置較久,表面的微生物感染情況復雜。在收集樣品過程中,觀察到醇化10年的煙葉已經部分發霉(未放入試驗組中)。此外,通過熱圖(略)比較了不同醇化時間對煙葉代謝產物譜的影響,結果顯示(圖5)與2.2發現的結果相似,核苷酸(2',3'-cCMP,3'-CMP)、糖類(潘糖,蔗糖)和脂質(PC 34:3)隨醇化時間的增加而遞減,而其他大部分物質,如酰基化氨基酸(N-甲酰天冬氨酸)、脂肪酸(木蠟酸)、酚類(3,4-二羥基芐胺)和苯類(2-氨基苯酚)等,則逐年遞增。此結果結合感官評價有望指導最佳醇化時間的確定。

注:Y1-7,醇化時間1至7年。
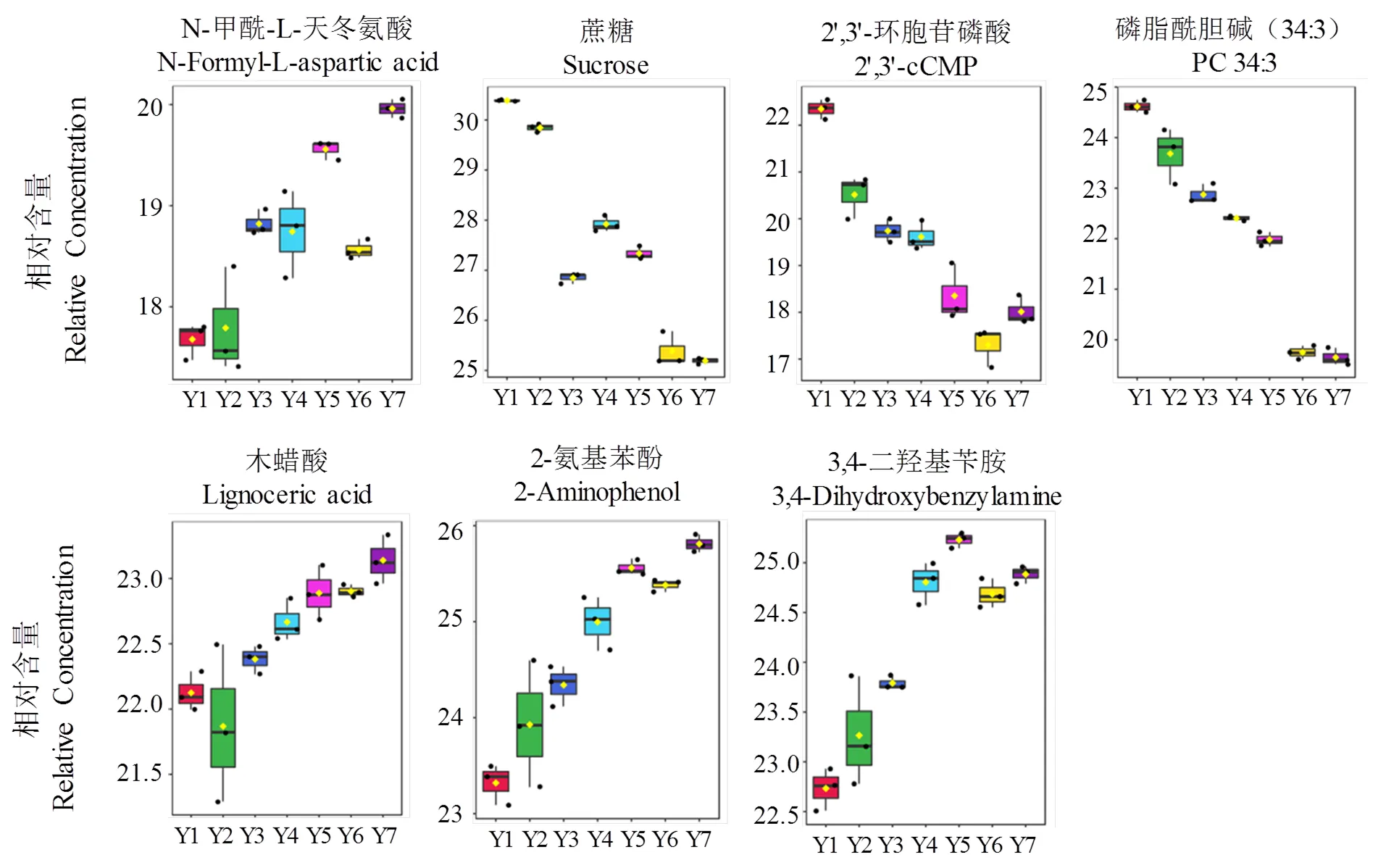
圖5 1至7年醇化的煙葉中部分有代表性差異代謝物的箱型圖
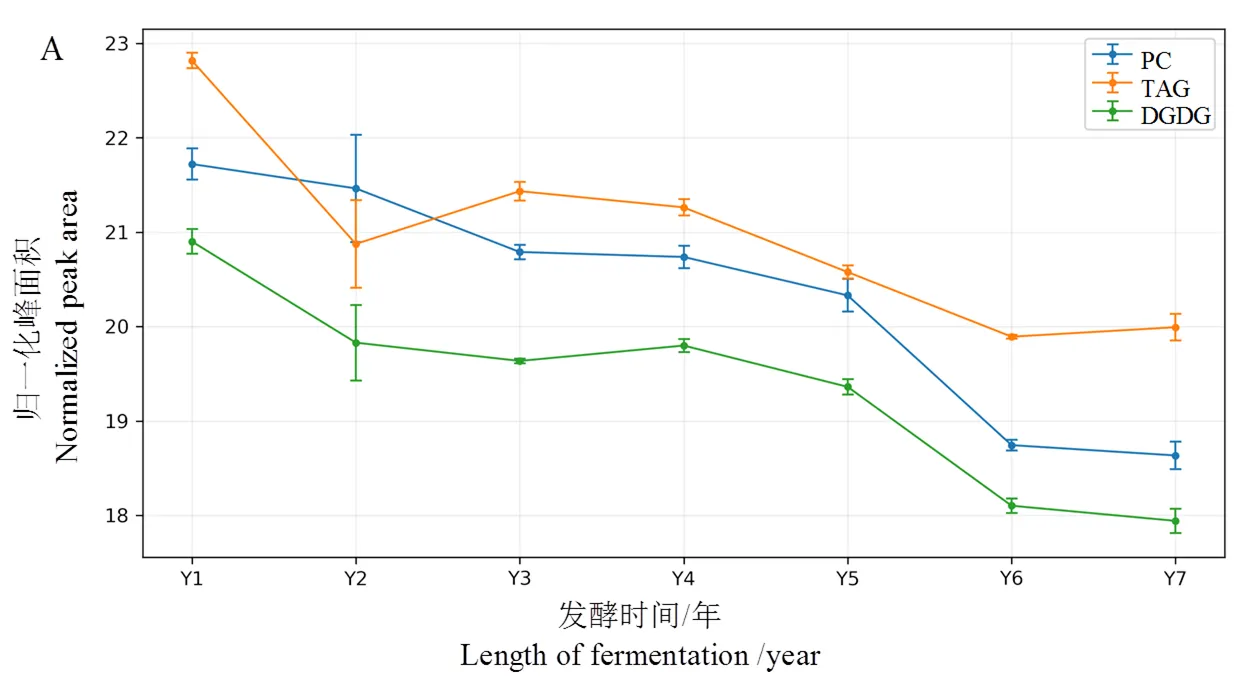
從圖6A中可以看出,脂質(TAG、PC、DGDG)隨醇化時間的延長而逐漸減少,且TAG含量在第2年下降最快,DGDG次之,PC含量變化較緩慢。脂肪酸的含量(圖6B)則隨醇化時間的延長而增加。結果表明,TAG首先被消耗,其次是DGDG,最后是膜磷脂。
2.4 產地對煙葉代謝產物譜的影響
通過PCA分析展現了分別在廣東(GD)和湖南(HN)栽培的同品種云煙87(YY87)煙葉在醇化前后的代謝差異(圖7),其中PC1可區分醇化與否,PC2可區分產地(廣東和湖南)。這種產地差異可歸因于膜脂(如PC、PE、DGDG)、氨基酸、核苷酸和糖類(圖8)。醇化前,非生物膜脂質(Non-membrane lipids)如TAG在廣東和湖南中顯示出微小差異(圖8-9);醇化后(圖8),廣東產地的煙葉膜脂(PC、PE、DGDG)含量無顯著變化,而湖南產地的煙葉膜脂降低至與廣東產地的相同水平,兩地間膜脂的差異消失。該結果表明產地影響煙葉的代謝譜,而醇化使兩地間的膜脂和氨基酸的含量差距縮小。

注:RT和CT分別表示醇化煙葉和非醇化煙葉。GD和HN分別表示來自廣東和湖南的煙葉。

注:化合物名稱中紅色字體表示醇化后含量升高,藍色表示含量降低。
3 討 論
本研究采用GC-MS,C18-UPLC-MS和C8-UPLC-MS三個平臺聯合使用的方法,研究了不同醇化程度、醇化時間和產地對煙草代謝譜的影響,大大提高了所檢測樣品中代謝物的覆蓋率。
對不同醇化程度煙葉的研究發現,賴氨酸、色氨酸等常見氨基酸,蔗糖、葡萄糖和甘露糖等還原糖顯著減少,與前人的研究結果一致[20]。它們的減少與其自然氧化和微生物降解有關。在醇化過程中,氨基化合物和還原糖之間的非酶糖化反應會形成許多香氣成分[21]。
在醇化煙葉中觀察到核苷酸和堿基呈下降趨勢。在死亡的生物體中,堿基胸腺嘧啶經常隨著時間的推移而被氧化成乙內酰脲[22]。醇化煙葉中莽草酸含量顯著降低,莽草酸是芳香族氨基酸、色氨酸、苯丙氨酸和酪氨酸的前體。酪氨酸可被代謝產生苯丙烷類化合物,進而形成黃酮、香豆素、單寧和木脂素。綠原酸是煙葉中的主要多酚,對香煙的香味有積極的貢獻,其在醇化煙葉中的濃度降低可能是由于被氧化。
尼古丁含量是煙葉產品質量的一個重要指標。由本研究的結果觀察到醇化后尼古丁濃度顯著降低,與已有研究[23]一致。同時,尼古丁的前體物質煙酰胺和尼古丁的代謝產物偽氧尼古丁的相對含量也在醇化后顯著降低。這證實醇化降低了煙葉中尼古丁和相關代謝物的含量。

圖9 GD_YY87和HN_YY87之間差異脂質的箱型圖
研究中所提及的黃酮類、苯類和酚類化合物廣泛分布于植物中。經過醇化后,包括楊梅素、沒食子兒茶素、大豆苷和香豆蔻素在內的大多數黃酮類化合物的含量顯著增加。相反,黃酮苷、異牡荊素或芹菜素以及槲皮素3-O-丙二酰糖苷的含量在醇化后降低。在醇化過程中,黃酮類化合物的糖苷形式緩慢轉化為苷元形式。
研究還比較了不同醇化時間對煙葉代謝產物譜的影響,結果顯示酰基化氨基酸的含量逐年上升,此發現未在其他煙草文獻中報道。蔗糖、潘糖和葡萄糖醛酸等糖類化合物的濃度逐年降低,而N-乙酰胞壁酸和葡萄糖醛酸-3,6-內酯呈現相反的趨勢。N-乙酰胞壁酸作為細菌細胞壁中肽聚糖的關鍵成分,也是已知的細菌污染標志物。N-乙酰胞壁酸的相對濃度隨著醇化時間的延長而增加,這證明醇化煙葉中存在細菌。
隨著醇化時間的延長,TAG、PC、DGDG等脂質顯著減少(圖6A),而脂肪酸的濃度顯示出相反的趨勢(圖6B),其濃度的增加可能是脂質降解的結果。TAG是一種有效的碳和能量存儲形式,PC和PE是植物細胞膜中兩種常見的磷脂[24],它們會逐漸被水解或氧化。這些反應可在光、熱、酶和/或微生物的存在下被催化,TAG分解為甘油和脂肪酸[25],這就解釋了TAG減少和脂肪酸增加的原因。DGDG、MGDG等半乳糖脂是植物光合類囊體膜中含量最豐富的脂質[26]。結果表明,煙葉醇化過程中TAG首先被消耗,其次是DGDG,最后是膜磷脂,該發現在本文中首次提出,具體機理有待更進一步研究。
鄭慶霞等[27]曾發現產地對煙草的代謝譜的影響甚至大于品種對代謝譜的影響,但并未深入研究其影響的具體物質。本研究發現在不同產地(湖南和廣東)的同一品種煙葉(云煙87)所表現出的化學成分差異主要在于膜脂(如PC、PE、DGDG)、氨基酸、二肽、核苷酸和糖類。
4 結 論
結果表明,醇化加工和產地不同對煙葉的代謝產物有較大影響。在醇化樣品中,氨基酸(色氨酸、賴氨酸、絲氨酸)、核苷酸(腺苷、脫氧腺苷、3'-AMP、3'-CMP等)、糖類(蔗糖、潘糖、甘露糖等)和多元醇(綠原酸、莽草酸)、黃酮苷(異牡荊素或芹菜素、槲皮素3-O-丙二酰葡萄糖苷)的含量減少,而大多數黃酮類化合物(沒食子兒茶素、楊梅素、大豆苷)、苯類[4-(甲氨基)苯甲酸)、2-氨基苯酚、龍膽酸等]、酚類(辛弗林、3,4-二羥基芐胺等)和新樅酸等萜類化合物含量增加。醇化時間延長可以進一步增強這些影響。此外,不同產地的烤煙葉的代謝特征存在明顯差異。代謝組學和脂質組學可用于研究不同產地和醇化時間對煙草產品的代謝特征的影響,從而將這些發現應用到煙葉加工和香煙制備工藝評估和優化中。
[1] LI L, LU X, ZHAO J, et al. Lipidome and metabolome analysis of fresh tobacco leaves in different Geographical regions using liquid chromatography-mass spectrometry Lipidomics[J]. Analytical and Bioanalytical Chemistry, 2015, 407(17): 5009-5020.
[2] ALMEIDA A M, VILLALOBOS E, ARAúJO S S, et al. Transformation of tobacco with angene involved in trehalose biosynthesis increases tolerance to several abiotic stresses[J]. Euphytica, 2005, 146(1-2): 165-176.
[3] ZHANG L, WANG X, GUO J, et al. Metabolic profiling of Chinese tobacco leaf of different geographical origins by GC-MS[J]. Journal of Agricultural and Food Chemistry, 2013, 61(11): 2597-2605.
[4] LI Y, PANG T, LI Y L, et al. Gas chromatography-mass spectrometric method for metabolic profiling of tobacco leaves[J]. Journal of Separation Science, 2011, 34(12): 1447-1454.
[5] ZHAO Y, ZHAO C, LU X, et al. Investigation of the relationship between the metabolic profile of tobacco leaves in different planting regions and climate factors using a pseudotargeted method based on gas chromatography/mass spectrometry[J]. Journal of Proteome Research, 2013, 12(11): 5072-5083.
[6] JAMES J. Studies on the fermentation of[J]. Acta microbiologica Academiae Scientiarum Hungaricae, 1965, 12: 45-48.
[7] ZHOU J, YU L, ZHANG J, et al. Characterization of the core microbiome in tobacco leaves during aging[J]. Microbiologyopen, 2020, 9: 1-13.
[8] DI G M, PAOLINO M, SILVESTRO D, et al. Microbial community structure and dynamics of dark fire-cured tobacco fermentation[J]. Applied and Environmental Microbiology, 2007, 73(3): 825-837.
[9] WANG J J, XU Z C, FAN J L, et al. Effects of X-ray irradiation on the microbial growth and quality of flue-cured tobacco during aging[J]. Radiation Physics and Chemistry, 2015, 111: 9-13.
[10] KOEPPE D E, ROHRBAUGH L M, RICE E L, et al. The effect of age and chilling temperature on the concentration of scopolin and caffeoylquinic acids in tobacco[J]. Physiologia Plantarum, 1970, 23(2): 258-266.
[11] 王芳,歐明毅,楊超,等. 茅臺酒致香微生物對煙葉致香成分影響[J]. 貴州農業科學,2018,46(6):89-93.
WANG F, OU M Y, YANG C, et al. Effect of different aroma microbes extracted from Moutai distiller’s yeast on aroma components in tobacco [J]. Guizhou Agricultural Sciences, 2018, 46 (6): 89-93.
[12] 夏炳樂,顏春雷. 生物酶制劑提高煙葉醇化質量[J]. 煙草科技,2007(11):13-17.
XIA B L, YAN C L. Improvement of tobacco quality with enzyme during aging[J]. Tobacco Science & Technology, 2007(11): 13-17.
[13] FIEHN O. Metabolomics by gas chromatography-mass spectrometry: Combined targeted and untargeted profiling[J]. Current Protocols in Molecular Biology, 2016, 114: 30.4.1-30.4.32.
[14] SALEM M A, JüPPNER J, BAJDZIENKO K, et al. Protocol: a fast, comprehensive and reproducible one-step extraction method for the rapid preparation of polar and semi-polar metabolites, lipids, proteins, starch and cell wall polymers from a single sample[J]. Plant Methods, 2016, 12: 45.
[15] GIAVALISCO P, K?HL K, HUMMEL J, et al. 13C isotope-labeled metabolomes allowing for improved compound annotation and relative quantification in liquid chromatography-mass spectrometry-based metabolomic research[J]. Analytical Chemistry, 2009, 81: 6546-6551.
[16] CUADROS-INOSTROZA á, CALDANA C, REDESTIG H, et al. TargetSearch - a bioconductor package for the efficient preprocessing of GC-MS metabolite profiling data[J]. BMC Bioinformatics, 2009,10: 428-430.
[17] FIEHN O, KOPKA J, TRETHEWEY R N, et al. Identification of uncommon plant metabolites based on calculation of elemental compositions using gas chromatography and quadrupole mass spectrometry[J]. Analytical Chemistry, 2000, 72(15): 3573-3580.
[18] ZHANG Q, WU S, LI Y, et al. Characterization of three different classes of non-fermented teas using untargeted metabolomics[J]. Food Research International, 2019, 121: 697-704.
[19] ARREBOLA-LIéBANAS F J, ROMERO-GONZáLEZ R, GARRIDO FRENICH A, et al. applications in high resolution mass spectrometry: food safety and pesticide residue analysis[M]. Amsterdam: Elsevier, 2017.
[20] WAHLBERG I, KARLSSON K, AUSTIN D J, et al. Effects of flue-curing and ageing on the volatile basic constituents of virginia tobacco[J]. Phytochemistry, 1977, 16(8): 1233-1235.
[21] 王瑩. 美拉德反應的工藝條件優化及其產物的GC-MS鑒定、卷煙加香應用研究[D]. 鄭州:河南農業大學,2009.
WANG Y. Study on optimization of the process conditions, the products of GC/MS identification and application in cigarettes flavoring of maillard reaction[D]. Zhengzhou: Henan Agricultural University, 2009.
[22] HOFREITER M, SERRE D, POINAR H N, et al. Ancient DNA[J]. Nature Reviews Genetics, 2001, 2(5): 353-359.
[23] ZHAO L, ZHU C, GAO Y, et al. Nicotine degradation enhancement by Pseudomonas stutzeri ZCJ during aging process of tobacco leaves[J]. World Journal of Microbiology and Biotechnology, 2012, 28: 2077-2086.
[24] CAHOON E B, DIETRICH C R, MEYER K, et al. Conjugated fatty acids accumulate to high levels in phospholipids of metabolically engineered soybean andseeds[J]. Phytochemistry, 2006, 67(12): 1166-1176.
[25] 邱立友,趙銘欽,岳雪梅,等. 烤煙發酵高效菌株的篩選[J]. 河南農業大學學報,2000,34(3):232-235.
QIU L Y, ZHAO M Q, YUE X M, et al. Screening of efficient strains for the fermentation of flue-cured tobacco[J]. Henan Agricultural Sciences, 2000, 34(3): 232-235.
[26] SHIMOJIMA M, OHTA H. Critical regulation of galactolipid synthesis controls membrane differentiation and remodeling in distinct plant organs and following environmental changes[J]. Progress in Lipid Research, 2011, 50(3):258-266.
[27] 鄭慶霞,劉萍萍,陳霞,等. 基于氣質和液質聯用技術的煙草鮮煙葉代謝組學分析流程[J]. 煙草科技,2019,52(6):59-71.
ZHENG Q X, LIU P P, CHEN X, et al. Metabolomic workflow and analysis of fresh tobacco leaves based on GC-MS and LC-MS[J]. Tobacco Science & Technology, 2019, 52(6): 59-71.
Metabolite and Lipid Profiling of Flue-cured Tobacco Leaves during Aging
HUANG Guihong1, XIE Huali1, PENG Qianrong2, PENG Xing1, YANG Yang2, HUI Jianquan2, SHI Zhifa2, WU Youxiang2, OU Mingyi2, LI Yan1*
(1. Metanotitia Co., Ltd, Shenzhen, Guangdong 518000, China; 2. The Technology Center of China Tobacco Guizhou Industry Co., Ltd, Guiyang 550009, China)
In order to explore the metabolic and lipidomic changes of tobacco leaves during aging, an integrated analytical approach using both gas chromatography-mass spectrometry (GC-MS) and liquid chromatography-mass spectrometry (LC-MS) was used to chemically profile flue-cured tobacco leaves from different origins. The results showed that primary metabolites such as carbohydrates, amino acids, lipids, and nucleotides decreased significantly in tobacco leaves after aging, however, increased abundance of secondary metabolites including flavonoids, benzenoids, phenols, and terpenoids was observed. Additionally, during the aging time of 1 to 7 years, the above mentioned primary metabolites continuously decreased with the extension of aging time, while the secondary metabolites showed an opposite trend. The cultivar YY87, which was cultivated in Guangdong and Hunan, showed great chemical compositional differences atdifferent cultivation origins. These differences were attributed to amino acids and membrane lipids, however, the differences decreased after aging. In conclusion, the metabolomics and lipidomics methods can effectively distinguish aged and non-aged tobacco leaves, reveal the characteristics of tobacco leaves with different aging degrees, and the effects of different producing areas on the chemical composition of tobacco leaves.
metabolomics; lipidomics; tobacco leaves; aging; origin
TS41+1
A
1007-5119(2022)03-0078-09
10.13496/j.issn.1007-5119.2022.03.012
黃桂紅(1990-),女,碩士,研究方向為代謝組學。E-mail:guihong.huang@metanotitia.com。
,E-mail:yan.li@metanotitia.com
2021-10-15
2022-01-24

