cid-miR-146a在LCDV-cn感染中的差異表達及其調控作用
胡海浩,黃鑒濤,馬嘉霖,楊 碩,閆秀英,簡紀常
(廣東海洋大學水產學院/廣東省水產動物病害防控與健康養殖重點實驗室/水產經濟動物病害控制廣東普通高校重點實驗室,廣東 湛江 524088)
魚淋巴囊腫病毒中國株(Lymphocystis disease virus China,LCDV-cn)是牙鲆(Paralichthys olivaceus)淋巴囊腫病的病原[1],致使患魚在皮膚、鰭、尾部等長有囊腫,給牙鲆養殖造成了重大損失。對LCDVcn 及牙鲆淋巴囊腫病的研究已取得一定進展[2-6],但牙鲆淋巴囊腫病的有效防控依然是水產養殖業中的難題,其原因之一是LCDV-cn 的致病機制知之甚少[7]。微小RNA(miRNA)可通過與靶基因結合對靶基因的轉錄進行調控,從而參與多種病理、生理過程[8]。因此,對LCDV-cn 感染過程中miRNA 的調控作用進行研究,可在miRNA 層面解析LCDV-cn的致病機制。
研究發現不同物種miR-146a的序列高度保守,提示miR-146a在生物體的生理、病理過程中可能發揮重要作用[8]。已有研究表明miR-146a在多種腫瘤中高度表達,調控腫瘤發生發展的許多生物學過程,而且miR-146a 的調控具有促腫瘤發展的作用,抑制miR-146a 的表達可使腫瘤細胞的致瘤性和侵襲力下降[9-10]。更有研究表明miR-146a 調控病毒的感染過程,如在乙型肝炎病毒(Hepatitis B virus,HBV)感染過程中,miR-146a 通過抑制機體抗病毒反應促進HBV 復制和蛋白表達[11];丙型肝炎病毒(Hepatitis C virus,HCV)感染可誘導miR-146a 的表達上調,從而促進病毒感染[12];在人乳頭瘤病毒(Human papilloma virus,HPV)感染中,miR-146a 發揮多重作用,調控HPV 的感染進展[13];還有研究發現,miR-146a 的上調與EB 病毒(Epstein-Barr virus,EBV)感染引起的腫瘤細胞增殖相關[14-15]、有些病人miR-146a 的下調可能與新型冠狀病毒(Corona covid-19 virus,COVID-19)感染引起的嚴重癥狀有關[16]、miR-146a 可調控人類免疫缺陷病毒(Human immunodefdiciency virus type 1,HIV-1)感染[17]、miR-146a 的表達上調可促進石斑魚虹彩病毒(Singapore grouper iridovirus,SGIV)感染[18],等。上述研究表明miR-146a 在病毒感染和腫瘤發生中起著重要的調控作用。
本課題組前期研究[19]表明,草魚miR-146a(Ctenopharyngodon idellamiR-146a,cid-miR-146a)在LCDV-cn 感染草魚卵巢細胞系(grass carp ovary cells,GCO)過程中存在顯著差異表達。因此,本研究在LCDV-cn感染GCO 過程中,對cid-miR-146a進行鑒定和表達特性分析,并探索cid-miR-146a 的調控作用,為在miRNA 層面解析LCDV-cn 的致病機制等提供基礎。
1 材料與方法
1.1 材料與試劑
LCDV-cn 分離自患淋巴囊腫病的牙鲆,保存于本實驗室;GCO細胞購買于深圳檢驗檢疫局。
本研究所用引物見表1,在上海生工生物技術有限公司合成。
1.2 LCDV-cn感染GCO細胞
用25 cm2細胞培養瓶于28 ℃培養GCO 細胞,具體操作參照文獻[2,19],所用培養基為MEM 培養基[含體積分數10%胎牛血清(FBS)],正常傳代約48 h 單層細胞鋪滿瓶底時,吸出培養液,取1 mL 的LCDV-cn 懸液(滴度濃度105.5TCID50/mL[19])進行感染(同時設未感染組為對照組),于20 ℃下孵育1 h后,取出病毒懸液,加入4 mL 維持液(含體積分數2%FBS 的MEM 培養基)于20 ℃下繼續感染實驗,并定時取樣。
1.3 電鏡負染
取10 mL 滴度濃度(105.5TCID50/mL)的LCDV-cn懸液[19],于室溫和-80 ℃反復凍融4 次,于4 ℃、1 000g條件下離心30 min,取上清用質量分數3%磷鎢酸進行染色,于廣東醫科大學附屬醫院進行電鏡觀察。
1.4 頸環(Stem-loop)RT-PCR
取LCDV-cn感染GCO 72 h時樣品1瓶(細胞培養瓶),胰酶消化后取1×106個細胞,于室溫、1 000g條件下離心3 min,棄上清后,加入1 mL Trizol,按照TRIzol?LS試劑盒說明書提取RNA,并用10 mg/mL瓊脂糖凝膠電泳檢測RNA 完整性。用提取的RNA和頸環反轉錄引物RT-cid-miR-146a(表1),按照反轉錄試劑盒PrimeScript?RTreagent Kit with gDNA Eraser 說明書進行特異性反轉錄,制備頸環RT-PCR模板cDNA,保存于-80 ℃備用。

表1 引物序列Table 1 Primers used in this study
根據前期研究結果[19],采用頸環RT-PCR 擴增cid-miR-146a,所用引物cid-miR-146a-F 和cid-miR-146a-R 見表1。PCR 擴增體系為50 μL,包含EX-Taq 25 μL、cDNA 3 μL(質量濃度約為50 μg/mL)、cid-miR-146a-F 2 μL、cid-miR-146a-R 2 μL 和ddH2O 18 μL。PCR 反應條件為95 ℃變性30 s、60 ℃退火30 s、72 ℃延伸60 s,循環40 次。然后用3%(質量體積比)瓊脂糖凝膠電泳進行檢測。頸環RT-PCR 擴增獲得目的片段的長度為60 bp,包括上游序列4 bp(5′-GCGC-3′)、cid-miR-146a序列23 bp(5′-TGAGA ACTGAATTCCATAGATGG-3′)、頸環序列33 bp(5′-GTGCAGGGTCCGAGGTATTCGCACTGGATC GAC-3′)。將cid-miR-146a 插入至pMD18-T 載體,然后轉化至DH5α,于37 ℃下進行培養。按藍白斑篩選方法選取陽性菌落[1],并將陽性菌落送往上海生工生物技術有限公司進行測序。
1.5 定量PCR
收集LCDV-cn 感染GCO 細胞后0、4、8、16、24、48、72、144 和196 h 樣品,然后制備cDNA(同前)用于定量PCR。所用引物cid-miR-146a-F、cid-miR-146a-R、U6F和U6R見表1,定量PCR總體積為10 μL,包含TB Green Premix Ex Taq II 5 μL、cDNA 1 μL、cid-miR-146a-F 1 μL、cid-miR-146a-R 1 μL 和ddH2O 2 μL。反應條件為95 ℃預變性30 s,95 ℃變性5 s、60 ℃退火30 s,循環40次。
上調下調實驗中,cid-miRNA-146a 在GCO 細胞的表達定量。上調下調實驗包括4 組:上調組(轉染cid-miR-146a mimics 模擬物,轉染濃度為20 nnmol/L)、下調組(轉染cid-miR-146a inhibitor 抑制物,轉染濃度為20 nnmol/L)、陰性對照(NC組:轉染NC,轉染濃度為20 nnmol/L,)和陽性對照(LCDV-cn 正常感染組,無轉染)。cid-miR-146a mimics、cid-miR-146a inhibitor 和NC的序列分別為5′-UGAGAACUGAAUUCCAUAGAUGG-3′、5′-CCAUCUAUGGAAUUCAGUUCUCA-3′和5′-UUGUACUACACAAAAGUACUG-3′,于上海生工生物技術有限公司合成。用不含抗生素的MEM(含體積分數10%FBS)培養GCO細胞,當GCO細胞于12~16 h 單層生長至70%~90%時,使用Lipo‐fectamineTMRNAiMAX 將cid-miR-146a mimics、cidmiR-146a inhibitor 和NC 分別轉染至GCO 細胞,培養24 h后,用LCDV-cn進行感染,于20 ℃繼續培養。然后,收集LCDV-cn 感染GCO 細胞0、4、8、16、24、48、72、144 和196 h 樣品,制備cDNA 用于cid-miR‐NA-146a 的定量。定量PCR 所用引物、定量PCR 體系和反應條件同上述cid-miRNA-146a的表達定量。
cid-miRNA-146a 靶基因Flt1的表達定量。樣品制備同上述上調下調實驗。定量PCR 所用引物RT-Flt-F、RT-Flt-R、18s-F 和18s-R 見表1,定量PCR體系和反應條件同上述cid-miRNA-146a 的表達定量。
根區溫度對嫁接黃瓜苗葉綠素熒光參數的影響…………………………… 劉念奇,宋 陽,孫世君,高 宇,吳佳旺,崔曉晗(118)
LCDV-cnmcp(主要衣殼蛋白,major capsid protein)的表達定量(代表LCDV-cn 的復制[7])。樣品制備同上述上調下調實驗。定量PCR 所用引物RT-LCDV-MCP-F、RT-LCDV-MCP-R、18s-F 和18s-R見表1,定量PCR 體系和反應條件同上述cid-miR-146a的表達定量。
1.6 統計分析
應用SPSS 24 軟件,用2-ΔΔCt法[23]進行單因素方差分析,并統計差異顯著與否(P<0.05或P<0.01)。
1.7 cid-miR-146a靶基因預測
應用RNAhybrid(https://bibiserv.cebitec.unibielefeld.de/rnahybrid/)、miRanda(http://www.microrna.org/)和TargetScan(http://www.targetscan.org/fish_62/)軟件預測cid-miR-146a的靶基因。3 個軟件預測到的共同靶基因作為靶向目標進行后續研究。
1.8 雙熒光素酶系統驗證cid-miR-146a的靶基因
應用RNA22 預測cid-miR-146a 靶基因的靶位點,根據靶位點設計擴增靶基因片段的引物為pmirGLO-Flt1-F和pmirGLO-Flt1-R(表1)。RT-PCR總體積為50 μL,包含ExTaq?酶25 μL、pmirGLOFlt1-F 2 μL、pmirGLO-Flt1-R 2 μL、cDNA 3 μL、ddH2O 18 μL。PCR 反應條件為95 ℃3 min;95 ℃30 s、55 ℃30 s、72 ℃1 min,35 個循環;最后72 ℃延伸5 min。將PCR 產物與pMD18-T 載體連接,進行亞克隆。通過菌落PCR(引物見表1)和測序進行驗證。將驗證正確的靶基因片段插入至雙熒光素酶啟動子pmirGLO 載體上,構建pmirGLO-Flt1 載體,并進行亞克隆。通過菌落PCR和測序進行驗證。將正確構建的pmirGLO-Flt1載體分別與cid-miR-146a mimics、cid-miR-146a inhibitor 和NC 共轉染至GCO細胞,于20 ℃培養48 h,檢測各組細胞熒光素酶活性。
1.9 生物信息學方法預測cid-miR-146a調控LCDV-cn感染的信號通路
應 用GO(http://geneontology.org/)和KEGG(https://www.genome.jp/kegg/)數據庫對cid-miR-146a可能參與的信號通路進行富集分析。
2 結果與分析
2.1 LCDV-cn感染GCO細胞的過程
LCDV-cn感染GCO細胞后,呈現的細胞病變效應(cytopathic effect,CPE)與文獻[2]一致。LCDVcn 感染GCO 細胞后3 d,細胞聚集、呈現明顯的“疤痕”現象,“疤痕”一直持續到約感染后6 d,6 d 之后細胞逐漸脫落、裂解,出現空洞(圖1)。
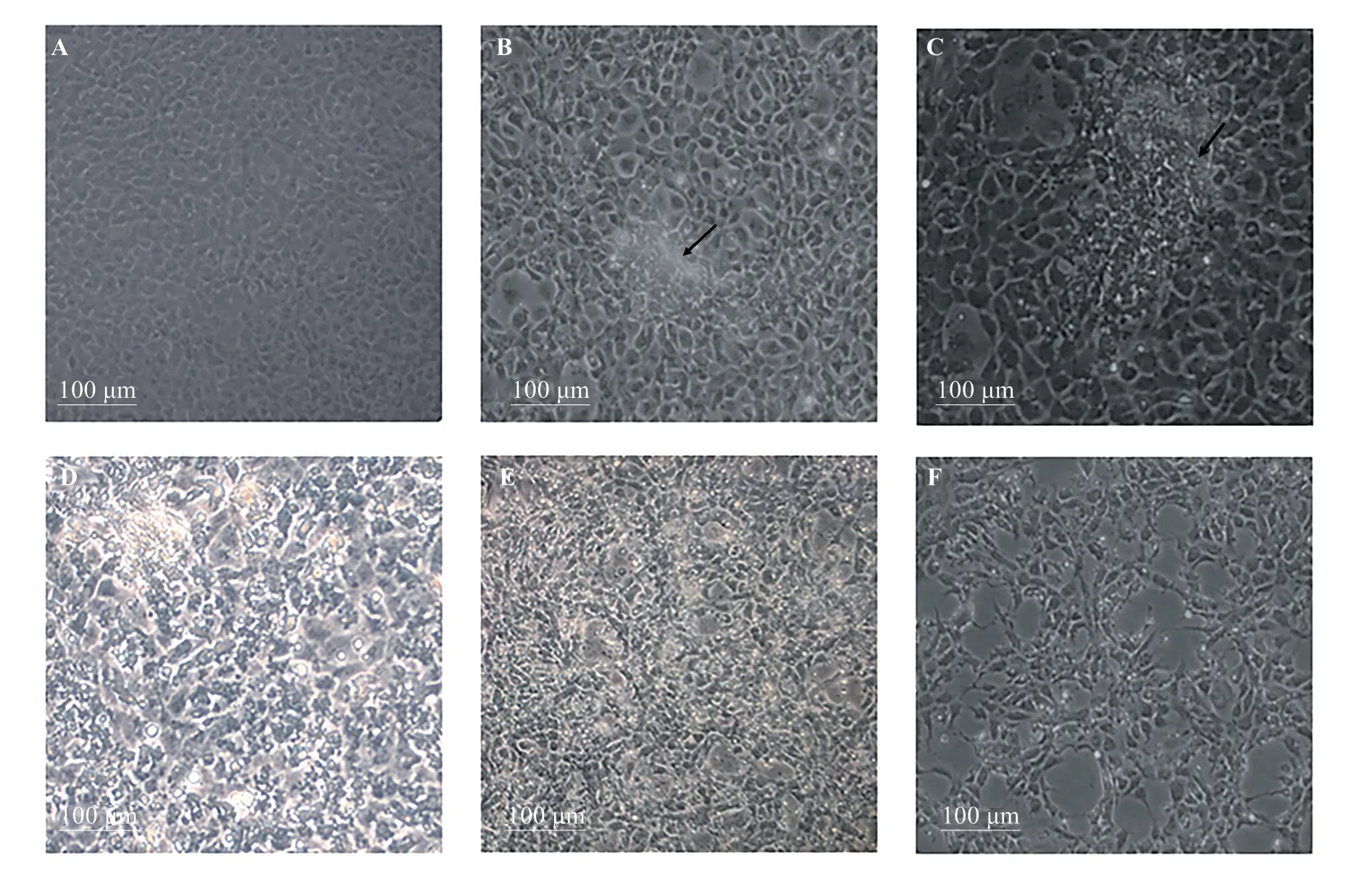
圖1 LCDV-cn感染GCO細胞Fig.1 GCO cells challenged with LCDV-cn
2.2 感染用LCDV-cn懸液電鏡負染
LCDV-cn 以滴度濃度105.5TCID50/mL[19]進行后續感染實驗,感染用病毒懸液進行電鏡負染可看到病毒粒子(直徑約110 nm)(圖2)。
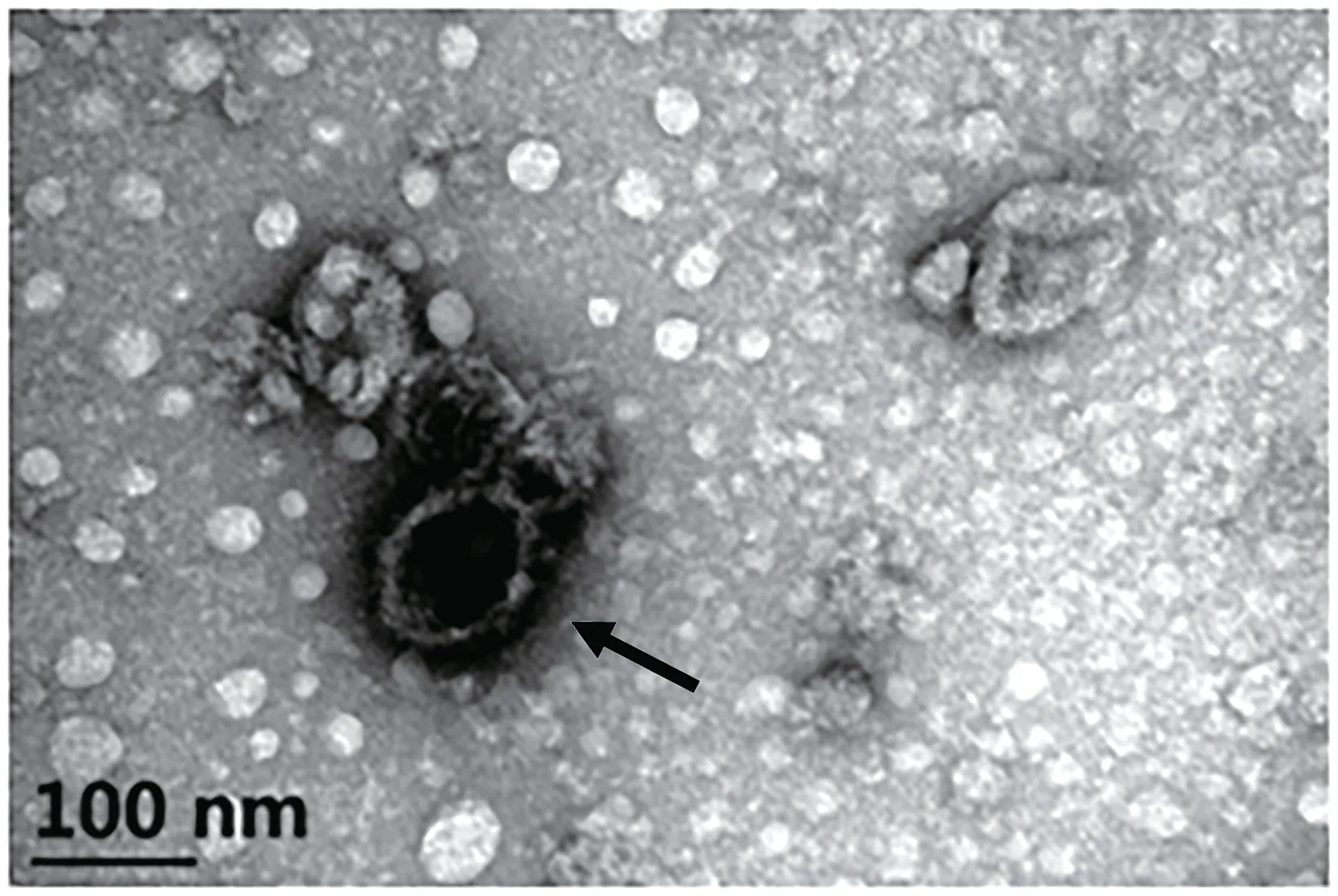
圖2 感染用LCDV-cn懸液電鏡負染Fig.2 Electron microscope of negative staining with LCDV-cn suspension for infection
2.3 cid-miR-146a的擴增
電泳結果表明28S、18S和5S rRNA條帶完整清晰(圖3),說明提取的樣品總RNA 無降解,可用于后續實驗。頸環RT-PCR 擴增后,電泳檢測表明獲得目的片段(圖4(a))。經菌落PCR(圖4(b))和測序驗證獲得的片段是正確的,即為cid-miR-146a。cidmiR-146a 的序列為5′-UGAGAACUGAAUUCCAU‐AGAUGG-3′(23 bp),經序列比對發現,cidmiR-146a與其他物種miR-146a同源(表2)。
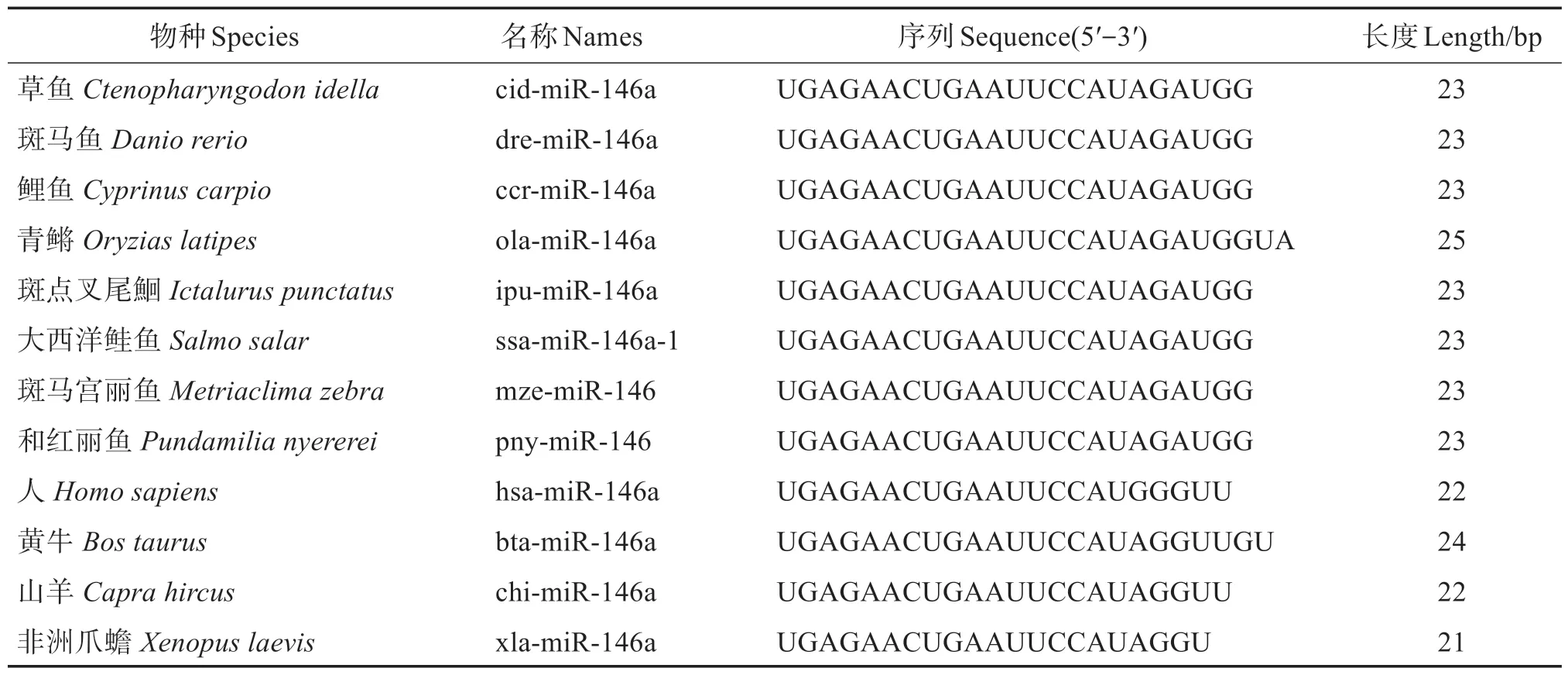
表2 已知的miR-146a序列Table 2 Known miR-146a sequences
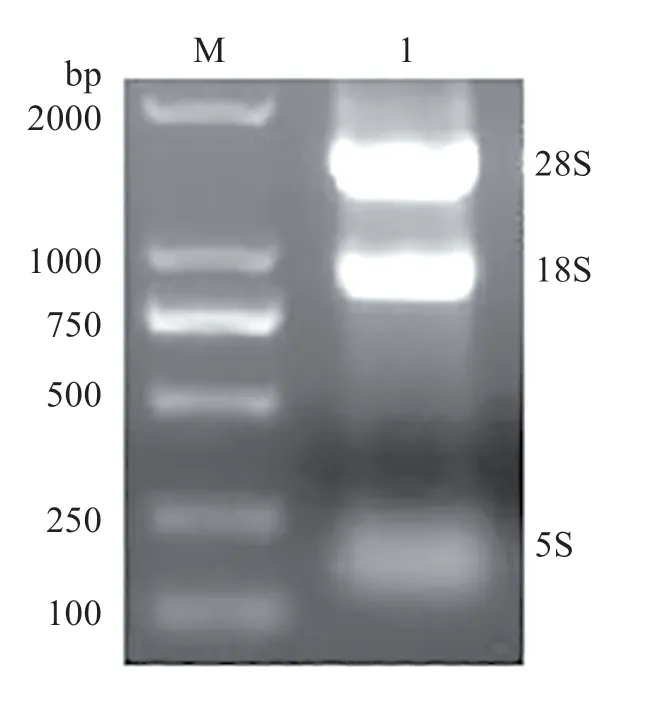
圖3 提取的樣品總RNAFig.3 Extracted total RNA of samples
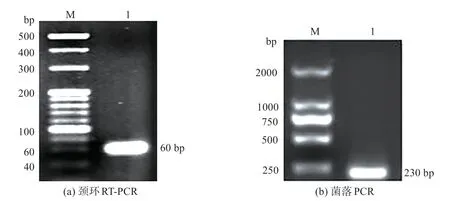
圖4 cid-miR-146a頸環RT-PCR和菌落PCRFig.4 Stem-loop RT-PCR and colony PCR of cid-miR-146a
2.4 cid-miR-146a 在LCDV-cn 感染GCO中的表達特性
依據LCDV-cn 感染GCO 細胞出現CPE 現象的變化特點,選取LCDV-cn 感染后0、4、8、16、24、48、72、144和196 h樣品,進行差異表達分析。由圖5可知,從0 到72 h,cid-miR-146a 的表達量逐漸增加,144和196 h時cid-miR-146a的表達量下降。
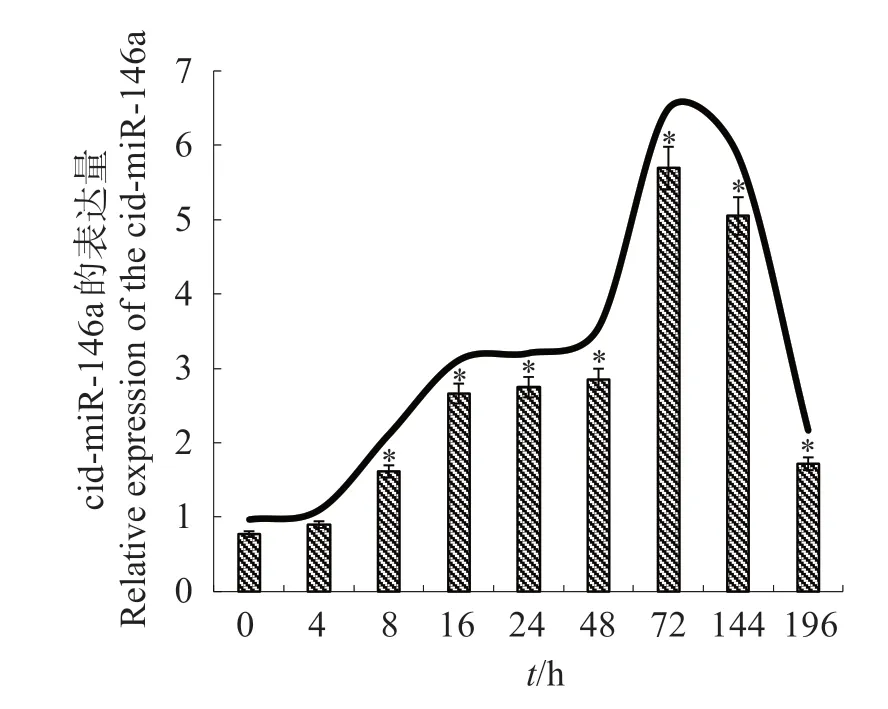
圖5 cid-miR-146a在LCDV-cn感染GCO過程中的表達Fig.5 Expression of cid-miR-146a in GCO cells infected with LCDV-cn
2.5 cid-miR-146a靶基因的預測
RNAhybrid 預測到cid-miR-146a 的靶基因為Gimap8(GTP 酶免疫相關蛋白8,GTPase immuneassociated protein 8)、LEPR(瘦素受體,leptin receptor)、Flt1(Fms 相關酪氨酸激酶1,Fms-related tyrosine kinase 1)和DLGAP5(Discs 大同源相關蛋白5,Discs large homologous affinity protein 5),其總評分值分別為-0.41、-0.01、-0.32和-0.046(評分值為負數,靶基因的概率大)。miRanda 預測到cid-miR-146a 的靶基因為PDIA3(蛋白質二硫鍵異構酶A3,protein disulfide-isomerase A3)、irak1(細胞介素-1受體相關激酶-2)、LOX(賴氨酰氧化酶,lysyl oxidase)和Flt1(Fms 相關酪氨酸激酶1,Fms-related tyrosine kinase 1),其總評分值分別為-0.013、-0.046、-0.19和-0.31。TargetScan 預測到cid-miR-146a 的靶基因為DIO-1(碘代甲狀腺氨酸脫碘酶1,iodothyronine deiodinase 1)、Flt1(Fms 相關酪氨酸激酶1,Fmsrelated tyrosine kinase 1)和Gimap8(GTP酶免疫相關蛋白8,GTPase immune-associated protein 8),其總評分值分別為-0.18、-0.32和-0.41。預測到的靶基因與癌癥和腫瘤發生、抗原呈遞和感染反應相關。
此3 個軟件均預測到Flt1是cid-miR-146a 的靶基因,因此后續以Flt1為靶標開展實驗。應用RNA22 預測到Flt1含有 結合cid-miRNA-146a 的位點(折疊能為-72.38 kJ/mol,P值為0.353),Flt1與cid-miRNA-146a 結 合 的 位 點 序 列 為:5′-UACA‐AAAGGGAGGUUCAGUUCUC-3′(圖6),位于Flt1mRNA(GenBank 編碼:XM_039667029)的280-302堿基(圖6)。
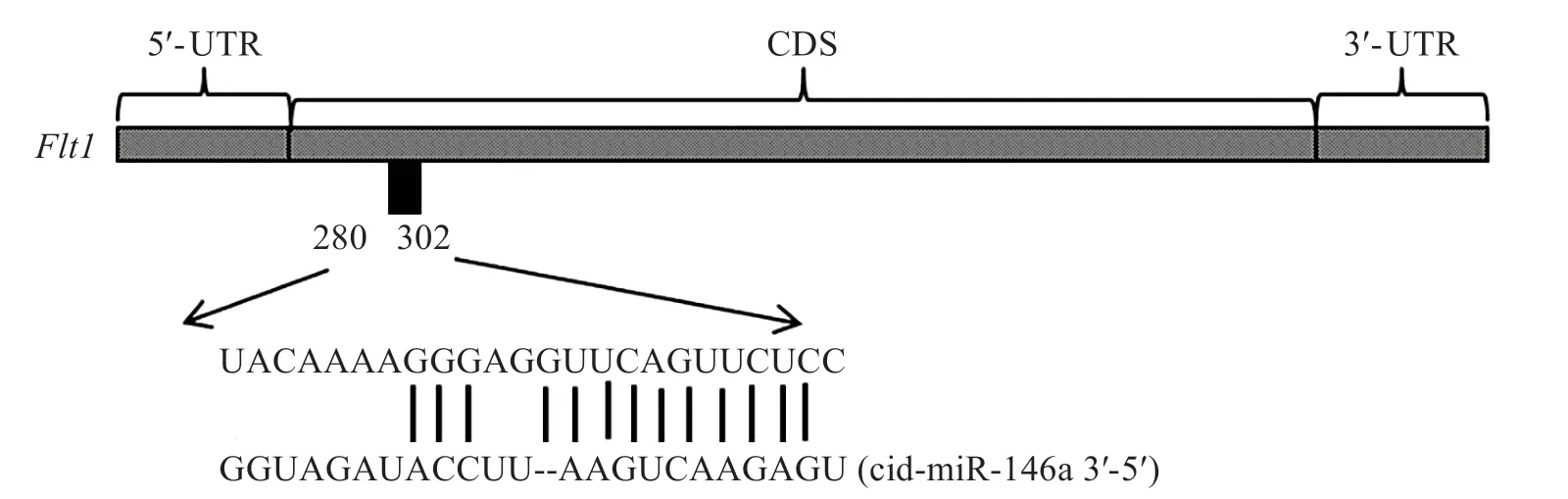
圖6 cid-miR-146a靶向Flt1基因的結合位點Fig.6 Binding sites of the gene Flt1 targeted with cid-miR-146a
2.6 cid-miR-146a的靶基因Flt1驗證
選取含靶位點的Flt1片段,其長度為456 bp,位于Flt1mRNA 的249-704 堿基。經RT-PCR 擴增后將目的Flt1片段插入至pmirGLO 載體,菌落PCR、XhoⅠ和SalⅠ雙酶切(圖7)和測序結果說明目的片段是正確的,成功構建pmirGLO-Flt1,并應用雙光素酶報告基因系統驗證靶基因。雙熒光素酶報告系統檢測雙熒光素酶的活性結果顯示(圖8):共轉染cid-miR-146a mimics 和pmirGLO-Flt1 后,雙熒光素酶活性顯著下降,并與其它兩組(共轉染cid-miR-146a inhibitor 或NC)差異顯著(P<0.05),表明Flt1確實是cid-miR-146a的靶基因。
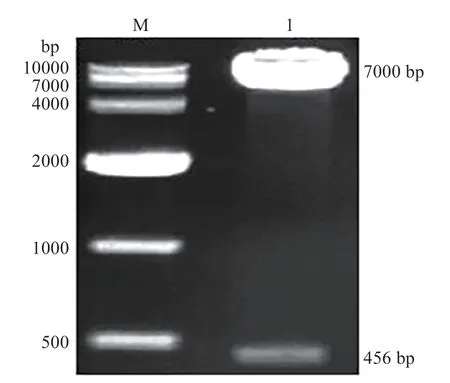
圖7 pmirGLO-Flt1雙酶切Fig.7 Double enzyme digestion of pmirGLO-Flt1
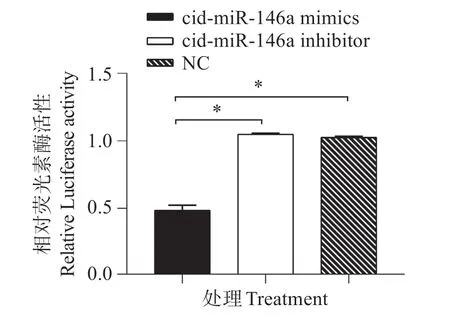
圖8 雙熒光素酶活性檢測Fig.8 Detection of luciferase activity
2.7 cid-miR-146a在上調下調GCO細胞中的表達量
對cid-miR-146a 進行上調下調后,定量PCR 結果表明(圖9):在cid-miR-146a 上調和下調的GCO細胞中,cid-miR-146a 的表達量與陽性對照組和陰性對照組中的表達量存在顯著差異(P<0.05);cidmiR-146a 上調組中,cid-miR-146a 的表達量明顯升高(P<0.05),而在cid-miR-146a 下調組中,cid-miR-146a 的表達量明顯下降(P<0.05)。由此也說明轉染cid-miR-146a mimics 和cid-miR-146a inhibitor 的濃度20 nnmol/L 是合適的,后續研究按此濃度20 nnmol/L進行。
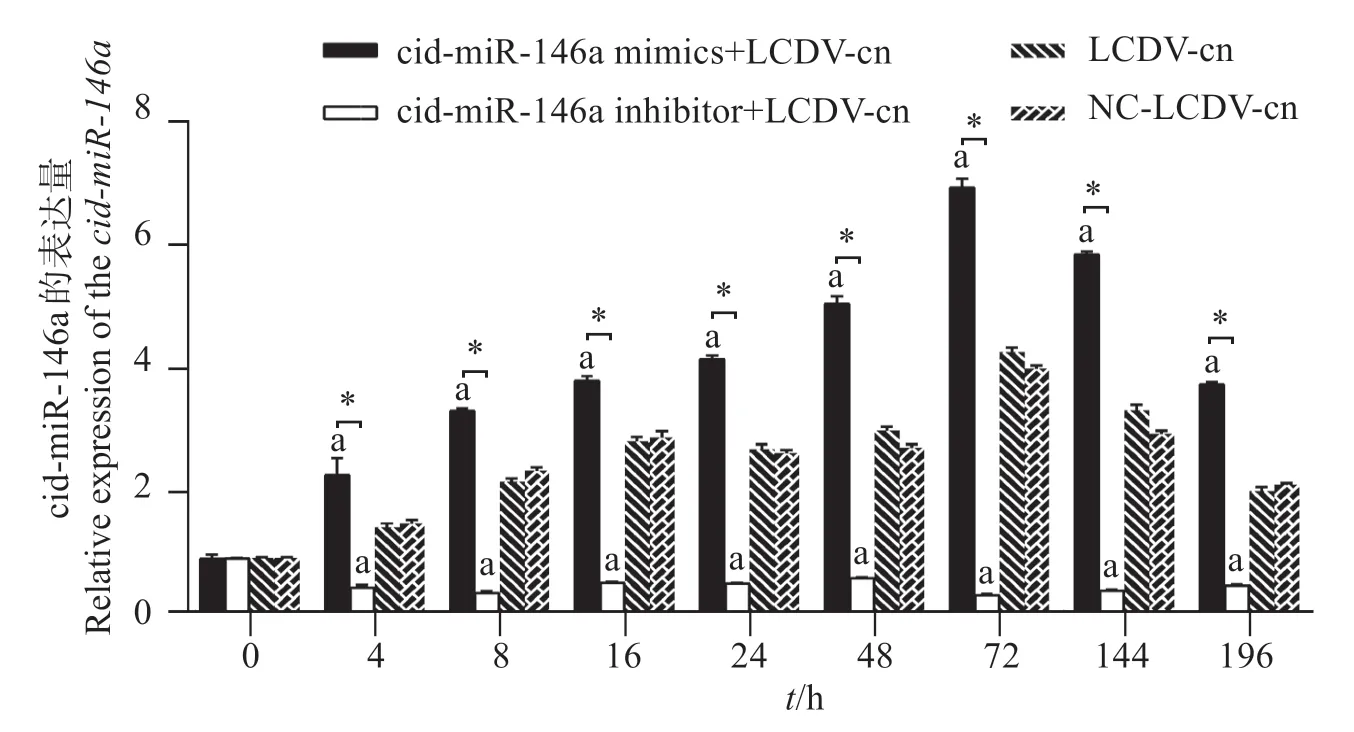
圖9 上調下調實驗中cid-miRNA-146a在GCO細胞的表達Fig.9 Expression of cid-miRNA-146a in GCO cells for the up-down regulation experiment
2.8 cid-miR-146a對其靶基因Flt1的調控
對cid-miR-146a 進行上調下調后,靶基因Flt1定量PCR 結果表明(圖10):在cid-miR-146a 上調組,Flt1的表達量最少,與其它組的表達量存在顯著差異(P<0.05);在cid-miR-146a下調組,Flt1的表達量最多,與其它組的表達量存在顯著差異(P<0.05);在陽性對照組,Flt1的表達量先下降然后上升,在72和144 h時最少。
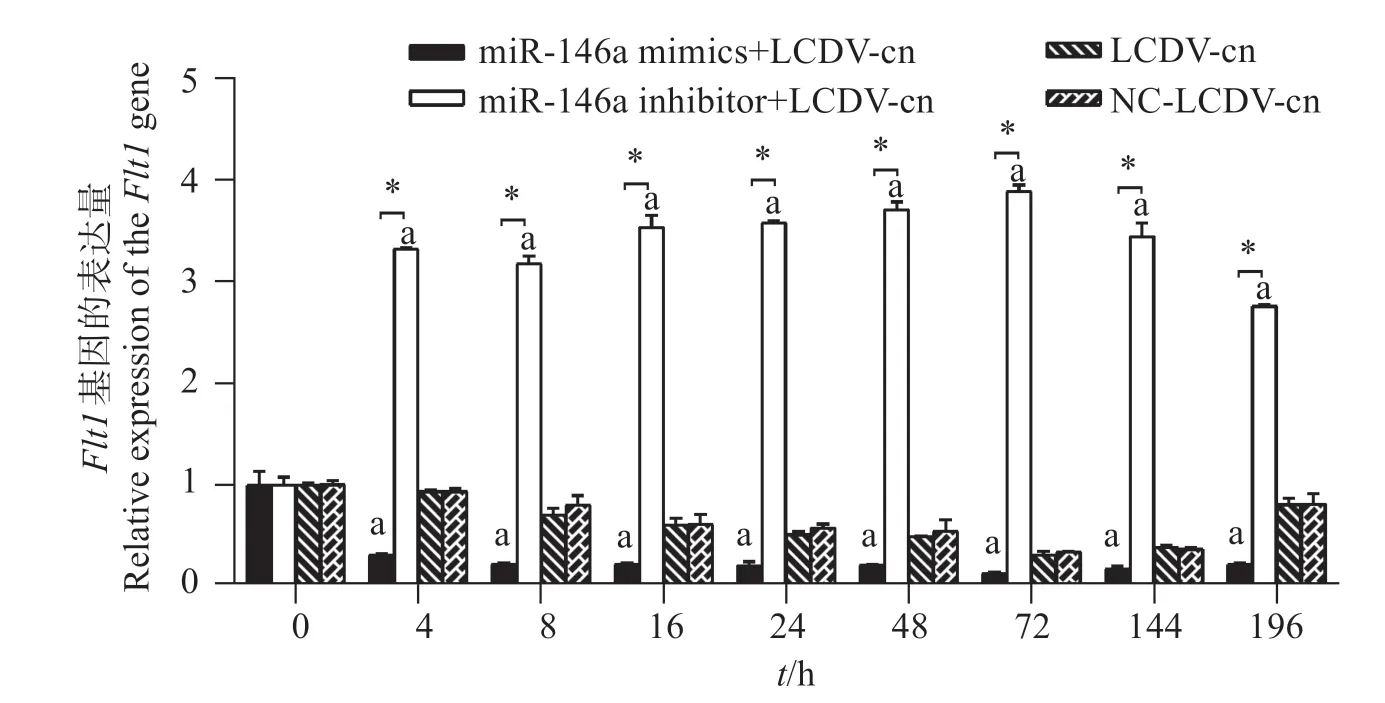
圖10 GCO細胞中Flt1的表達Fig.10 Expression of the gene Flt1 in GCO cells
2.9 cid-miRNA-146a對LCDV-cn復制的調控
對cid-miR-146a 進行上調下調后,LCDV-cnmcp基因定量PCR 結果(mcp的表達代表LCDV-cn的復制)表明(圖11):在cid-miR-146a 上調組,mcp基因的表達量最多,峰值在72 h,與其它組的表達量差異顯著(P<0.05);在cid-miR-146a下調組,mcp基因的表達量最少,與其它組的表達量差異顯著(P<0.05);在陽性對照組(LCDV-cn 正常感染),mcp基因的表達量先上升后下降,與上調組趨勢一致,峰值在72 h。由此說明,cid-miR-146a 上調促進LCDV-cn 在GCO 細胞的復制,cid-miR-146a 下調后LCDV-cn在GCO細胞的復制降低。
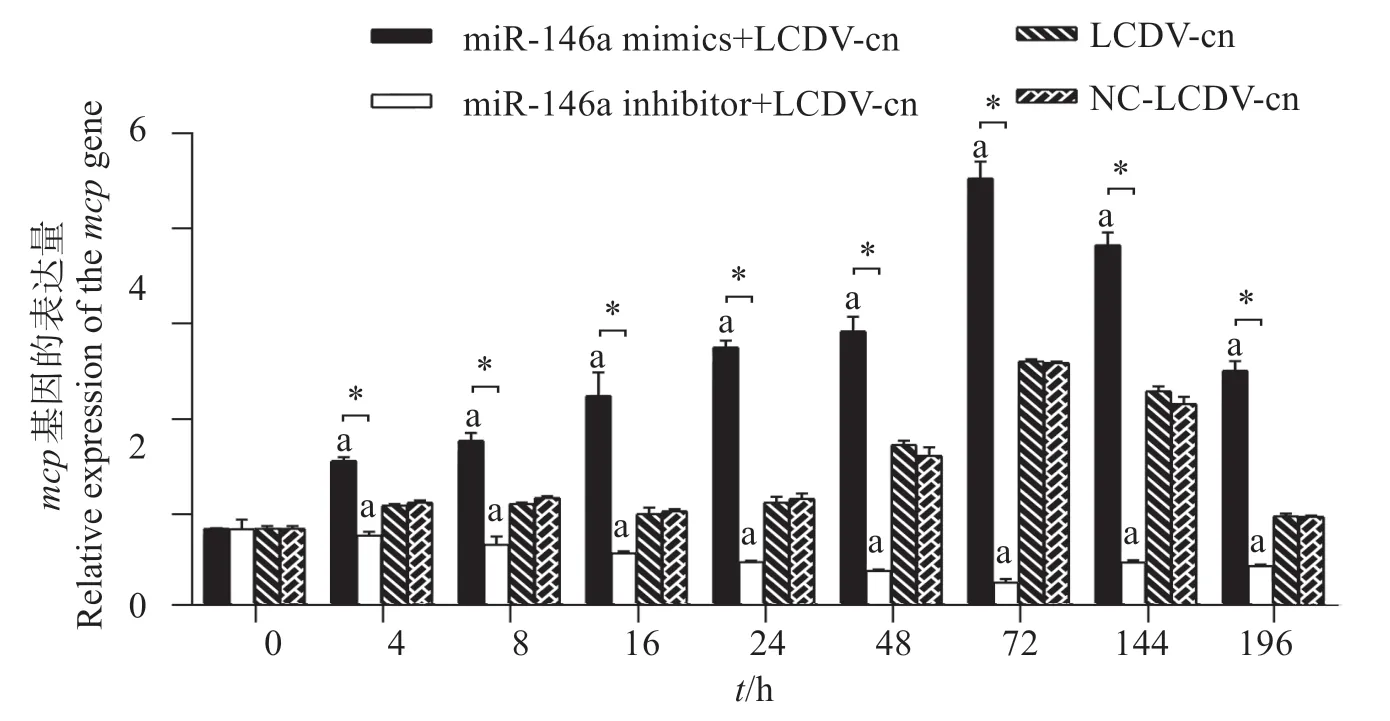
圖11 GCO細胞中mcp基因的表達Fig.11 Expression of the mcp gene in GCO cells
2.10 生物信息學預測cid-miR-146a 在LCDV-cn 感染過程中調控的信號通路
應用GO 和KEGG 預測到cid-miR-146a 調控的信號通路可能包括Toll樣受體(Toll-like receptor)信號通路(P值為0.005 6)、NF-кB(nuclear factor κB)信號通路(P值為0.009 4)和ErbB(receptor tyrosine kinases)信號通路(P值為0.0266 7)等。Toll 樣受體可識別病原體、快速激活先天免疫,NF-кB可調節涉及免疫、細胞存活等的基因,ErbB 可調控細胞增殖、分化和存活等(https://www.genome.jp/kegg/)。
3 討論
miRNA 在病毒感染和腫瘤發生中起著重要的調控作用,miR-146a 作為不同生物中比較保守的miRNA,已成為抗病毒感染和抗腫瘤等研究的熱點[9-18]。高通量測序表明在LCDV-cn感染GCO 過程中,cid-miR-146a 的表達存在顯著差異[19],本研究以cid-miR-146a 為目標miRNA,探索cid-miR-146a 對其靶基因和LCDV-cn復制的調控作用。
LCDV-cn 感染GCO 后的CPE 現象呈現出“疤痕”和空洞,與Zhang等[2]的研究一致。在本研究中,LCDV-cn 感染GCO 后CPE 現象的變化與cid-miR-146a的表達變化時間點呈正相關:在LCDV-cn 感染GCO 后,細胞聚集“疤痕”形成的過程(圖2),cidmiR-146a 的表達一直上調(圖4);細胞脫落、裂解、“疤痕”消失的過程(圖2),cid-miR-146a的表達下調(圖4)。總之,在LCDV-cn 感染GCO 細胞過程中,cid-miR-146a的表達先上升(3 d前)后下降(6 d后)。在病毒感染的不同時期,cid-miR-146a 呈先上調后下調的表達模式,這在其它病毒感染中也得以發現,如,在HPV感染中,在感染的起始階段miR-146a表達上調,在感染后期miR-146a表達下調[13]。
本研究表明cid-miR-146a靶向Fms相關酪氨酸激酶1 (FLT1)的編碼區而發揮其調控作用。FLT1是血管內皮生長因子(VEGF)受體之一,Flt1廣泛表達于腫瘤細胞,與血管生成和腫瘤發生相關[24]。在本研究中,LCDV-cn 感染后引起的淋巴囊腫病是一種皮膚瘤(可自愈),在較大的囊腫上有肉眼可見的紅色血管[25],說明在LCDV-cn 引起的皮膚瘤發展過程中確實存在著血管生成。研究表明在多種腫瘤中Flt1的表達異常,如,在神經膠質瘤中Flt1的表達高度上調[24]、在頭頸鱗狀上皮細胞癌中Flt1選擇性上調表達[26]等。本研究發現在LCDV-cn 感染GCO細胞過程中,cid-miR-146a 對其靶基因Flt1的表達起著負調控作用(圖10),與HPV 感染中miR-146a的調控相似。在HPV 感染引起的腫瘤中,miR-146a靶向調控表皮生長因子受體(EGFR),且miR-146a負調控EGFR的表達[27]。在其它一些腫瘤研究中,也發現了miRNA 對Flt1的負調控作用,如,miR-139-5p 靶向Flt1抑制Flt1的表達,從而調控人類神經膠質瘤的發展[24]。此外,研究發現降低或抑制Flt1的表達可控制腫瘤的發展等:乳腺癌中Flt1的抑制可以降低腫瘤轉移效率[28],敲降Flt1的表達可以阻止膠質瘤細胞的傳播[29],在絨膜癌細胞中Flt1基因是特定類型細胞腫瘤的抑制劑[30]。而且,血管生成對腫瘤發展來說是必不可少的,FLT1是血管生成和腫瘤發生的主要調控因子之一[24,31],因此,Flt1已成為一種新型潛在的腫瘤治療靶點[28-29]。雖然本研究表明cid-miR-146a對Flt1的表達起著負調控作用,但其對LCDV-cn感染的調控機制有待深入研究。
本研究結果進一步表明LCDV-cn的復制與cidmiR-146a 的表達呈正相關(圖11),隨著cid-miR-146a 的上調下調而變化。在其它病毒感染中,也發現miR-146a的表達與病毒復制呈正相關,并促進病毒復制。如,miR-146a 促進HBV 的復制,可提高HBV 引起肝癌的風險[32-33]。此外,目前研究表明在病毒感染中,miR-146a 調控免疫相關等信號通路,從而調控病毒的復制。如,在流感病毒H1N1 和H3N2 感染中,miR-146a 參與的信號通路包括Toll樣受體信號通路、先天免疫反應、細胞因子的產生和凋亡[34];在EBV 感染過程中,miR-146a 參與淋巴細胞信號通路和干擾素信號通路等[35]。本研究應用生物信息學方法預測到cid-miR-146a可能參與調控Toll 樣受體信號轉導通路、NF-кB 信號通路和ErbB信號通路,這些信號通路與免疫和腫瘤發生相關。因此,推測cid-miR-146a 調控的LCDV-cn 致病機制可能涉及與宿主免疫因子的互作、腫瘤發生發展等,cid-miR-146a 對LCDV-cn 感染的調控機制還有待深入研究。本研究還發現Flt1的表達與LCDVcn 的復制呈負相關,但Flt1對LCDV-cn 復制的調控機制有待解析。

