熱脅迫對中間球海膽抗氧化酶活性及線粒體結構與功能的影響
王文配,韓泠姝,2,張向磊,劉 鵬,楊新宇,王 犖,張偉杰,常亞青,丁 君
(1.大連海洋大學農業農村部北方海水增養殖重點實驗室,遼寧 大連 116023;2.寧波大學海洋學院,浙江 寧波 315211)
中間球海膽(Strongylocentrotus intermediu)生長快、品質優,但對溫度變化敏感,2017 年山東、遼寧等地增養殖中間球海膽曾因夏季高溫導致大量死亡[1-3]。海洋生物在急性高溫脅迫下會調整生理調節機制,線粒體代謝機制的調整對生物補償溫度變化所產生的影響至關重要[4-5]。ATP 酶是一類分布廣泛的膜結合蛋白酶,參與生物體能量代謝等生理生化過程。鯉(Cyprinus carpio)和團頭魴(Megalobrama amblycephala)在受到高溫脅迫時其肝臟細胞線粒體超微結構受損[6-7];凡納濱對蝦(Litope‐naeus vannamei)和銀鯧(Pampus argenteus)在受到高溫脅迫時,其ATP 酶活性顯著降低[8-9]。但未見對中間球海膽線粒體的相關報道。
此外,高溫也會激活生物體液免疫,改變抗氧化酶活性。抗氧化系統中超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-PX)和過氧化物酶(POD)等起主要作用,SOD 將生物體產生的有毒物質轉化為H2O2,CAT 和GSH-PX 可以將H2O2轉變為水和分子氧,以清除氧自由基和保護細胞免受氧化損傷[10]。POD 廣泛分布于動物、植物和微生物細胞中,在底棲海洋無脊椎動物中如貽貝(Mytilus edulis)和蛤類,POD是參與免疫調節的主要免疫酶類[11]。在牙鲆(Paralichthys olivaceus)[12]及長牡蠣(Crassostrea gigas)[13]的研究中發現,高溫使其體內SOD、CAT等抗氧化酶的活性顯著升高,而羅氏南極魚(Notothenia rossii)[14]在高溫狀態下其腎臟中CAT 酶活性顯著降低;中間球海膽1 ℃/d 從15 ℃升至26 ℃的過程中,SOD及CAT活性呈先升高后降低趨勢,該變化可以保護海膽免受氧化損傷[15]。
本研究以中間球海膽為研究對象,開展急性高溫脅迫下中間球海膽線粒體結構與功能以及抗氧化酶活性變化特征研究,有助于從生理水平上闡明中間球海膽如何響應高溫脅迫,為海膽響應高溫脅迫及高溫育種提供基礎。
1 材料與方法
1.1 實驗材料
選取45 只飼養于農業農村部北方海水增養殖重點實驗室的1.5 齡健康中間球海膽,體質量為(35.30±1.93)g,殼徑為(47.01±5.35)mm,殼高為(28.99±2.80)mm。
1.2 實驗設計
實驗設計15、20和25 ℃3個溫度梯度,以15 ℃為對照組。每個梯度3 個重復,每個重復5 只。實驗開始將45 只中間球海膽放置于15 ℃控溫水槽內暫養7 d,其中15 只暫養7 d 后立即取樣。再將剩余30 只實驗用中間球海膽隨機分配到2 個控溫水槽中,其中15 只以1 ℃/h 速度逐漸升溫至20 ℃后,維持24 h 后立即取樣;另外15 只以1 ℃/h 的速度逐漸升溫至25 ℃后,維持24 h后立即取樣。
1.3 樣品采集
每個重復隨機取3 只,每個實驗組9 只,置于冰盒上活體解剖,每只抽取約5 mL 體腔液裝入10 mL離心管內,離心(轉速9 000 r/min)10 min 后取上清液轉入新的離心管內。抽取體腔液后立即剪取腸組織液氮速凍,同離心后的體腔液和沉淀的體腔細胞放置于-80 ℃冰箱內保存備用。
1.4 檢測指標
腸組織檢測指標是ATP 和Ca2+濃度、Ca2+-ATP酶、Ca2+-Mg2+-ATP 酶、Na+-K+-ATP 酶,體腔液檢測的指標是SOD、CAT、GSH-Px、POD。線粒體提取、ATP 濃度測定、Ca2+濃度測定的試劑盒均購自上海杰美基因醫藥科技有限公司,其具體實驗方法見說明書;ATP 酶活測定、抗氧化酶(GSH-Px、CAT、POD、SOD)活性測定的試劑盒均購自南京建成生物工程研究所,其具體實驗方法見說明書。超薄切片制備借鑒劉曉輝的實驗方法[6],最后使用透射電鏡(JEM-2000EX)觀察。
1.5 數據處理
實驗結果均用平均值±標準差表示。實驗數據用SPSS19.0 軟件進行統計分析,分別對各組的實驗數據進行單因素方差(One-Way ANOVA)分析和Duncan’s多重比較,顯著性水平α=0.05。柱狀圖使用GraphPad Prism v8.0.2.263制作。
2 結果
2.1 急性高溫脅迫下中間球海膽體腔細胞線粒體結構變化
對照組(15 ℃)體腔細胞邊界清楚(圖1(a))。線粒體呈圓形或橢圓形,且在細胞邊緣排列,線粒體膜完整,嵴清晰可見且靠近線粒體兩端排列(圖1(b))。
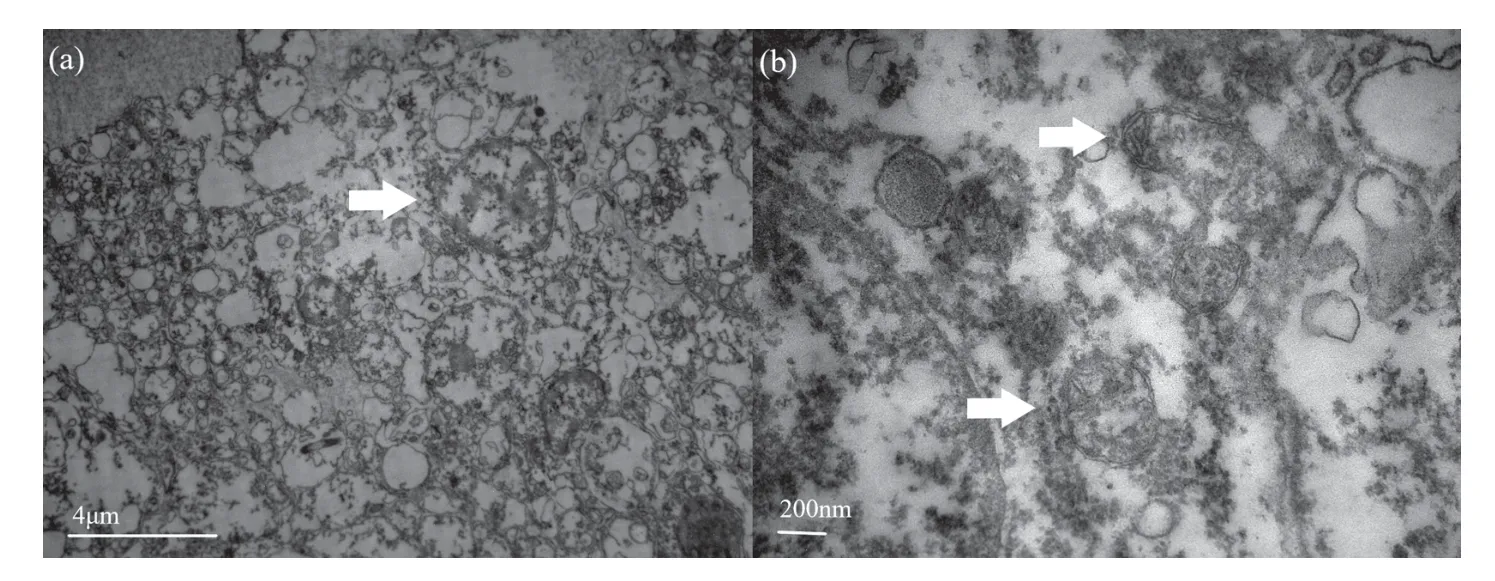
圖1 15 ℃下的中間球海膽體腔細胞結構Fig.1 The structure of coelomocytes of the Strongylocentrotus intermedius at 15°C
20 ℃組體腔細胞邊界清楚(圖2(c)),線粒體呈圓形或橢圓形,在細胞核周圍排列,與對照組相比線粒體數目顯著增多。極大部分線粒體膜完整且嵴在線粒體中間排列;小部分線粒體膜溶解破損,嵴脫落不清晰,線粒體基質與對照組相比密度增大(圖2(d))。
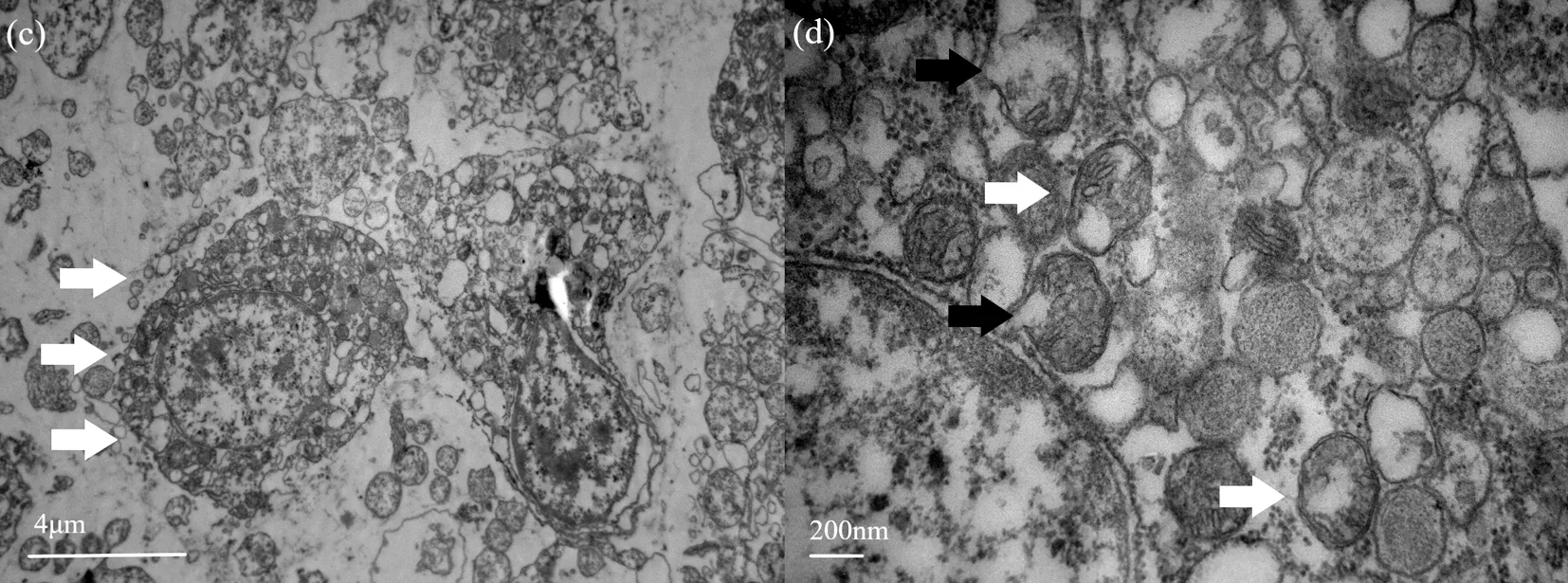
圖2 20 ℃下的中間球海膽體腔細胞結構Fig.2 The structure of coelomocytes of the Strongylocentrotus intermediu at 20°C
25 ℃組體腔細胞邊界清楚(圖3(e)),線粒體呈圓形或橢圓形。線粒體數目與20 ℃組相比數目降低;大部分線粒體膜完整,部分線粒體膜破損,結構破損情況與20 ℃組相似。嵴破損溶解脫落在線粒體基質中渾濁不清晰,線粒體基質密度比20 ℃組大(圖3(f))。
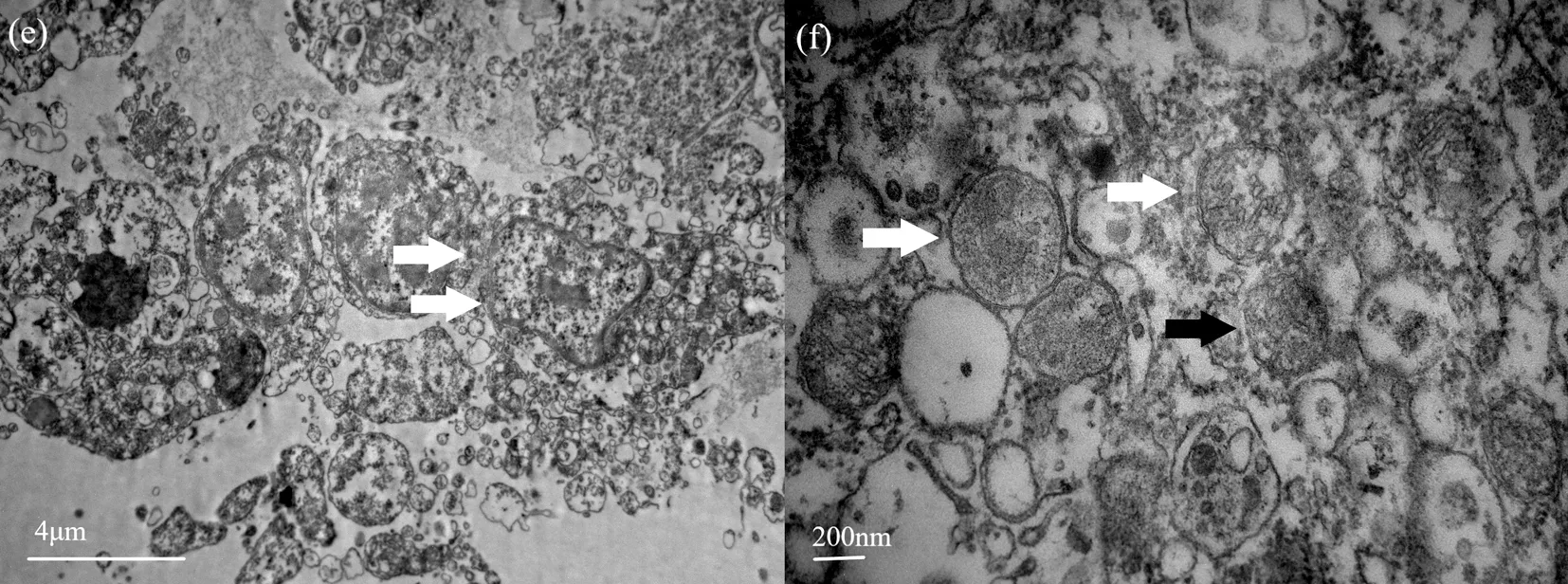
圖3 25 ℃下的中間球海膽體腔細胞結構Fig.3 The structure of coelomocytes of the Strongylocentrotus intermedius at 25°C
2.2 急性高溫脅迫下中間球海膽腸組織線粒體功能變化
圖4顯示,隨溫度升高,ATP濃度變化不顯著(P>0.05)。隨溫度升高至20 ℃,Ca2+濃度顯著下降(P<0.01);當升溫至25 ℃,與20 ℃組相比Ca2+濃度變化不明顯(P>0.05),與對照組相比差異極顯著(P<0.01)。
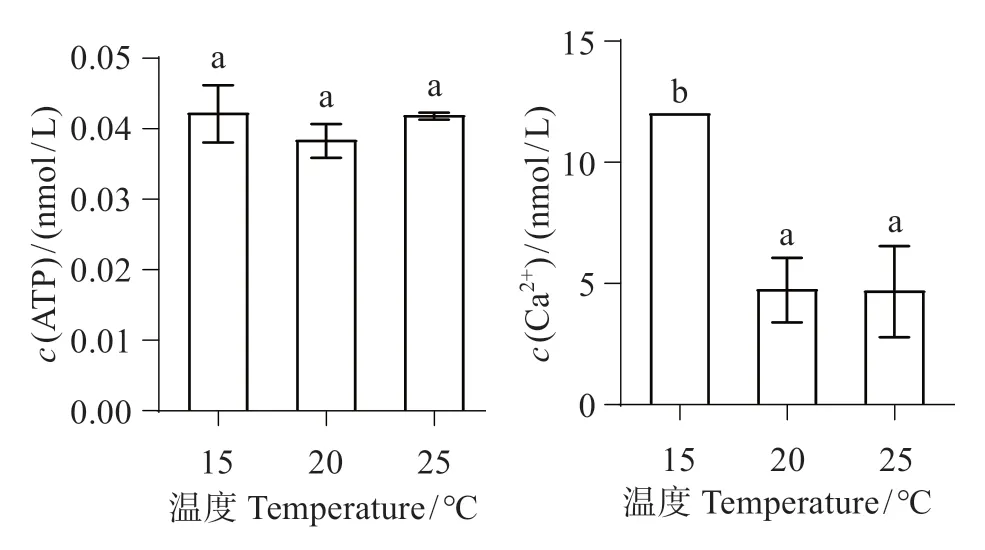
圖4 不同溫度下中間球海膽腸組織線粒體ATP、Ca2+濃度Fig.4 Mitochondrial ATP,Ca2+concentration of intermediate Strongylocentrotus intermedius tissue at different temperatures
隨溫度升高,Ca2+-ATP 酶和Ca2+-Mg2+-ATP 酶活性降低,Na+-K+-ATP 酶活性升高。20 ℃組Ca2+-ATP酶活性與對照組相比差異不顯著(P>0.05),20 ℃組Ca2+-Mg2+-ATP酶、Na+-K+-ATP酶活性與對照組相比差異顯著(P<0.05);25 ℃組Ca2+-ATP 酶、Ca2+-Mg2+-ATP 酶活性與對照組和20 ℃組相比差異極顯著(P<0.01)。25 ℃組Na+-K+-ATP 酶活性與20 ℃組相比差異不顯著(P>0.05),與對照組相比差異極顯著(P<0.01)(圖5)。
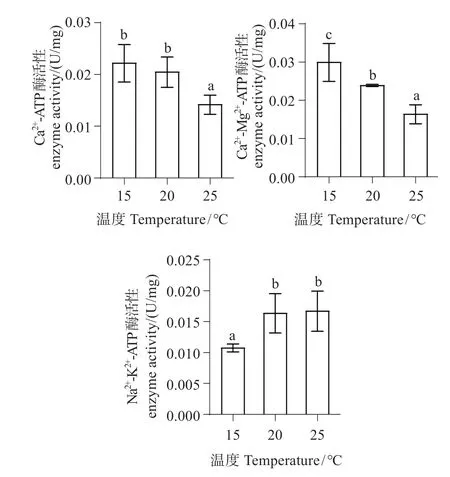
圖5 不同溫度下中間球海膽腸組織線粒體Ca2+-ATP、Ca2+-Mg2+-ATP和Na+-K+-ATP酶活性Fig.5 The mitochondrial Ca2+-ATP,Ca2+-Mg2+-ATP and Na+-K+-ATP enzyme activity of Strongylocentrotus intermedius tissue at different temperatures
2.3 急性高溫脅迫下中間球海膽體腔液抗氧化酶活性變化
圖6顯示,隨溫度升高,SOD活性顯著升高(P<0.05),25 ℃組較20 ℃組呈下降趨勢,變化不明顯(P>0.05);CAT活性下降明顯(P<0.05),20 ℃組和25 ℃組之間CAT 活性變化不明顯(P>0.05);GSHPx活性顯著下降(P<0.01),但25 ℃組和20 ℃組之間酶活性變化不明顯(P>0.05);POD活性顯著升高(P<0.05),20 ℃組和25 ℃組相比差異顯著(P<0.05)。
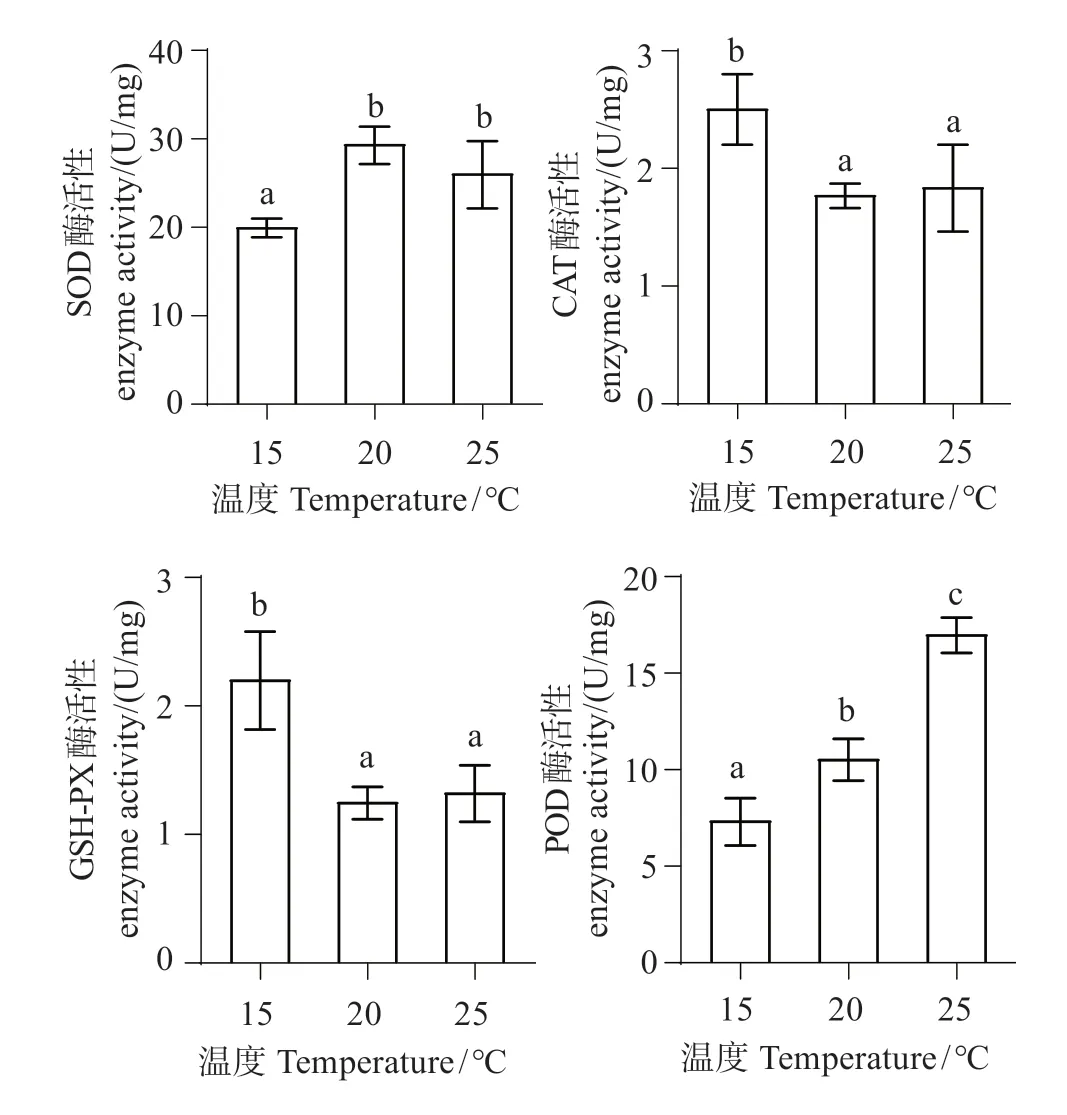
圖6 不同溫度下中間球海膽體腔液抗氧化酶活性變化Fig.6 Changes in the activity of antioxidant enzymes in Strongylocentrotus intermedius cavity fluid at different temperatures
3 討論
3.1 急性高溫脅迫下中間球海膽體腔細胞線粒體結構變化
高溫對中間球海膽體腔細胞結構產生一定影響。本研究結果顯示,隨溫度升高,體腔細胞膜、線粒體數量、線粒體膜及嵴變化趨勢明顯。盛連喜等[16]對鯉魚進行脅迫,發現其肝細胞線粒體腔室內有聚集狀態的非膠質物質出現。劉曉暉等[6]對鯉魚進行急性脅迫,發現鯉魚肝細胞中線粒體數量先增多后減少,第一次熱脅迫時部分嵴斷裂脫落在線粒體基質中;隨溫度繼續升高,線粒體受損嚴重,膜結構破壞,嵴脫落等。本實驗與其研究結果一致的是,當升溫至20 ℃時,體腔細胞內線粒體數目顯著增多,推測這與溫度突然升高、中間球海膽運動幅度加大、線粒體需提供更多能量有關[17]。當溫度升高至25 ℃,線粒體數量減少,這可能是由于高溫損害了線粒體的結構和酶的附著位點。本研究結果與鯉魚急性高溫脅迫后線粒體結構不一致的是,隨溫度升高,鯉魚肝細胞逐漸出現均質化,線粒體出現空泡化,而中間球海膽的體腔細胞和線粒體逐漸出現渾濁;而在熱脅迫小鼠早期囊胚細胞,發現其線粒體數目減少,線粒體發生腫脹、空泡化,線粒體基質變淺呈透明形態、嵴變短變少甚至消失,有的線粒體嵴排列紊亂不清晰[18]。這是脊椎動物與無脊椎動物在高溫脅迫下其細胞超微結構的異同點。
3.2 急性高溫脅迫下中間球海膽腸組織線粒體特征酶分析
ATP 是重要能量分子,在細胞生理和病理過程中起著重要作用[19]。錢令嘉等[20]對小鼠的熱脅迫實驗及朱孟凱等[21]對凡納濱對蝦的高溫脅迫實驗發現線粒體中ATP 濃度顯著增高。而本研究結果顯示,中間球海膽腸組織線粒體中ATP 濃度無顯著變化,推測在高溫下中間球海膽消耗更多能量以保持機體內正常平衡[22]。
Ca2+是調節細胞器的重要因子,當細胞內Ca2+濃度發生變化,這是導致細胞死亡的致命一擊[23]。隨溫度升高,Ca2+-ATP酶活性呈下降趨勢,推測是由于高溫使線粒體氧化代謝能力下降,膜脂質過氧化所導致的膜酶蛋白構象的改變,這降低了細胞內部Ca2+的線粒體的重攝取能力,導致細胞中鈣超載。線粒體Ca2+濃度降低是由于線粒體膜上的Ca2+-ATP酶可分解ATP產能,轉運Ca2+儲存于線粒體內,Ca2+-ATP 酶活性降低,所以Ca2+濃度降低。本實驗結果與熊大林等[8]對凡納濱對蝦進行熱脅迫,發現Ca2+-ATP酶活性呈下降趨勢的結果一致。
Na+-K+-ATP 酶和Ca2+-Mg2+-ATP 酶在維持細胞正常生理功能方面起重要作用。湯平濤等[24]對雄性大鼠進行熱脅迫120 min后,發現大鼠肝線粒體中的Ca2+-Mg2+-ATP 酶活性下降,本研究結果與其研究結果一致,可能由于線粒體膜通透性升高,不能將Ca2+通過逆濃度梯度及時運回,從而出現熱應激反應[25]。隨溫度升高,線粒體中Na+-K+-ATP酶活性明顯升高,推測溫度能夠影響其生物膜結構、膜上Na+-K+-ATP酶的構象以及酶對反應離子和底物的親和力[26]。
3.3 急性高溫脅迫下中間球海膽體腔液抗氧化酶活性變化特征
本研究結果表明,中間球海膽隨著溫度升高,其體腔液中的抗氧化酶活性均發生變化。正常生理狀態下,水生動物的抗氧化系統會及時從機體中去除代謝過程中產生的活性氧,而在環境脅迫下,機體內會有大量活性氧產生,從而造成機體損傷[27]。
SOD可將機體產生的毒性O2-轉化為H2O2,后者繼續被CAT 代謝為無毒的H2O[28-29]。丁文君等[15]對中間球海膽以每天升溫1 ℃進行急性脅迫,結果顯示SOD 活性均呈先升高后降低趨勢。本研究結果顯示,中間球海膽隨溫度升高,SOD 活性顯著升高,推測隨溫度升高中間球海膽機體產生應激反應,導致細胞和組織中自由基迅速增加,所以機體需更多SOD 來應對過多的自由基,從而提高了SOD 活性[30]。當溫度升高至25 ℃時,SOD 活性呈下降趨勢,但是變化不顯著,推測是由于機體中自由基含量增多,超過了SOD清除能力,導致SOD活性下降。
有研究高溫對刺參(Apostichopus japonicus)的影響,結果顯示CAT 活性隨溫度升高而降低[31-32]。謝明媚等[9]對銀鯧幼魚急性高溫脅迫,其血清中的GSH-Px 活性呈降低趨勢。本研究結果顯示,隨溫度升高CAT 及GSH-Px 活性呈下降,表明高溫對中間球海膽已造成損傷,抗氧化能力減弱,體內活性氧堆積超過了CAT 和GSH-Px 的清除能力,所以體內過多有毒自由基對CAT和GSH-Px的活性產生了抑制作用[33]。
POD 與生物應激有關,能將過氧化氫水解,可以對細胞起保護作用。本實驗結果顯示,中間球海膽隨熱脅迫溫度升高,體腔液中POD 活性顯著上升,本實驗結果與丁文君等[15]、丁小豐等[34]、Wang等[32]研究結果一致,即隨水溫升高,海膽機體因高溫產生應激反應,POD活性升高以保護細胞免受損傷。
4 結論
隨溫度升高,中間球海膽體腔細胞線粒體結構、腸組織線粒體的ATP 濃度、Ca2+濃度、ATP 酶活性以及抗氧化酶均發生一定變化。高溫使中間球海膽的線粒體發生損傷,其中線粒體膜破損,線粒體基質密度顯著增大,嵴溶解;Ca2+濃度、Ca2+-ATP酶、Ca2+-Mg2+-ATP 酶活性顯著下降,Na+-K+-ATP 酶活性顯著升高,與高溫脅迫陸生脊椎動物相比不同的是,熱脅迫下中間球海膽ATP 濃度沒有顯著性變化。此外,中間球海膽熱脅迫后體腔液SOD 酶、POD 酶活性顯著升高,CAT、GSH-Px 酶活性顯著下降。綜上所述,在生理水平上,中間球海膽通過調節線粒體結構與功能及抗氧化酶活性以響應熱脅迫。
本實驗有助于從生理水平上闡明中間球海膽如何響應高溫脅迫,為以后篩選耐高溫中間球海膽提供了一定參考,也為后續研究海膽響應高溫脅迫的分子機制提供依據。

