基于高通量測序技術的新疆哈密地區鹽堿地土壤細菌群落結構分析
李卓然,張子怡,阮愛東,魯 祥,武 帥
(水文水資源與水利工程科學國家重點實驗室/河海大學水文水資源學院,南京 210098)
中國鹽堿土總面積約為3.6×107hm2,占全國可利用土地面積的4.88%[1],主要分布在內陸干旱和半干旱地區,其中鹽堿耕地主要分布在黃淮海、東北平原地區,鹽堿荒地主要遍布在西北地區[2]。其中,內陸鹽堿地面積占全國鹽堿地總面積的95%[3]。
新疆地處干旱半干旱地區,具有氣候干旱、降雨稀少、晝夜溫差大等特點,一些地區耕地、草地鹽堿化嚴重,且呈逐漸加重的趨勢。新疆灌區耕地總面積達398.78×104hm2(不含旱地),其中鹽漬化面積達127.90×104hm2,占灌區耕地總面積的32.07%[4]。由于鹽堿地面積大,蒸降比失衡,地形封閉或低平,生長在其上的鹽生植物種類較多,如堿蓬(Suaeda glauca)、濱藜(Atriplex patens)、檉柳(Tamarix chinensis)等,這類植物具有很強的耐鹽性及耐旱性[5]。鹽生植物不但能適應高鹽和干旱的極端環境,還能改良鹽堿地土壤。20世紀90年代以來,許多學者將其作為生物手段修復鹽堿地的天然寶貴資源,進行了大量的研究[6]。地表植被類型的變化與土壤性質密切相關,尤其是土壤細菌的群落多樣性[7]。土壤細菌多樣性對環境的作用主要通過不同生物群落代謝功能與強度的差異性實現[8]。此外,土壤細菌群落結構及其代謝功能對于環境變化十分敏感,可及時反映土壤質量的變化趨勢,是評價土壤變化的重要指標[9,10]。因此,對不同植被群落下土壤細菌群落結構的研究能加深對當地土壤環境狀況的了解。隨著人口增長和經濟發展的壓力以及改善生態環境的需要,鹽堿地土壤資源和耐鹽植物資源將會變得更加重要[11],然而新疆荒漠植物對土壤細菌多樣性的影響研究仍未得到廣泛重視。
本研究以新疆哈密地區鹽堿地土壤為研究對象,采用Hiseq高通量測序方法,對裸地和灌叢下土壤細菌群落組成、結構與代謝功能進行研究,探究鹽堿土壤中影響細菌群落的關鍵環境因子。研究成果初步揭示了新疆哈密地區荒漠化鹽堿土壤細菌群落結構及其可能的影響機制,可為新疆荒漠化環境治理提供基礎性數據,同時為荒漠化地區的植被恢復與生態穩定性提供理論依據。
1 材料與方法
1.1 研究區域與土壤樣品采集
研究區位于新疆維吾爾自治區哈密市伊吾縣幻 彩 湖 周 圍(43°23′25.70″N、94°16′14.93″E,海 拔1 896 m)(圖1)。哈密市地域遼闊,天山山脈橫貫哈密中部,特殊的自然地理條件使哈密兼有南疆和北疆的氣候特點,哈密屬典型的溫帶大陸性干旱氣候,干燥少雨,晴天多,年平均氣溫10.04℃(1953—2014年),年降水量38.2 mm(1953—2014年),年蒸發量3 300 mm[12]。該地區土壤為典型的鹽堿土,區內植被以堿蓬、霸王(Zygophyllumxanthoxylon)等旱生灌木和芨芨草(Achnatherum splendens)、沿溝草(Catabrosa aquatica)等禾本科植物為主,并有少量駱駝蓬(Peganum harmalaL.)等半灌木或草本植物,多以斑塊狀分布。
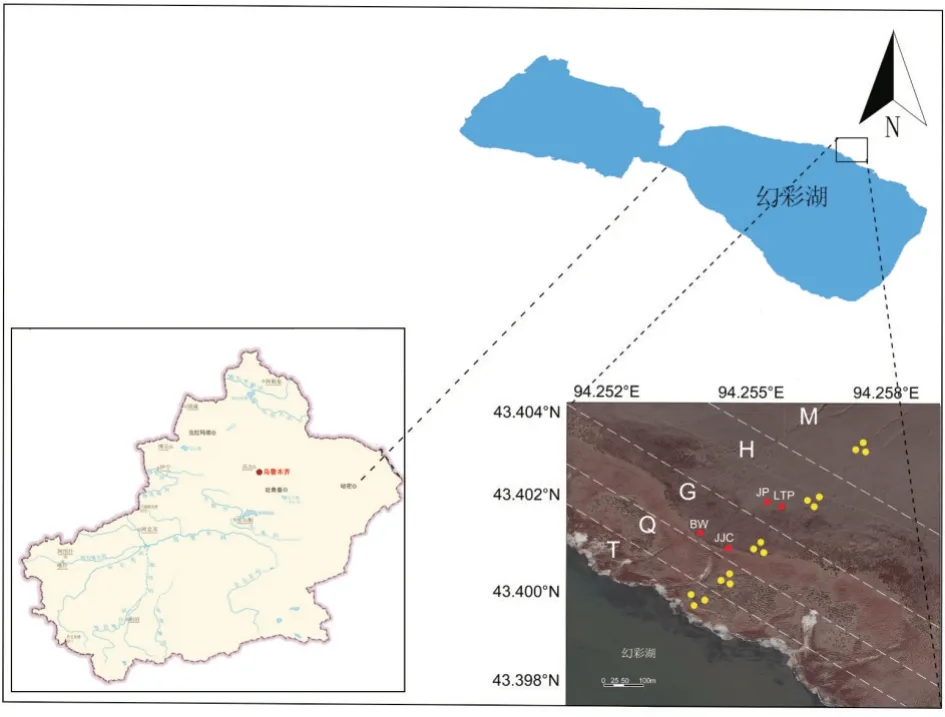
圖1 新疆哈密市幻彩湖采樣點
樣品采集于2019年9月下旬,采樣地點為天山北麓東段山腳到幻彩湖邊的一片鹽堿地。將采樣區域以不同優勢植物種類劃分為5個區域,不同區域離湖由遠到近分別命名為M、H、G、Q和T,其中山腳處至湖邊的無植被區域命名為M區域;H區域優勢植物是堿蓬,在區域內呈斑塊狀分布,另有少量駱駝蓬零散分布其中;G區域優勢植物是芨芨草,同樣在區域內呈斑塊狀分布,另有少量霸王零散分布其中;Q區域全部被優勢植物沿溝草覆蓋,未見其他植被物種;T區域是幻彩湖邊無植被消落區。各采樣點地勢平坦、處于自然狀態或少受人類活動干擾狀態。在各區域分別設置3個平行采樣點,去除表層1 cm土壤,采集表層(1~10 cm)非根際土壤,命名為樣品M、H、G、Q和T。另外分別在H和G區選取生長良好的堿蓬、芨芨草、駱駝蓬、霸王各1叢,在每個灌叢下方接近根系處采集表層(0~10 cm)土壤,分別命名為樣品JP組(堿蓬)、JJC組(芨芨草)、LTP組(駱駝蓬)和BW組(霸王),再將其等量混合樣品命名為樣品R組。將樣品裝入無菌自封袋后低溫帶回實驗室。在實驗室內將各樣品分為2份,分別保存于-80℃冰箱和4℃冰箱,用于DNA提取、測序和土壤理化性狀的測定。
1.2 土壤理化性質的測定
將采集到的所有土壤樣品進行處理,經自然風干、研磨過篩(2 mm)后,測定其理化性質,包括土壤pH、電導率(Electrical conductivity,EC)、有機碳含量(Total organic carbon,TOC)、全碳含量(Total carbon,TC)、全氮含量(Total nitrogen,TN)。
將上述風干土壤樣品與去離子水按1∶5混合后用pH計(Testo 206-pH2)和電導率儀(DDS-307A)測定土壤pH和電導率;土壤有機碳含量使用TOC儀(Multi N/C2100)測定;利用干式燃燒法并使用元素分析儀(EA4000,德國,JENA)測定土壤全碳和全氮含量。另取各原始樣品,采用烘干法測定土壤含水量。
1.3 土壤細菌DNA提取和高通量測序
將上述等量土樣冷凍干燥后,交由百邁克基因組測序公司(北京)采用MN NucleoSpin 96 Soi試劑盒進行DNA提取;用515F(5′-GTGYCAGCMGCCGCGGTAA-3′)和926R(5′-CCGYCAATTYMTTTRA GTTT-3′)引物對V4~V5可變區進行擴增。將合格的PCR產物在Hiseq nova平臺上進行高通量測序。測序數據已上傳至NCBI中的SRA數據庫,編號為PRJNA784184。
1.4 數據處理與分析
對原始數據進行拼接(FLASH[13],version 1.2.11),將拼接得到的序列進行質量過濾(Trimmomatic[14],version 0.33),并去除嵌合體(UCHIME[15],version 8.1),得到高質量的Tags序列。在相似性97%的水平上對序列進行聚類(USEARCH[16],version 10.0),以0.005%的群落相對豐度作為閾值展開過濾,獲得最終OTUs信息表[17]。利用RDPclassifier[18]對每條序列進行物種分類注釋,比對Silva數據庫[19],設置置信度閾值為0.8。
利用Mothur軟件計算α多樣性指數(Simpson、Shannon、Chao、Ace、Coverage),利用R語言ggplot2包繪制物種相對豐度圖。利用GraphPad Prism 9繪制α多樣性指數折線圖。利用R語言中PCoA分析不同區域土壤間菌群結構差異;利用R語言工具制作相關性Heatmap圖,分析環境因子與細菌門水平群落結構和α多樣性指數的關系。為了更深入地探索細菌群落與土壤理化性質的關系,利用R語言vegan包,通過VIF(Variance inflation factor,方差膨脹因子)分析對環境因子進行篩選,并利用Mantel檢驗和典范對應分析(Canonical correspondence analysis,CCA)對細菌群落結構和土壤性質之間的關系進行研究。
2 結果與分析
2.1 土壤理化性質分析
各土樣理化性質測定結果如表1所示。從表1可以看出,除區域M外,各區域土壤pH均偏堿性,且離湖越近pH越低,灌叢下混合土樣pH略低于其他裸露土樣。除臨近幻彩湖的2個區域土壤含水量較高(29.515%和38.629%)之外,其余土樣含水量均極低,值得關注的是灌叢混合土樣含水量僅0.595%。土壤TOC、TN和TC含量均在植被全覆蓋區域(Q組)中最高,而在區域H中最小,與含水量的變化呈相同趨勢。4種植物中,JP(堿蓬)的TN和TC要明顯高于其他灌叢下土樣和其所在區域土壤(H組),其余3種灌叢下土樣與其所在區域土壤TN、TC值相近。另外,JP的碳氮比在各灌叢下土壤中最低。JJC(芨芨草)的pH、含水量、TOC及EC值都低于其所采區域(G組),但TOC值和碳氮比要高于其余灌叢下土壤。土樣LTP(駱駝蓬)的pH最高,達8.810,大于各區域土壤pH;EC值遠小于其所采區域(樣品H組)。土樣BW(霸王)的含水量低于其余植被灌叢下土壤含水量,同時遠低于其所采區域土壤(土樣G組)的含水量;相比于G組EC值3.835 mS/cm,土樣BW的EC值遠小于該值,僅有0.659 mS/cm。在植物灌叢下土壤(R組)中的TN和TC要高于其在區域H和G的值。電導率EC在區域Q中最高,在區域M中最小,在區域H、區域G、區域Q、區域T仍與含水量變化相同。土壤碳氮比在區域H最高,在區域Q最低。
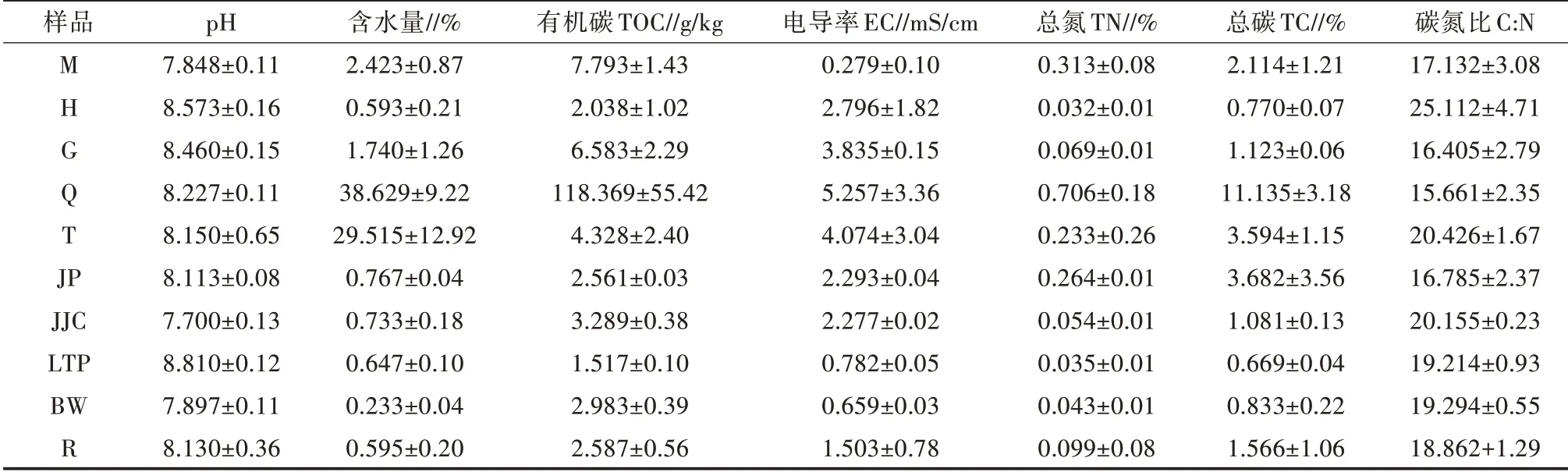
表1 不同區域的土壤理化性質
2.2 土壤物種注釋及組間土壤細菌群落差異分析
采用高通量測序和分類學對土壤樣品進行分析(圖2),全部樣本共獲得1 322個OUT,得到細菌23個門類44個綱103個目178個科379個屬以及489個種。基于物種注釋結果,在門分類水平上選擇最大豐度的前10種,對相對豐度柱狀圖進行分析。該細菌群落主要由擬桿菌門(Bacteroidetes)、變形菌門(Proteobacteria)、浮霉菌門(Planctomycetes)、放線菌門(Actinobacteria)、酸桿菌門(Acidobacteria)、廣古菌門(Euryarchaeota)、疣微菌門(Verrucomicrobia)、異常球菌-棲熱菌門(Deinococcus-Thermus)、奇古菌門(Thaumarchaeota)、綠彎菌門(Chloroflexi)等組成。結果表明,不同樣本的優勢菌門組成和比例存在顯著差異,主要優勢菌門為變形菌門、擬桿菌門和放線菌門,總和占36.54%~66.43%。隨各區域離湖距離的減小,放線菌門的相對豐度呈下降趨勢。樣品JP和JJC作為區域H和區域G的優勢植物灌叢下土樣,其物種組成分別與土樣H、土樣G呈相似的特點,且其中擬桿菌門相對豐度顯著高于其分別所在區域非根際土壤。對于4種植物灌叢土壤,廣古菌門和異常球菌-棲熱菌門在堿蓬、芨芨草灌叢土壤中的相對豐度遠大于其在駱駝蓬和霸王土壤中的相對豐度,而奇古菌門則正相反,其在駱駝蓬土壤中的相對豐度遠大于其在堿蓬與芨芨草土壤中的相對豐度。擬桿菌門在堿蓬、芨芨草和霸王中的相對豐度要大于其在駱駝蓬土壤中的相對豐度。
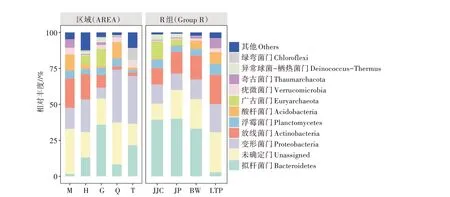
圖2 細菌門水平上的相對豐度
2.3 α多樣性分析
由表2可見,區域Q的土壤細菌多樣性較高,在不同區域土壤間,ACE和Chao1指數反映出相似的規律,區域H最低,區域Q較高,區域M大于區域G。均勻度指數(Simpson和Shannon指數)趨勢較為相似,即先下降后上升再下降,且區域M較高,區域T最低,區域T土壤細菌雖然多樣性較高但均勻度很低,反之區域M均勻度相對較高。各區域細菌α多樣性指數與其理化因子的變化趨勢相近,而細菌群落均勻度指數并未出現相同的趨勢。
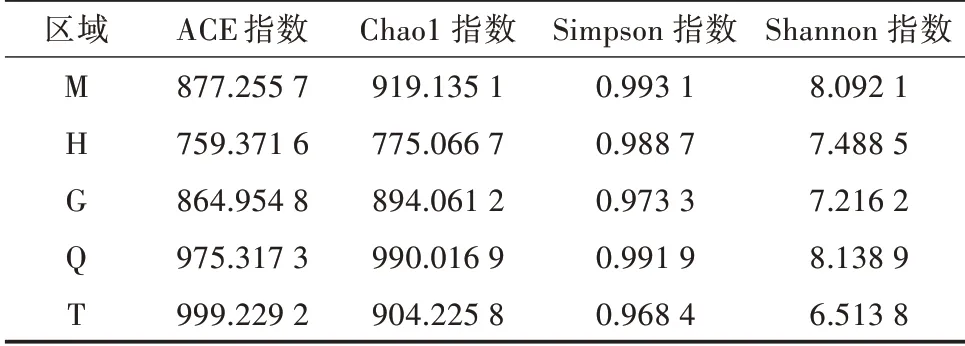
表2 不同區域的α多樣性指數
2.4 β多樣性分析
基于Bray-Curtis距離,在OTU水平上的PCoA分析揭示了不同采樣點的土壤細菌群落之間的相似性(圖3)。結果表明,在不同組分的采樣點發生了顯著分離,說明細菌群落結構受不同區域的影響差異較大。混合組R的4種灌叢下土壤較為分離,JP與JJC與區域G距離相近,LTP、BW分別與區域G、H距離相近。除JP外,其余灌叢土壤與其所在區域的相近關系與采樣結果一致。
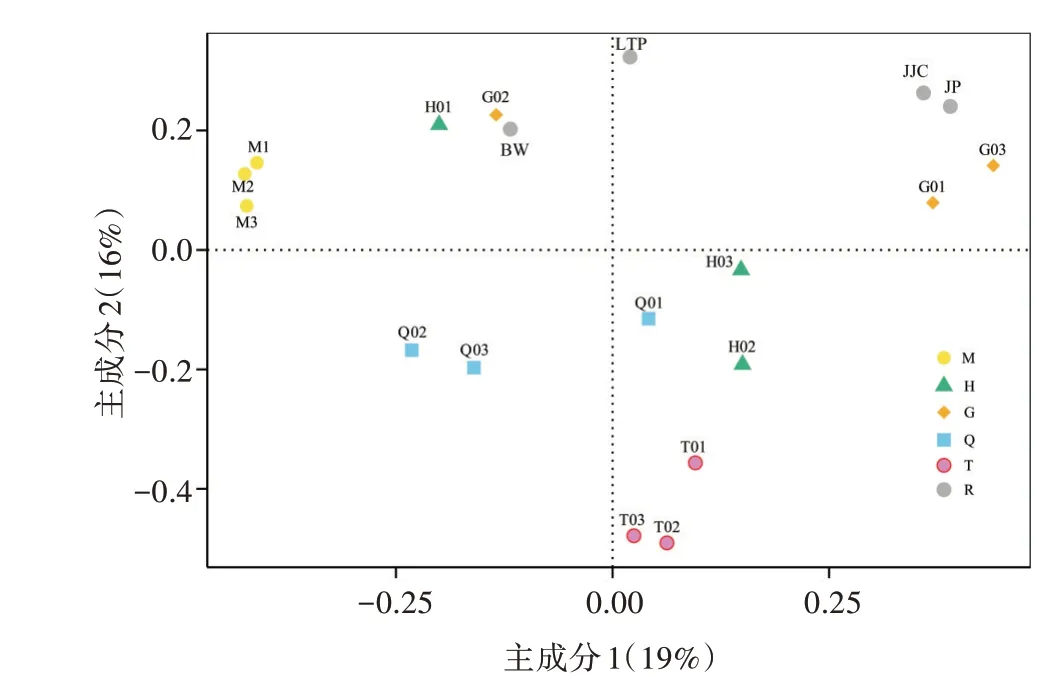
圖3 新疆哈密地區鹽堿土壤細菌β多樣性的主坐標(PCoA)分析
基于Bray-Curtis距離,OTU水平的置換多元方差分析結果顯示F=2.779 9,R2=0.516 72,P=0.001,組間差異極為顯著。根據Anosim分析,結果顯示R=0.61>0,P=0.001,表示組間差異顯著大于組內差異。
2.5 土壤細菌群落與理化性質的關系
圖4為不同區域土壤優勢群落與土壤理化因子之間的Spearman相關性分析。結果表明,在不同區域,電導率(EC)是影響細菌群落最顯著的環境因子,與電導率顯著正相關的優勢門有擬桿菌門(P<0.05)和異常球菌-棲熱菌門(P<0.01),EC越高,擬桿菌門和異常球菌-棲熱菌門占比越大。說明電導率對這2個優勢菌門占比影響較大。而在所有區域中均占優勢的變形菌門和放線菌門與這些環境因子均未顯示出顯著的相關性,說明理化因子對其他優勢菌門的分布影響極小。
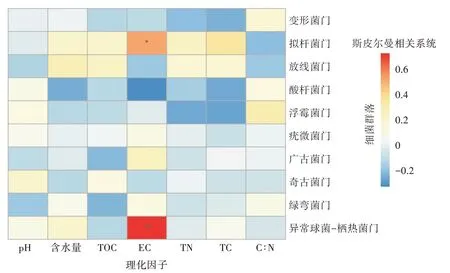
圖4 門水平上Spearman相關性分析
對α多樣性指數與土壤理化因子之間進行Pearson相關性分析(圖5)。土壤pH與ACE指數均呈極顯著正相關(P<0.01),說明pH對群落豐富度影響較大。而土壤含水量、有機碳、總碳、總氮等與細菌α多樣性指數無明顯相關性。
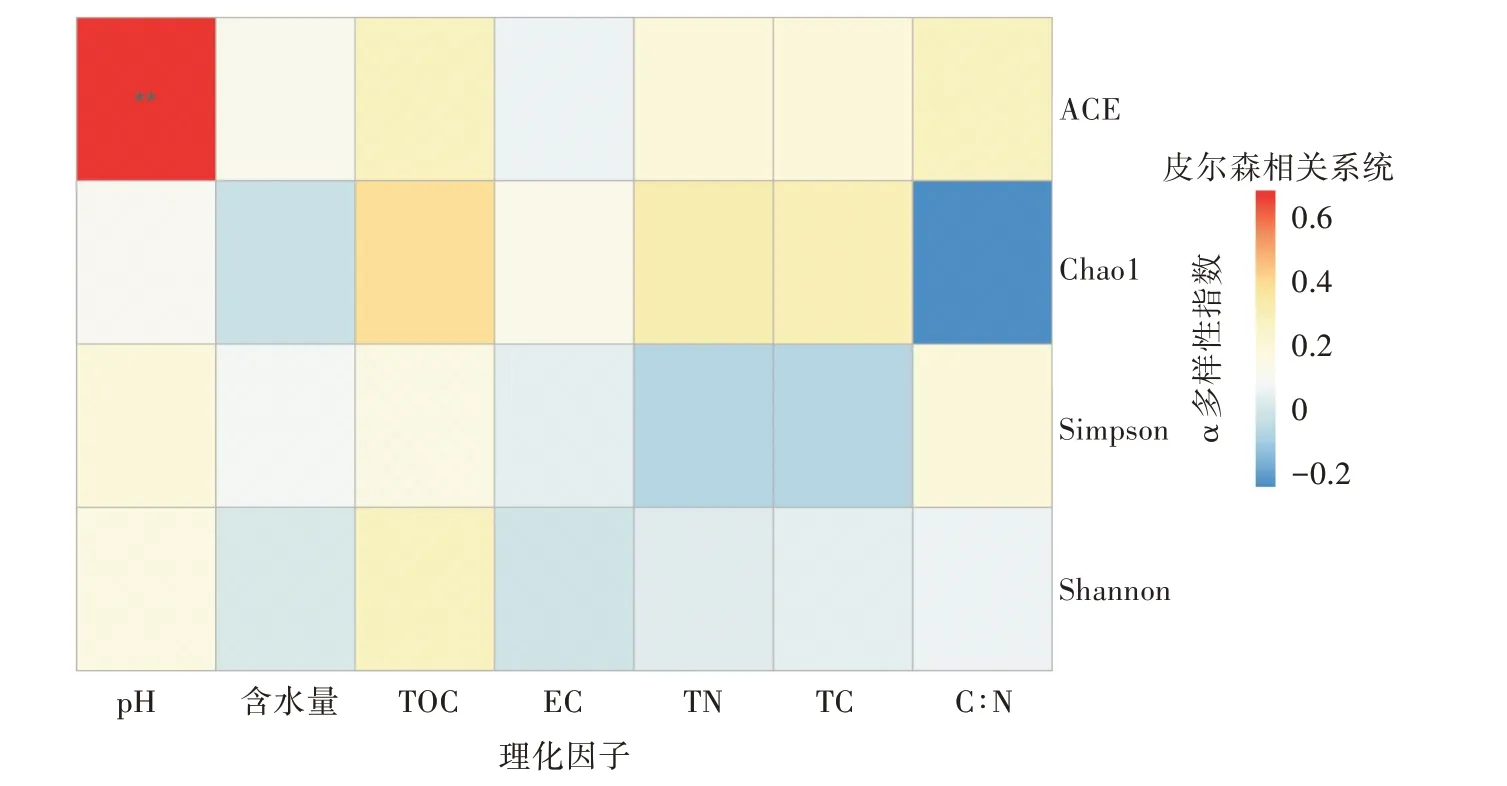
圖5 土壤理化因子與α多樣性指數的相關性分析
基于Bray-Curtis距離,在OTU水平上和理化因子進行Mantel檢驗(表3),Total為總群落,Sub1為細菌群落,Sub2為古菌群落。結果表明,總群落結構與pH呈顯著相關關系(P=0.044),細菌群落結構和pH呈顯著相關關系(P=0.038),而古菌群落結構與理化因子無顯著性相關關系。
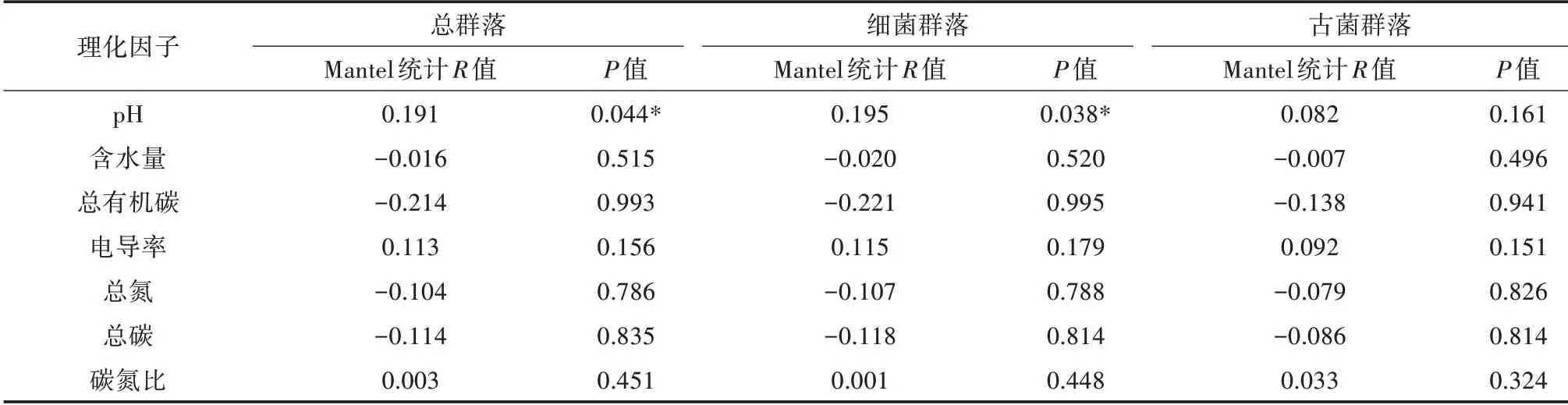
表3 基于Bray-Curtis距離通過Mantel檢驗分析細菌群落結構和土壤性質的關系
土壤細菌群落與環境因子的CCA分析(圖6)的前2個軸分別解釋了26.01%和22.82%的變異,這2軸共解釋了48.83%的變異。可以看出,在各理化因子的關系上,TOC、TC和土壤含水量與pH、C∶N呈負相關關系,pH和C∶N呈正相關關系,TOC與土壤含水量呈正相關關系。
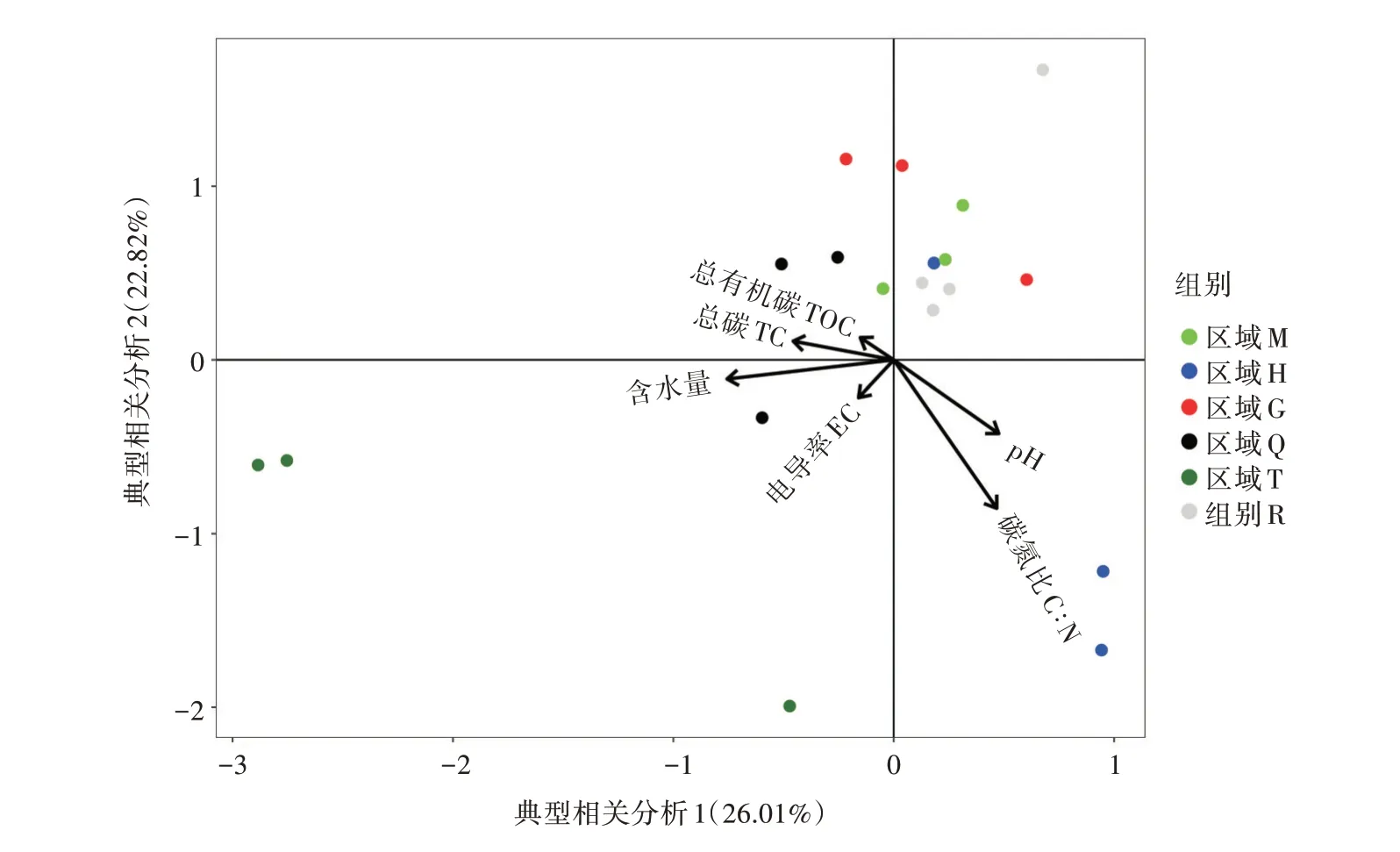
圖6 優勢菌群與土壤性質的CCA分析
2.6 土壤細菌群落功能預測
采用Tax4Fun2對細菌群落功能進行預測(圖7),得到各組之間細菌群落功能注釋存在顯著性差異,有16類功能基因相對豐度與區域變化有顯著響應關系。代謝方面,糖代謝和氨基酸代謝在細菌群落中高度富集。區域G的細菌群落功能注釋預測除在糖類代謝和氨基酸代謝的相對豐度較高之外,整體細菌群落功能注釋預測結果相對豐度比較低。隨著各區域離湖距離的減小,其生物降解和代謝呈逐漸上升的趨勢,說明距離幻彩湖邊越近的區域,代謝能力越強。在環境信息處理方面,信號傳導的相對豐度僅次于糖代謝和氨基酸代謝,且在區域Q豐度最高。在人類疾病和細胞過程這兩類一級代謝通路功能基因下,二級代謝通路功能基因均以區域G豐度最低。
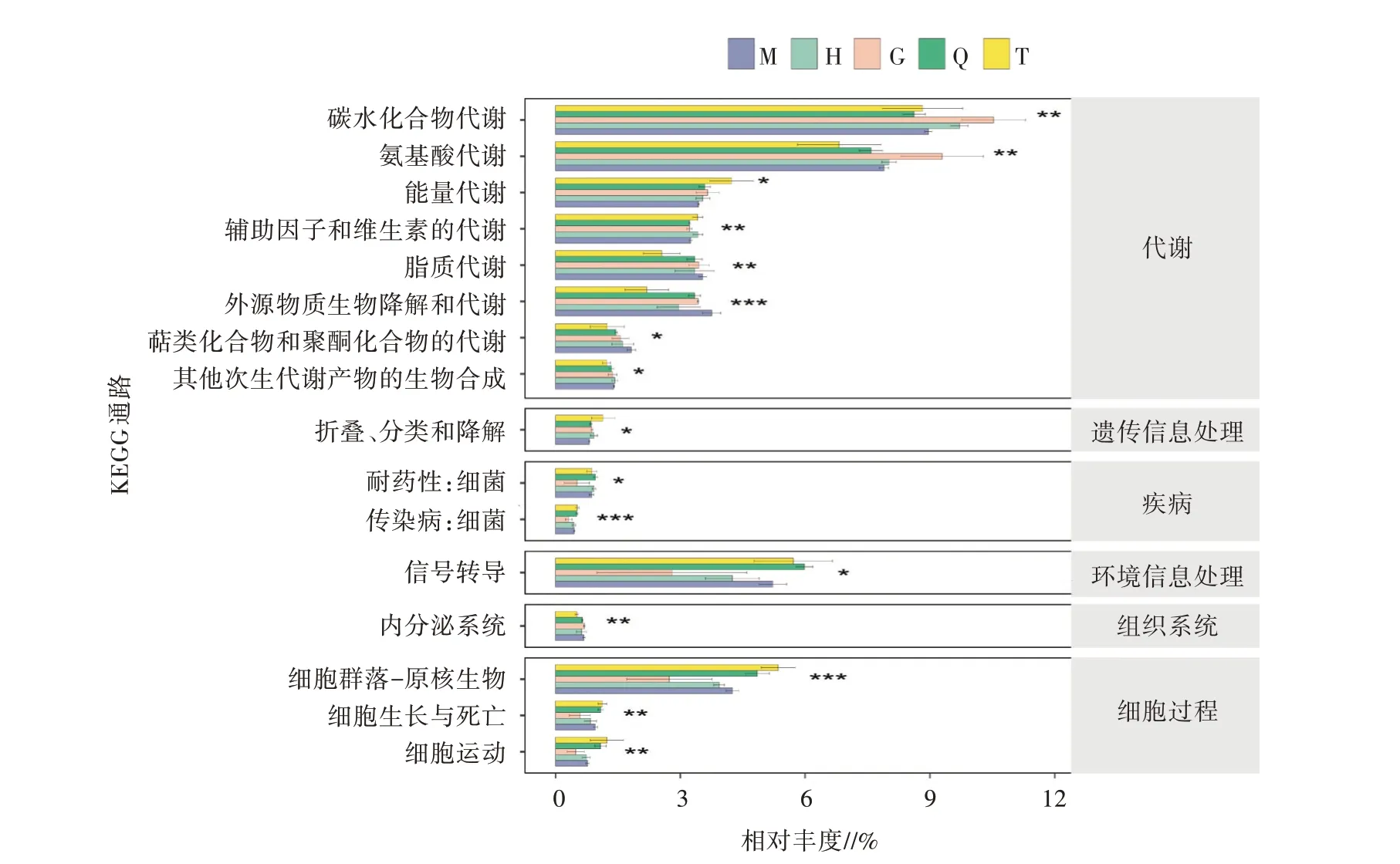
圖7 不同區域KEGG二級通路注釋功能相對豐度差異
3 討論
3.1 植被條件對土壤性質的影響
除樣品LTP外的3種植物JP、BW、JJC及R組的植物灌叢下土壤pH要普遍低于除區域M以外的土壤,這可能是植被凋落物產生的有機酸[20]導致土壤pH下降。從區域H到區域T離幻彩湖距離逐漸減小,土壤pH呈下降趨勢,其原因可能與生長于不同區域的優勢植物相關,因為鹽生植物可以對鹽堿土的理化性質進行改善,但不同種類的優勢植物對pH下降的影響程度不同[21]。在土壤含水量影響下,土壤TOC、TC和TN從干旱區域H到較為濕潤區域Q,呈上升趨勢。據報道,植物根系在土壤中縱橫交錯,其分泌物、脫落的根毛和根表皮細胞可極大地增加根系周圍土壤營養元素的含量[22],綜上所述,認為在新疆哈密地區不同區域中改變土壤性質的首要因素可能是植物。
細菌群落的分類學組成、多樣性和豐富度反映了土壤細菌對不同特征區域的響應。放線菌門在所有樣品中均為優勢菌門,在其他對相應植物土壤細菌[23,24]和其他干旱地區土壤細菌[25,26]的研究中放線菌門也占主要組成部分。這是因為放線菌門是一類能很好適應諸如干旱和高鹽等環境脅迫的菌群,并且能在貧瘠土壤中生存[27,28]。
細菌多樣性和豐富度最高的區域為區域Q,這可能是由于該區域土壤含水量高,土壤中有更多的營養物質,而細菌的數量與土壤有機質含量呈極顯著相關[29]。M區域均勻度指數較高,這可能與該區域為無植被區域有關,M區域與其他區域相比并沒有植被因素影響該區域的細菌群落組成,因為植物應對鹽堿脅迫的過程中,會發生一系列反應,根部會產生各種分泌物,有研究[30]發現根系分泌物的組成和量的微小變化會導致根系區微生物種群的重大變化。不同區域的細菌群落結構表現出組間差異大于組內差異,其可能受到不同區域土壤含水量變化和不同優勢植物的影響,因為干旱可能通過調節水分有效性直接影響根細菌群落,也可能通過改變土壤化學和植物表型間接影響根細菌群落[31]。
3.2 細菌群落與環境因子的關系
研究表明,電導率是影響土壤細菌群落結構的主要因素之一[32]。優勢菌門中的擬桿菌門和異常球菌-棲熱菌門與電導率呈顯著正相關,土壤電導率對土壤細菌群落的影響主要是通過對擬桿菌門的影響來完成的。
α多樣性指數中的ACE指數與pH呈顯著正相關,說明該地區細菌群落多樣性和豐富度在一定范圍內與pH呈正相關。在Mantel檢驗中同樣表現出群落結構與pH呈顯著性關系,這與Fierer等[33]的結果一致。土壤pH作為影響細菌群落主要因素的原因可能為以下幾點。首先,土壤pH可能不會直接影響細菌群落結構,而是作為一個綜合變量,直接或間接影響土壤性質如土壤水分狀況和鹽度等[34]。其次,土壤pH的微小差異(僅0.10)可能導致多種細菌群落變化[35],說明pH可以在小范圍內影響細菌群落結構的變化。
4 結論
基于Illumina Hiseq高通量測序技術,對新疆哈密地區鹽堿地土壤與4種灌叢下土壤細菌群落進行研究。在理化因子方面,除天山山腳下區域M,植物灌叢下土壤pH要普遍低于各區域土壤pH,隨各區域離湖距離逐漸減小,優勢植物逐漸變化,同時土壤pH隨著土壤含水量的升高呈下降的趨勢;在細菌群落結構組成方面,擬桿菌門、變形菌門、放線菌門為優勢菌門,各組間群落差異明顯;土壤電導率對擬桿菌門和異常球菌-棲熱菌門影響顯著,土壤pH對細菌群落多樣性與組成影響最為顯著。植被條件可能是影響新疆哈密地區鹽堿地土壤性質的首要因素,而土壤pH可能為各區域細菌群落變化的主要影響因素;由Tax4Fun2功能預測可得,該地區土壤細菌群落的代謝功能在代謝和環境信息處理方面較為豐富,可能是干旱和鹽堿脅迫對相關基因有促進作用。本研究初步揭示了新疆哈密地區鹽堿地土壤細菌群落結構及其可能影響機制,可為荒漠化地區的植被恢復與生態穩定性分析提供數據支持和理論依據。

