減毒流感疫苗研究進展①
林晶英 顏子乙 顏靈逸 李明遠 崔亞利
(四川大學華西第二醫院檢驗科,出生缺陷與相關婦兒疾病教育部重點實驗室,成都 610041)
流感作為一種存在已久的急性發熱性呼吸道疾病,具有高傳染性。流感病毒主要通過空氣以飛沫傳播為主,也可通過病毒污染的物品間接傳播,人群對流感病毒普遍易感。流感病毒分為甲、乙、丙、丁等四型,其中甲型流感病毒可分為多個亞型,可造成人類嚴重的呼吸道疾病,并引起世界性大流行。本文主要介紹了當前控制人類流感感染的疫苗策略,但由于不斷的抗原漂移及減毒活流感疫苗的局限性,迫切的需要開發新的流感疫苗技術,評價疫苗的安全性和有效性。因此,本文還研究了反向遺傳學技術在新型流感疫苗研制中的應用,并對研發各種新型疫苗的策略進行了敘述與匯總。
1 甲型流感病毒及其疫苗研究
1.1 甲型流感病毒 甲型流感病毒(influenza A virus,IAV)屬于正黏病毒科病毒,病毒體具有包膜,核酸為單負鏈RNA,并分為8 段。病毒包膜中蛋白質最豐富的是血凝素(hemagglutinin,HA)和神經氨酸酶(neuraminidase,NA),其次是基質2(M2)蛋白。根據HA 和NA 病毒表面糖蛋白的抗原特性,將IAV 分為多個亞型,其中HA有16種(H1至H16),NA有9種(N1 至N9)[1]。目前的季節性流感中主要出現的是A 型流感H1N1 和H3N2。HA 通過與唾液酸受體結合,進入細胞病毒包膜與內體的融合。此外,HA 對細胞表面唾液寡糖具有特異性,故其是決定病毒趨向性和宿主特異性的主要因素之一[2]。NA 可去除唾液酸,將病毒從感染的細胞中釋放出來。M2蛋白負責內吞及病毒組裝后病毒體的酸化。病毒包膜下,有一個由基質1(M1)蛋白組成的蛋白質層,參與病毒體組裝及出芽。核轉運蛋白(NEP)存在于病毒顆粒內,主要作用是將病毒復制后期的8種vRNP復合物從細胞核轉移到細胞質。這些vRNP 是病毒體的核心,包括被病毒核蛋白(viral nucleoprotein,NP)包裹的8 個vRNA 片段及由酸性聚合酶(acid poly‐merase,PA)、堿性蛋白1 和2(PB1,PB2)3 個亞基組成的RNA 聚合酶(圖1)。8 個vRNA 片段(PB2,PB1,PA,HA,NP,NA,M 和NS)包含較長的中央編碼區,兩個末端為非編碼區,這些區域對于vRNA 基因組的復制和轉錄至關重要,而且在每個vRNA 片段的3'和5'末端,包含病毒組裝所需的包裝信號[3]。
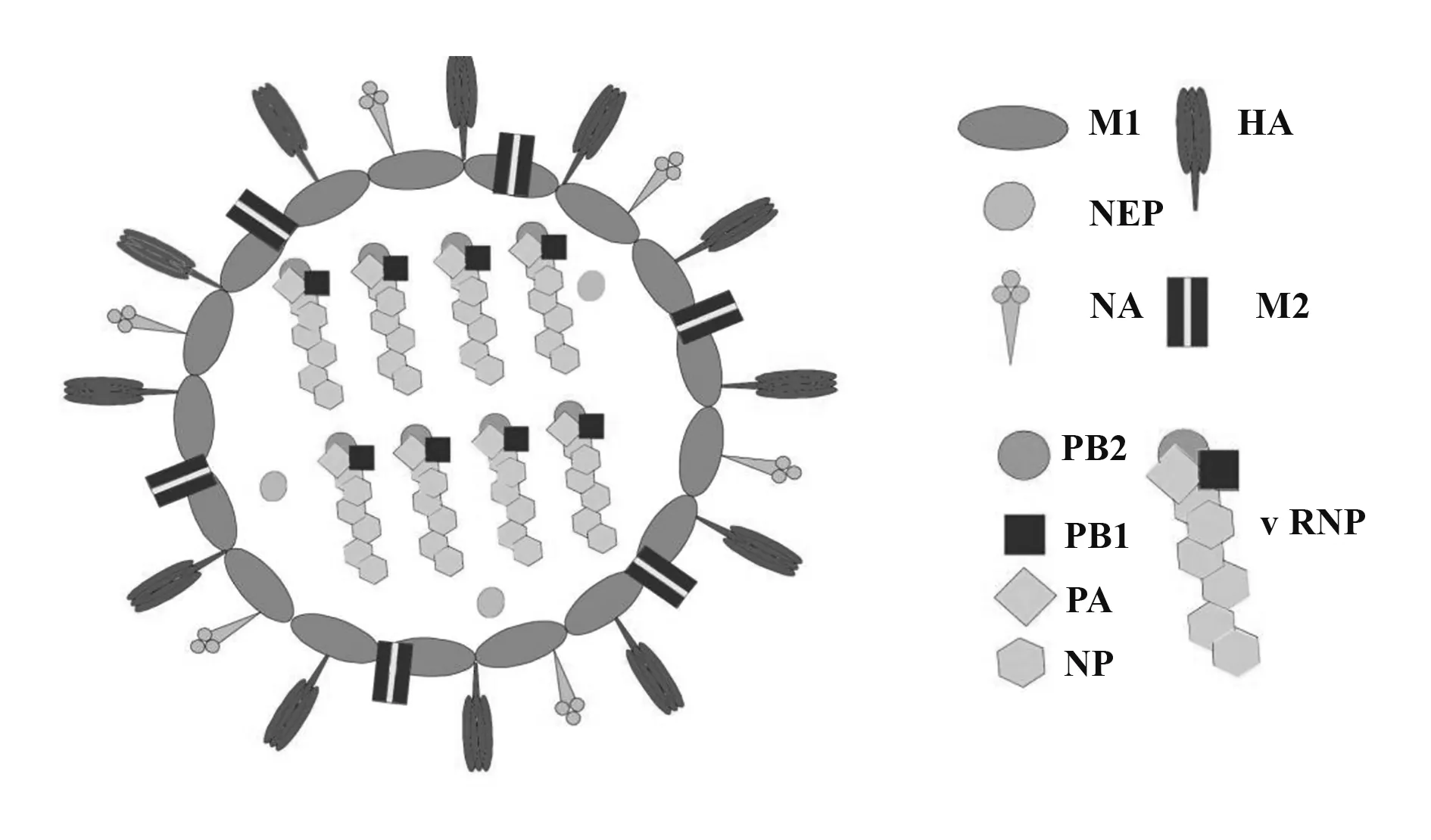
圖1 甲型流感病毒結構Fig.1 Structure of Influenza A virus
乙型流感病毒(influenza B virus,IBV)常引起局限性流行,且只在人類之間傳播。乙型流感病毒同樣由8 個RNA 節段構成,但與IAV 不同的是,IBV 表面除了主要的HA、NA 蛋白和M1 蛋白外,還有BM2離子通道和NB 離子通道,主要用于病毒的脫殼和組裝(圖2)。乙型流感病毒在對宿主細胞的侵染過程同甲型流感病毒大體一致。
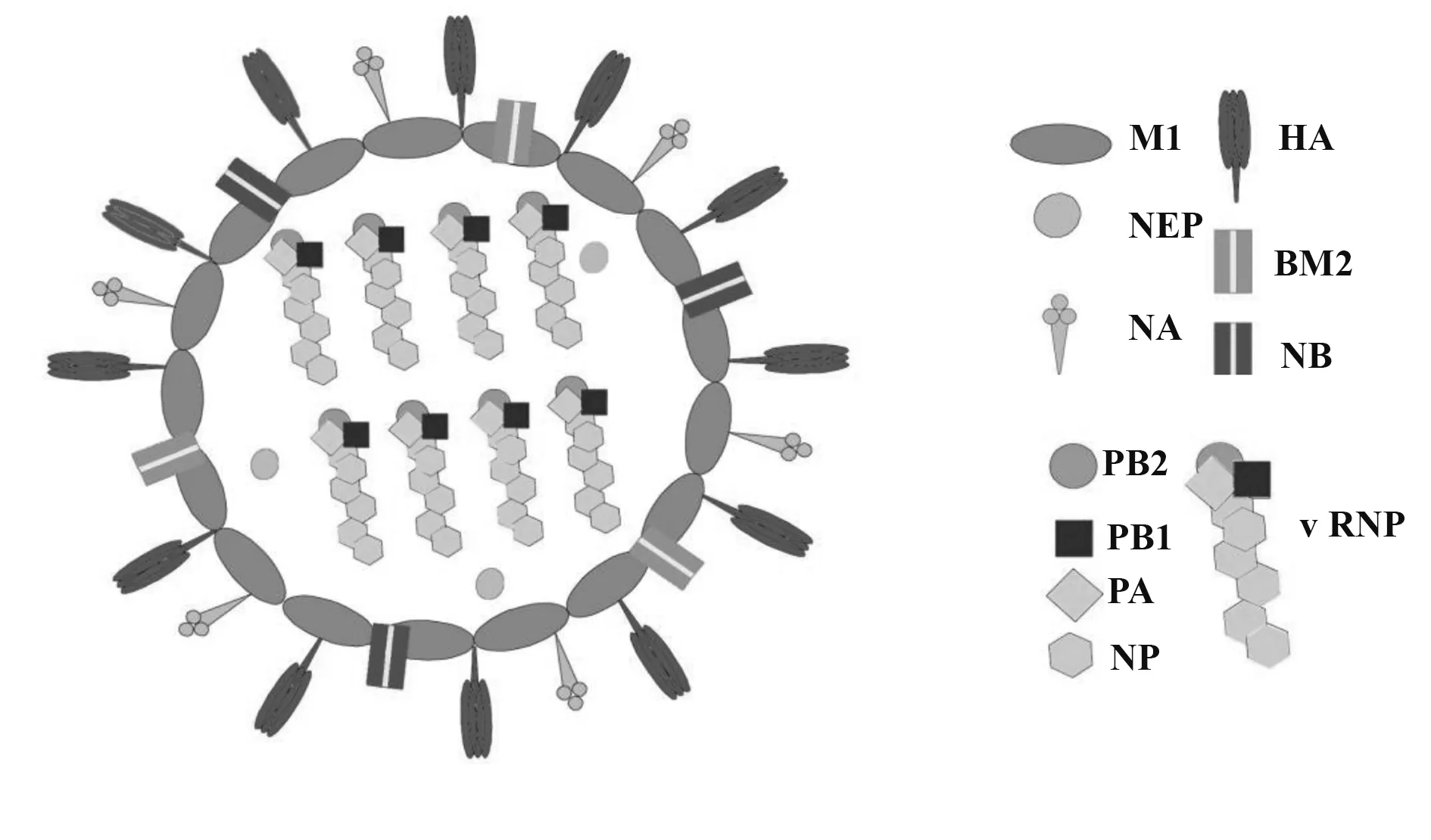
圖2 乙型流感病毒結構Fig.2 Structure of Influenza B virus
1.2 當前控制人類流感感染的疫苗策略 IAV 每年都會反復流行,導致人類輕度至重度呼吸系統疾病甚至病死,對公共健康和全球經濟構成威脅。目前,接種疫苗仍然是避免人類感染季節性IAV 最有效的手段。盡管每個國家對接種疫苗的策略各不相同,但美國免疫實踐咨詢委員會建議,每年要為所有6 月齡以上的人接種流感疫苗[4]。由于不斷的抗原漂移,因此每年要更新疫苗的配制,以確保疫苗中包含的HA 和NA 與季節性流行病毒相匹配。抗原漂移是流感病毒在復制過程中HA 基因和NA基因發生點突變后累積產生的結果,發生抗原漂移的甲型流感病毒可再次感染先前已獲得免疫的宿主,進而導致流感的反復流行[5]。
目前流感疫苗主要有滅活流感疫苗(inactivate influenza vaccines,IIV)、減毒活流感疫苗(live-atten‐uated influenza vaccines,LAIV)、HA 重組疫苗、DNA疫苗、亞單位疫苗和類病毒顆粒疫苗等幾種,其中IIV 及LAIV 為主[6]。IIV 是預防流感最常用的疫苗,也是第一批獲得許可的流感疫苗。IIV 于1940 年開始使用,開始為僅包含一種甲型流感病毒亞型的單價制劑,但通過大規模研究證實其可有效預防流感流行。IIV 通過將WHO 每年推薦的病毒株與另一株生長迅速的流感病毒共同感染雞胚,在感染后2~3 d 獲得重配病毒。該重配病毒在生長迅速的流感病毒HA、NA 中和抗體存在的條件下,選擇得到包含來自WHO 推薦病毒的HA 和NA 片段及來自生長迅速的流感病毒的6個內部片段。將重配病毒純化和濃縮,并用甲醛或β-丙內酯滅活即可得到IIV(圖3)[7]。IIV 通過肌注接種,在預防流感感染相關的發病率及病死率方面具有60%~90%的有效性。但是,IIV 誘導的T 細胞所介導的免疫應答有限,且該免疫應答主要為病毒株亞型特異性,因此IIV只能引起短期的特異性免疫過程,且對變異產生的新流感病毒無中和作用。
圖3 流感滅活疫苗(IIV)的生產Fig.3 Production of inactivated influenza vaccine(IIV)
與IIV相反,LAIV經鼻內接種,他們的感染途徑類似于病毒自然感染,誘導了更廣泛、更強大的免疫反應,包括黏膜免疫反應。更重要的是LAIV 可以在接種人群中引發特異性T 細胞介導的免疫反應,并對包括流行性流感病毒在內的其他病毒株提供交叉保護。與其他流感疫苗相比較,LAIV的保護性是具有明顯優勢的[8]。因為抗原漂移會直接影響疫苗效果,因此迫切需要研究出可以中和多個血清型病毒株(包括漂移株和不同亞型病毒株)的疫苗,為流感預防提供廣泛的交叉保護,LAIV恰恰是在這方面最具優勢候選疫苗。
LAIV 由WHO 推薦候選病毒及主供體病毒(master donor virus,MDV)的共同感染雞胚,感染2~3 d 后獲得重配病毒,該病毒包含來自MDV 的6個內部片段和來自WHO候選株的HA和NA片段。在針對MDV株表面糖蛋白中和抗體存在的情況下,25 ℃低溫擴增選擇,制備LAIV 疫苗,然后將所選的LAIV 鼻內接種(圖4)。這個過程最主要的是要確保所選的MDV減毒、冷適應且溫度敏感[9]。MDV在高溫(37 ℃或39 ℃)下復制能力較弱,較低的溫度(25 ℃至33 ℃)下具有高效的復制,這種特性使LAIV在較冷的人上呼吸道中有效復制,同時避免病毒在較熱的下呼吸道中復制引起疾病[10]。LAIV 經鼻腔內接種可能會導致病毒感染人體嗅球,這是一個嚴重的安全隱患;但通過舌下給藥可以克服這一風險,同時在防止致死性病毒感染方面同樣有效。
圖4 減毒流感活疫苗(LAIV)的生產Fig.4 Generation of live-attenuated influenza vaccine(LAIV)
傳統上被批準使用的流感疫苗主要為三價疫苗,包括兩種IAV 亞型(H1N1 和H3N2)和一種乙型流感病毒(IBV)譜系(Victori 型)。但自上世紀70 年代后,兩種乙型流感病毒(IBV)譜系(Victori 型和Yamagata 型)在人類中逐漸流行,FDA 在2012 年批準包含上述4 種抗原成分的四價疫苗制劑投入使用,四價疫苗可以對流感傳播中2種IBV 譜系以及2種IAV亞型(H1N1和H3N2)有效預防作用。在四價LAIV 中,2 個冷適應MDV 被用作主供體,分別從IAV(H1N1 和H3N2)和IBV(Victori 和Yamagata 型)中利用外部HA 和NA 糖蛋白產生4 種重配病毒[11]。由于尚未完全掌握其減毒機制,目前僅適用于未懷孕的2~49歲健康人群。
以往的研究表明,LAIV 的有效保護率為75%~80%,兒童預防效果更好,但依舊沒有成為優于IIV的推薦使用疫苗。LAIV 在控制流感病毒感染方面的優勢在于通過鼻內接種方式,可以誘導比IIV 更強大和長期的體液和細胞免疫應答,但還需要研究其安全性、有效性、穩定性,同時應當優化其產能[12]。
1.3 反向遺傳學技術在新型流感疫苗研制中的應用 由于流感病毒容易變異,生產出穩定和具有交叉保護作用的流感疫苗一直是一項艱巨的挑戰。反向遺傳學理論使對流感病毒生物學特性有進一步的闡釋,包括與病毒基因組復制和轉錄、發病機制或病毒-宿主相互作用的機制等。反向遺傳學技術是通過對病毒基因組加以修飾,從而產生能夠表達外源蛋白的重組病毒作為疫苗載體,可提高LAIV的安全性、免疫原性和保護性,而且產生的重組病毒含報告基因,便于追蹤病毒感染或攜帶,以及預測其突變及減毒等[13]。
目前,已經研制出幾種基于質粒的反向遺傳學方法以生產重組流感病毒,最常用的方法是在易感細胞中同時表達陽性鏈病毒mRNA 和陰性鏈病毒vRNA 的8 種雙聯和雙向質粒。這種反向遺傳學技術是基于雙重啟動子概念,其中vRNA的cDNA拷貝克隆到攜帶RNA 聚合酶I(Pol I)啟動子的ambisense質粒中,以指導vRNA 合成;在相反方向,RNA 聚合酶II(Pol II)啟動子從同一cDNA 驅動mRNA 表達[14]。然后將8個“雙意義”質粒共同轉染到FDA推薦的細胞中,轉染3~4 d,可從轉染細胞的組織培養上清液中回收活病毒,然后在FDA 推薦的新鮮細胞或雞胚中擴增培養。
目前用于生產流感病毒疫苗的常用基質有雞胚以及哺乳動物細胞如MDCK 或Vero 細胞,Vero 細胞作為基質生產脊髓灰質炎疫苗已有多年的歷史,目前也被批準用于生產流感疫苗。其優點在于其生產原料來源不受限,能有效避免變異的發生,保護效果好。MDCK 細胞(Madin-Darby canine kidney cells)為犬上皮樣細胞,對大多數流感病毒敏感,增殖速度快,不易發生變異。盡管FDA在2012年批準通過細胞制備流感疫苗的方法,但目前尚不存在利用此種方法制備所需數量疫苗的設施,事實上目前大多數商業化的流感疫苗都是在雞胚中培養的。與反向遺傳學方法相比,用雞胚生產流感疫苗可以自然選擇帶有變異的病毒體,這是它在流感疫苗生產過程中的一大優勢[15]。但多數流感病毒在雞胚中生長不佳,影響疫苗制備效率,且雞胚生產時間長、難以自動化、易引起流感病毒變異等缺點,此外禽流感時影響其產量。基于病毒質粒的反向遺傳學方法則有著更快、更好制備流感疫苗的優勢。
此外,由于生物安全問題和病毒對雞胚的高殺傷力,傳統的流感疫苗制備方法不能用于生產高致病性流感病毒(highly pathogenic IAV,HPAIV)的疫苗,如H5N1[16]。而反向遺傳學方法可將H5 或其他HPAIV 減毒,這一優點讓流感疫苗研究領域對此方法格外感興趣。優化后的反向遺傳學方法可以替代傳統的疫苗生產方法,有可能成為應對流感大流行候選疫苗研發的首選方法。
2 LAIV研發的新策略
在過去的幾十年里,LAIVs 研究已取得長足的進步。但疫苗研究和生產仍然是一個緩慢的過程,特別是流感疫苗生產過程中會出現IAV 變異,常導致保護效力低于預期。因此,迫切需要新的方法來制備LAIV,以提其對高季節性和大流行性流感的有效性。
2.1 NS1 截短或缺陷病毒的LAIV IAV 非結構性蛋白1(NS1)在受感染的宿主細胞中早期即可表達,
并在病毒的復制周期中發揮多種作用。 NS1 是IFN 拮抗劑,可以抑制I-IFN 的產生和抗病毒作用,同時促進病毒復制,因此有修飾、截短或NS1缺失的IAV 因其拮抗IFN 的能力高度衰減,可作為新型LAIV。有研究對甲型流感進行截短試驗,分為野生型組(A)、NS1 截短組(B)和NS1 缺失組(C),NS1 截短組(B)又分為NS1 1-77、NS1 1-99 和NS1 1-126(數字范圍表示為氨基酸表達),研究顯示NS1截短或缺失的重組LAIV 可導致病毒在體內的衰減,且IFN 的表達與截短的長度有關(圖5)[18]。此外,在I/ II 期臨床試驗中已證實含有NS1缺陷型的三價疫苗制劑是安全的,且其能夠在健康成人中誘導高水平的抗體[19]。
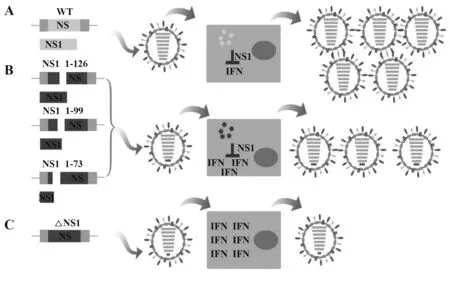
圖5 基于病毒NS1的截短和/或缺失的LAIVFig.5 LAIV based on truncations and/or deletion of viral NS1
2.2 次優密碼子的使用的LAIV 由于遺傳密碼的簡并性,大多數氨基酸由一種以上的密碼子編碼,被稱為同義密碼子。密碼子使用的偏嗜性是指物種之間和物種內部使用同義密碼子的頻率不相等,優選密碼子可影響基因表達、蛋白質翻譯及蛋白質折疊的水平[20]。研究人員利用病毒和宿主對密碼子的偏嗜性,以及新合成修飾病毒基因的新技術,研發了在流感病毒蛋白中使用次優密碼子來制造新LAIV 的方法。密碼子去優化是指使用病毒基因組中錯誤表達的密碼子來產生減毒病毒,通過將數百個同義突變整合到單個或多個IAV 基因中,可以制備新的LAIV。密碼子偏倚是指某些密碼子對比其他密碼子對出現的頻率更高,并且這種頻率在物種之間有所不同,通過將在宿主遺傳密碼中表現較少的密碼子組合來產生LAIV,并改變參與vRNA 合成和病毒傳播的病毒蛋白表達[21]。NS 片段也可被用于LAIV 的密碼子去優化,且其去優化程度越高的病毒,其毒力衰減越明顯。使用次優密碼子的IAV 必須在體外能有效復制,這對于疫苗生產很重要;而在體內卻要高度減毒,這作為LAIV 的安全性非常重要。因此,LAIV研發中次優密碼子的使用也是研發安全、有效的LAIV的一種策略。
2.3 病毒基因組重排在LAIVs 發展中的作用 基因組重排的IAV也可以被用作LAIV制備,與其他方法相比具有以下優點:由于基因組的重排,病毒不可能恢復到有毒力的WT 表型;可以通過改變病毒基因組的結構而不改變蛋白質表達來表達外源基因;病毒基因組的重排不影響病毒蛋白的免疫原性;同時表達其他HA 和/或NA 的重排病毒可被制作成二價LAIV 來抵抗多種病毒株。目前,基因組重排技術已被用于研究針對高致病性IAV(H9N2和H5N1)的LAIV,當H9N2-H5 重組病毒作為LAIV 注射到小鼠和雪貂體內時,可以有效保護其免受H5N1 和表達了H9 的pH1N1 重組病毒的致命攻擊[22]。這種基因重排技術與當前的疫苗生產是一致的,它可以用于快速生產更有效的LAIV,但需進一步研究這種疫苗的穩定性。
2.4 單循環傳染性IAV 作為LAIV 單循環傳染性IAV(sciIAV)是利用分子生物學技術,使病毒基因組突變、缺失或替換產生的sciIAV。這些病毒可能在病毒基因組合成、病毒組裝或病毒顆粒釋放方面有缺陷,因此在感染后缺乏傳播能力[23]。為了產生和制備sciIAV,需要在容納細胞系中反式提供缺失的基因產物以支持病毒繁殖,而在非容納細胞系中,可發生原發性感染,但不會產生感染性病毒顆粒。近幾年中,不同的sciIAV 已被用作包裝信號的研究、中和抗體或抗病毒藥物的篩選、耐藥性、HA 互補、NA 功能分析或疫苗開發[24]。使用sciIAV 作為LAIV的主要優點是可以誘導宿主產生免疫應答,而病毒不會復制和導致發病。但是,一些缺乏流感病毒聚合酶(PB2、PB1 或PA)片段的sciIAV 可能會降低病毒復制和基因轉錄水平,從而影響B 或T 細胞免疫應答的誘導和保護效果。
產生sciIAV 有以下幾種方法:具有病毒成分缺失或替換的sciIAV,是產生sciIAV最常見的策略,可以是完全或部分缺失病毒成分。基于病毒組分突變的SciIAV,可導致功能表達或加工喪失,無需刪除或替代完整的病毒基因。HA 切割位點的突變,使HA 不能與唾液酸受體結合。I AV 離子通道M2蛋白胞質尾結構域的缺乏,導致病毒不能脫殼。
2.5 基于過早終止密碼子的LAIV 最近研制出不具備復制能力的IAV 活疫苗,是基于過早終止密碼子(PTC)產生的。正常情況下,核糖體與tRNA 互補的三重密碼子將基因組序列翻譯成多肽;而三聯體UAG(琥珀密碼子)通常是翻譯終止信號或終止密碼子,導致多肽合成的終止。但在某些物種中,UAG 對應于tRNA 反密碼子(tRNACUA),它能夠在終止密碼子處引入非天然氨基酸(UAA)。PTC-4 是在IAV 片段PB2、PB1、PA 和NP中含有4個終止密碼子的無復制能力的PTC 病毒,其特點是在常規細胞中復制能力不足,但在含有表達正交tRNA(tRNACUA)的細胞中可有效復制,因此該技術作為LAIV 具有很高的安全性。此外,PTC-4 病毒可誘導強大的黏膜、體液和細胞免疫,從而對同源WT 病毒攻擊給予保護[25]。總之,這表明基于PTC 技術的LAIV,可實現對不同亞型IAV株的保護。由于這項技術相對簡單,它幾乎可以適用于任何可操作病毒。
3 結束語
疫苗接種仍然是預防和控制人類和動物流感的首選方法和有效手段,所以需要繼續評估季節性流感疫苗的安全性和有效性,以及開發新的流感疫苗生產技術。一般來說,LAIV在預防流感感染方面比IIV 更具優勢,但在使用中發現LAIV 對pH1N1 的保護效果欠佳。盡管LAIV 在2018~2019 年被重新批準季節性流感預防中使用,但四價LAIV 有效性降低仍是一個問題。國家過敏和傳染病研究所(NIAID)與流感研究和監測中心(CEIRS)提出,當前的首要目標就是開發出通用流感疫苗,這種通用疫苗要求適用于所有年齡段的人群,抗病毒有效性至少達到75%,在至少一年(最好是多個季節)內預防1 和2 組IAV。此外,通用疫苗還希望擁有類似于LAIV在上呼吸道有效復制的能力,以誘導更廣泛和持久的免疫應答。
反向遺傳學方法的實施縮短流感疫苗研究到生產所需的時間,極大地促進LAIV 的發展,更加利于針對大流行性流感病毒的LAIV 的開發。希望未來的流感疫苗可以增加體液免疫和細胞免疫反應,保護相同或不同亞型的IAV,且可在細胞系中批量生產,以進一步縮短生產時間。

