鞣花酸的制備及應用研究進展
屈艷君,王文慧,曹家南,汪育文,劉淼,沈才洪,宋萍
摘要:目的:綜述了鞣花酸和鞣花單寧的結構和來源、鞣花酸的提取和生物法制備工藝的研究進展,以期為鞣花酸的工業生產提供科學依據。方法:總結有關鞣花酸制備的研究性論文、綜述及書籍等。結果:固態發酵、液態發酵和酶轉化方法生產鞣花酸的工藝優缺點各異。結論:鞣花酸的應用前景廣闊,生產方式多樣,生物技術法生產鞣花酸是一種綠色高效的生產的方法。
關鍵詞:鞣花酸;鞣花單寧;固態發酵;液態發酵;酶轉化
鞣花酸是沒食子酸的二聚衍生物。自然界中的鞣花酸多以聚合形式存在,鞣花酸與糖之間用酯鍵相連形成可水解的單寧,即鞣花單寧(ETs)。鞣花酸和鞣花單寧具備多酚化合物的抗氧化性。相比于鞣花單寧,鞣花酸的分子量小,人體吸收效果好,更受關注,可應用于化妝品、保健品、飲料、醫藥等行業。此外,因鞣花酸具備多酚二內酯的結構,還可以應用于材料領域,作為共聚物、螯合劑、離子交換樹脂和電化學裝置等。因此,鞣花酸具有廣闊的應用前景。
1鞣花酸和鞣花單寧的結構
1.1鞣花酸
鞣花酸的4個酚羥基和2個內酯基具有親水性質,而2個苯環具有疏水部分,因此鞣花酸具有兩親特性。鞣花酸的水溶性低,僅微溶于水,在甲醇中的溶解度大大提高,在吡啶中也有較高的溶解度[1-2]。當鞣花酸作為藥劑開發時,有希望的溶劑是N-甲基吡咯烷酮、聚乙二醇400、三乙醇胺[1]。
1.2鞣花單寧
鞣花單寧由六羥基二苯甲酰基(HHDP)基團與葡萄糖通過酯鍵相連。HHDP基團是鞣花單寧的特征結構,由兩個3,4,5-三羥基苯甲酰基(沒食子酰基)單元碳碳鍵結合生成。鞣花單寧在酸或堿條件下,酯鍵被水解從而釋放出HHDP基團。HHDP基團是一個不穩定的基團,會進一步內酯化,從而生成具有高抗氧化活性的鞣花酸。鞣花單寧結構復雜多樣,到目前為止已經發現了1 000多種鞣花單寧。通過HHDP基團和沒食子酰基部分之間的C-O氧化連接,鞣花單寧可以形成高達幾千分子量的二聚體Sanguiin H-6,還可以形成三聚體和四聚體等。鞣花單寧也可以與其他類別的分子結合而產生雜化結構,形成Epiacutissimin B等化合物。
2鞣花酸和鞣花單寧的來源
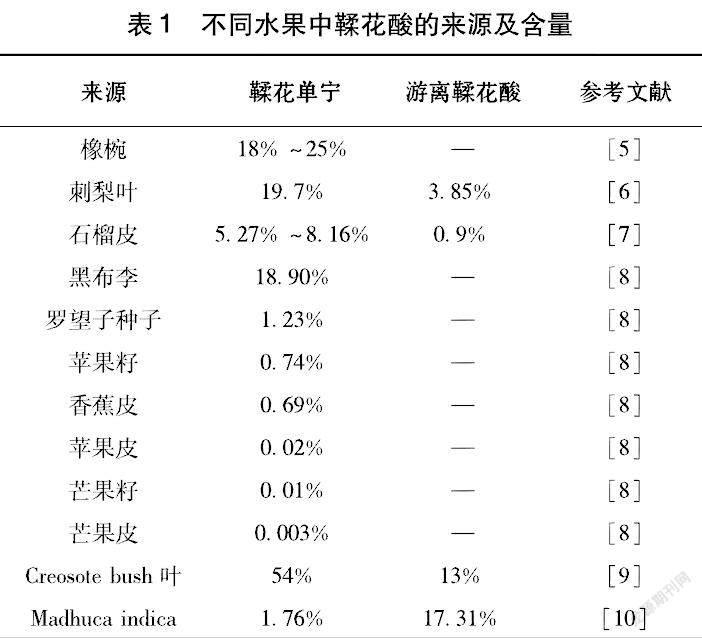
鞣花單寧廣泛存在自然界中,在樹莓、覆盆子、草莓等薔薇科植物中含量較為豐富,在刺梨葉中含量高達197.08 mg/g[3]。表1可見,100 g石榴皮中鞣花酸含量達到3.5 g,可以作為鞣花酸工業制備的主要原料[4]。我國是石榴生產大國,栽種面積居世界第一,年產量超過170萬t。石榴皮占石榴總重20%~30%,是果汁加工副產物,除藥用外大部分被廢棄,造成一定的資源浪費和環境污染。因此,充分、有效地開發利用石榴皮中的鞣花酸是實現農廢資源回收利用的有效途徑。
3鞣花酸的生產
鞣花酸的制備方法有3種:化學合成法、提取法和生物法。其中化學法利用沒食子酸或沒食子酯氧化聚合制備鞣花酸,產率可達到20%~30%,但是因為沒食子酸(酯)的生產過程非常復雜,并且獲得的產物中還摻雜醌類物質,使得鞣花酸的分離純化具有一定困難,故目前很少使用此法進行鞣花酸的生產[11]。本綜述主要討論提取法和生物法制備鞣花酸的研究進展。
3.1提取法生產鞣花酸
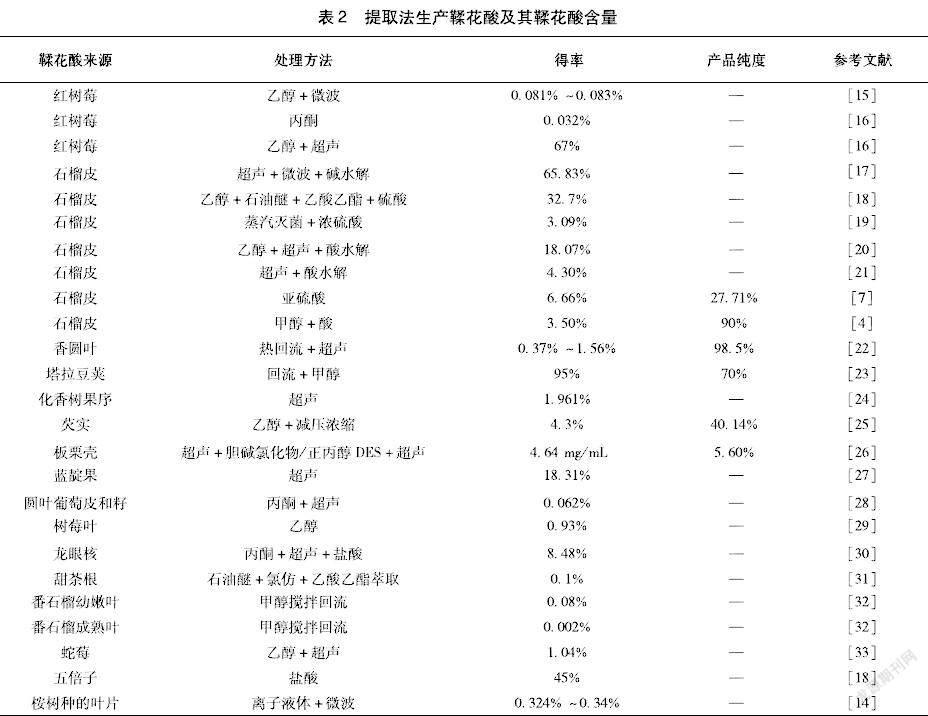
利用鞣花酸易溶于有機溶劑的性質,可以直接從原料中提取。通常使用乙醇、丙酮等溶劑作為萃取劑。對于一些鞣花酸含量比較高的薔薇科植物,例如樹莓可以單獨使用萃取劑提取。對于其他含有鞣花酸的原料還會在使用萃取劑的基礎上增加加熱、超聲、微波等技術,同時結合酸或堿水解,以獲得較高純度的鞣花酸(表2)。
提取過程的關鍵步驟是溶劑的選擇。甲醇/水或丙酮/水的混合物有較好的提取效率。Lei [12]通過比較這些溶劑混合物發現,1 g含鞣花單寧樣品加入10 mL溶劑(7 ∶3的丙酮/水的溶劑混合物),提取溫度維持60 ℃,不斷攪拌,并在提取過程中避免光照,提取12~24 h后過濾去除纖維、色素和其他化合物等雜質,利用蒸發除去溶劑,將含丙酮/水的提取物通過冷凍干燥,鞣花酸的產量最高可達到0.55%,鞣花單寧產量最高可達到6.72%。
結合水解可以增加鞣花酸的收率和純度。Lu[4]等采用甲醇提取石榴皮中的鞣花單寧,隨后用5%的硫酸水解5 h,并通過提取和重結晶進行純化,最終從100 g石榴皮中獲得3.5 g純度90%的鞣花酸產品。鞣花單寧也可以在堿性條件下水解獲得鞣花酸。五倍子為中國特有資源,是葉上的蟲癭,主要分布在川貴一帶,約含有50%~70%的鞣花單寧。雷焱[13]將蒸餾水與五倍子混合浸取,加入碳酸氫鈉和氫氧化鈉,得到48.46%粗鞣花酸產品,再通過對鞣花酸進行堿變性溶解,最后加入酸進一步純化,鞣花酸純度可達95%以上。該工藝常溫常壓下即可進行,產品純度高,生產成本約為國際市場價的20%左右。但是五倍子是昆蟲的尸體,用其制備的鞣花酸只能用于外用,而不能應用于食品和保健品領域。
離子液體可以替代傳統的揮發性溶劑。Chowdhury[14]使用質子型可蒸餾的離子液體[N1100][N(C1)2CO2]從兒茶和橄欖果中提取鞣花酸,提取率達到85%。這種方法效率較高,可以減少萃取中水的用量,該離子液體可以通過低溫蒸餾去除,在收率和能源成本方面較有優勢。另一種方法是使用離子液體輔助微波萃取蒸餾桉樹種葉片,同時提取鞣花酸、沒食子酸和精油[14],該方法具有高效、節能、省時且環保的特點。
3.2生物法生產鞣花酸
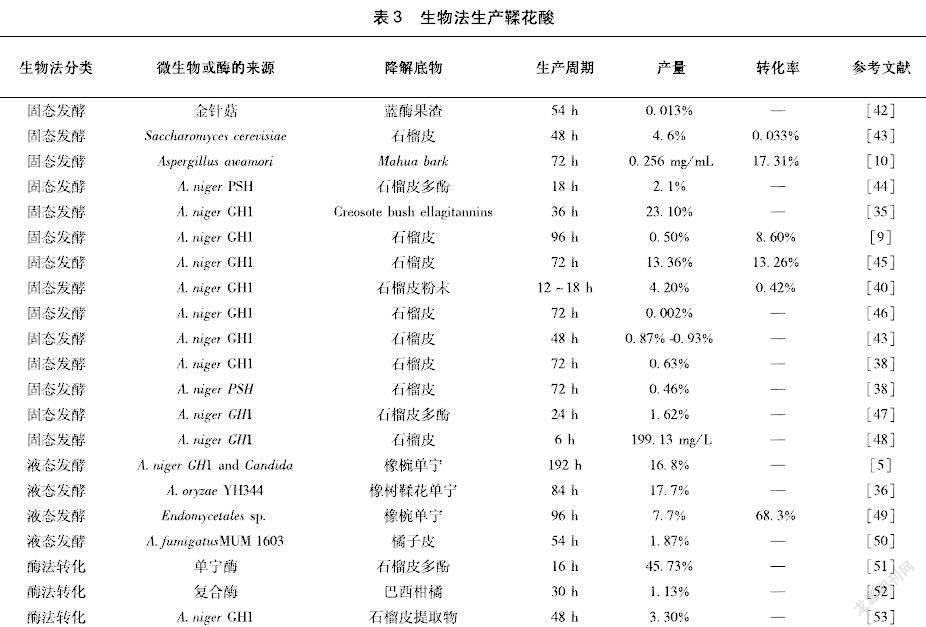
溶劑萃取結合酸解提取鞣花酸是傳統的方法,但是存在產率低、成本高和環境污染等缺點。鞣花酸產率低的主要原因是植物來源種類繁多,鞣花單寧結構復雜多樣、純化困難、處理過程易引入其他雜質[34-35]。因此,需要開發在產率和能源成本方面更有效的替代技術,以實現鞣花酸的高純度和大規模生產。目前,生物技術生產已成為一種有前途的替代方法(表3)。
3.2.1與鞣花單寧降解相關的酶單寧酶是鞣花單寧降解過程中研究比較多的酶,可以水解鞣花單寧中的酯鍵。單寧酶是一種誘導酶,在單寧酸和單寧存在的情況下可以誘導生成。單寧酶在各種真菌,細菌和酵母菌中廣泛存在。生產中常用的單寧酶生產菌主要是真菌,如黑曲霉A.niger和米曲霉A.oryzae[36-38]。隨著對生物法制備鞣花酸的深入研究,發現了另外一種參與鞣花單寧特異性降解的酶—鞣花單寧酶,也稱作鞣花單寧酰基水解酶(EAH)。鞣花單寧酶與單寧酶的酶解過程類似,都是降解鞣花單寧中的酯鍵,但是兩種酶出現的時間不一致。Aguilera-Carbo[35]在A.niger固態發酵雜叢灌木鞣花單寧過程中檢測了單寧酶(酶活檢測以沒食子酸甲酯為底物)和鞣花酸酶活性(酶活檢測以石榴皮多酚為底物),發現鞣花酸積累的時間與單寧酶酶活出現的時間不一致,卻與鞣花單寧酶酶活出現的時間一致,因此提出了鞣花單寧酶參與鞣花單寧降解過程的假設。Ascacio-Valdés[39]在A.niger固態發酵石榴皮提取物的過程中也發現了類似的現象,鞣花單寧酶出現的時間與鞣花酸大量積累期間一致、鞣花單寧酶的酶活更高、鞣花單寧酶和單寧酶最高酶活出現的時間不一致,因此作者推測HHDP基團與糖苷之間的酯鍵被具有高特異性的鞣花單寧酶降解,使得鞣花酸積累[39]。隨后,Juan A.Ascacio[40]通過變性和非變性電泳確定了存在特定降解鞣花單寧的酶,該酶分子量約200kDa,并且該酶由石榴皮鞣花單寧誘導產生。作者還推測了石榴皮鞣花單寧的降解途徑:石榴皮中鞣花單寧的主要成分安石榴苷在鞣花單寧酶作用下生成中間產物安石榴林,鞣花單寧酶進一步降解安石榴林生成gillagic acid,最后生成鞣花酸,但該研究并沒有指出這種特定降解鞣花單寧的酶是否就是鞣花單寧酶。
由于鞣花單寧結構的復雜性和多樣性,鞣花單寧的降解過程中除了單寧酶和鞣花單寧酶會直接參與[34],在一些鞣花酸的生產過程中還發現了多種酶的協同作用。Huang等[41]發現,在A.oryzae與Trichoderma reesei共培養降解橡椀單寧提取物時,鞣花單寧酰基水解酶、纖維素酶和木聚糖酶在生成鞣花酸的過程中存在協同作用。而在Ascacio-Valdés JA[39]用A.niger GH1固態發酵石榴皮提取物時,鞣花酸的產量與纖維素酶、木聚糖酶、β-葡萄糖苷酶、多酚氧化酶無關,僅與鞣花單寧酶相關。盡管已經對單寧酸的生物降解和一些簡單單寧酸的降解機理進行了許多研究,但對鞣花單寧等復雜單寧的斷裂途徑和參與降解過程的酶知之甚少。在積累機理上,仍然缺少一些中間體的具體降解過程。對于單寧酶和鞣花單寧酶之間的認知,目前僅知道兩者催化底物的不同和在同一催化過程中出現酶活峰值的時間不同,而對于兩者在酶學性質等信息仍然未知。
3.2.2固態發酵法制備鞣花酸固態發酵的發酵過程粗放、設備要求簡單,使得單寧酶的酶活高,發酵后鞣花酸濃度高易提取,菌體對底物的耐受濃度更高,不容易出現分解代謝阻遏和產物反饋抑制現象,而且單寧酶的胞外特性及其較強的pH和溫度穩定性,使得固態發酵廣泛應用于單寧酶生產和鞣花酸的制備研究[54]。根據固態發酵中固相的性質,可以把固態發酵分為兩種類型:一種是以農作物同時作為底物和固相的固體底物基質固態發酵;另一種是以惰性載體作為固相的惰性載體吸附固態發酵。在以石榴皮為固相時,Armando R[38]發現,A.niger GH1菌株可以將石榴皮總多酚在72 h內降解71%,發酵120 h后可以獲得6.3 mg/g的得率。當A.niger GH1菌株固態發酵的固相改為浸潤了鞣花單寧提取液的聚氨酯泡沫載體時,在30 ℃、1×107 個孢子/mL的孢子懸浮液、培養12~18 h的條件下,鞣花酸的最大產量為42.02 mg/g[39]。Aguilera-Carbo A[35]的研究同樣發現,A.niger GH1能夠在培養36 h時完全降解雜叢灌木的鞣花單寧,鞣花酸產率為23.1%。惰性載體吸附固態發酵與固體底物基質固態發酵相比,產物提取簡便,可以較容易地從惰性載體中提取到胞外產物,雜質含量少,載體可重復使用。
培養基和培養條件的優化也是鞣花酸固態發酵研究的重點。Rajiv Chandra Rajak[10]以印度的一種樹皮作為底物(含17.31%左右的水解單寧),通過A.awamori固態發酵,在料液比1 ∶2、溫度35 ℃、pH 5.5、培養72 h的條件下,單寧酶活性最高可達56.16 IU/gds,鞣花酸產量為0.256 mg/mL。Federica M等[43]以釀酒酵母作為菌種,在溫度25 ℃、濕度70%、1×106個孢子/mL的孢子懸浮液、pH 5、蛋白胨20 g/L、酵母提取物5 g/L、氯化鈉460 g/L,使用1∶100的固液比,用二甲基亞砜作為溶劑,鞣花酸的產量是46 mg/g。 不同的底物選擇也會影響鞣花酸的產量,Paranthaman R[55]采用茶的殘渣作為A.niger GH1固態發酵生產鞣花酸的底物,生成最大鞣花酸產量最佳條件是在35 ℃下持續96 h,最高可生產42.35 μg/g 鞣花酸。
單寧酶和鞣花單寧酶是誘導酶,通常會使用單寧酸或者單寧作為誘導劑,也可以將單寧酸和單寧作為唯一的碳源和誘導劑[56]。誘導劑和碳源的合適配比有利于單寧的降解。Aguilar-Zárate P用A.niger GH1固態發酵時,30 g/L安石榴苷用作碳源和誘導劑,添加少量麥芽糖(0.15 g/L)作為促進生長的碳源,可使鞣花酸和鞣花單寧酶產率提高至33.18 mg/L/h和33.70 U/L/h,與不添加麥芽糖的組做對照,分別提高2.8、1.5倍[48]。
在工藝及優化反應器方面,Sepúlveda L[45]優化A.niger GH1在托盤生物反應器上以石榴粉為載體進行固態發酵。使用Plackett-Burman設計篩選培養因子,結合中央復合設計評估培養條件。在最優條件下,鞣花酸產量達到132.62 mg/g,生產速率為0.24 g/L/h。此外,Buenrostro-Figueroa J[57]還開發了一種以聚氨酯泡沫顆粒(0.85 mm)為載體的柱形連續生物反應器,以固態發酵方式生產菌體并固定化鞣花單寧酶(30 ℃、18 h);向裝有生物催化劑的填充床反應器注入石榴皮鞣花單寧提取液(0.1%,w/v),在60 ℃的條件下,生物反應器可以保持60%的水解速率,連續進行10個連續循環生產。在水解的前70 min,鞣花酸產量為235.89 mg/g,鞣花酸產量高達175 mg/g。這是第一份使用自動固定化酶高產量連續生產鞣花酸的研究。
由于鞣花單寧聚合物的解聚對于鞣花酸的生產也很重要,可以通過減少鞣花單寧酸的大分子聚合物的位阻,使得水解酶可以容易地到達反應部位以催化鞣花單寧酸水解成游離鞣花酸單元。Huang[41]利用產單寧酶的A.oryzae和產纖維素酶的T.reesei共培養,使用橡椀提取物(含有62%鞣花單寧)為底物生產鞣花酸。生產過程中檢測到較高的鞣花單寧酶、纖維素酶和木聚糖酶含量,鞣花單寧酶、纖維素酶和木聚糖酶的活性與鞣花酸產量有很強的相關性。在最佳生產條件下(初始pH 4.5、鞣花單寧濃度4 g/L),發酵96 h后,鞣花酸的產率可達到24%[41]。
3.2.3液態發酵法制備鞣花酸目前,利用液態發酵制備鞣花酸的報道比較少。盡管在比較固態發酵和液態發酵的研究中顯示出固態發酵有較高鞣花酸轉化率,但是液態發酵條件更可控,因此也具有一定的應用潛力。Leonardo[50]發現,桔皮廢棄物中有28%為多酚類化合物、27%為鞣花單寧、25%為黃酮類化合物、20%為沒食子單寧,多酚類化合物主要為兒茶素、鞣花酸和橘皮素。通過使用中心實驗設計,煙曲霉A.fumigatus MUM1603在最優發酵條件下(溫度30℃、孢子接種量2×107個孢子/g、桔皮多酚6.2 g/L),鞣花酸的產量為18.68 mg/g。Huang[58]發現,以橡椀單寧為底物,利用曲霉SHL-6生產鞣花酸時,碳源和氮源是菌株降解鞣花單寧的重要參數,在5 g橡椀單寧、蔗糖為碳源、蛋白胨為氮源、28 ℃、初始pH在4.5~5、120 r/min發酵72 h的條件,鞣花酸的產率可以達到15%。Huang等 [37]以橡子果實提取物為底物,利用A.oryzae和Endomycopsis fibuligera共發酵產生鞣花酸,當這兩種菌株在30 ℃、pH 5.0和5.6 g/L的初始底物濃度下時,鞣花酸的最大產率可達到32%,鞣花酸的最大產量是1.84 g/L。在發酵過程中,兩種菌起到了不同的作用,A.oryzae因為有更高的鞣花單寧酶酶活、多酚氧化酶酶活和葡萄糖苷酶酶活,能產生更多的鞣花酸,而E.fibuligera則可以有效降解鞣花單寧。
3.2.4酶轉化制備鞣花酸酶轉化法主要是利用微生物生產單寧酶或者鞣花單寧酶將鞣花單寧水解生成鞣花酸。酶法轉化較發酵法而言,副產物相對較少,目標產物更易于提純。酶轉化將單寧酶的生產和鞣花單寧的轉化分為兩個步驟,使得轉化過程更可控。酶濃度、pH值和反應時間等因素對酶促反應影響較大。程艷[53]確定了以石榴皮為底物酶法生產鞣花酸的最佳條件:在50 mL含6.7%的單寧溶液中加入15 mL 65 U/mL酶液、pH 5.5、30 ℃反應48 h,鞣花酸得率約13%,純度約32%。Huang[36]選擇來自A.oryzae來源的鞣花單寧酰基水解酶,使用含60%鞣花單寧的橡子果實為底物,初始鞣花單寧濃度為5 g/L,鞣花單寧酰基水解酶活性30.8 IU/mL的條件下,轉化84 h時鞣花酸達到17.7%。也可以通過不同酶的組合,同時獲得植物組織中包括鞣花酸在內的其他產品。Madeira[52]通過纖維素酶、果膠酶和單寧酶同時獲得來自巴西柑橘殘留物的酚類,其中橙皮素、柚皮素和鞣花酸產量分別為120、80、11 250 mg/g。盡管酶解法和酸解法制備的鞣花酸粗品中的鞣花酸的含量基本相等,但是酸法生產鞣花酸經過純化后純度可以達到90%以上,而酶法純化后的純度只有60%[53]。
4鞣花酸的前景及展望
生物法生產鞣花酸面臨著成本較高的問題,因此有必要加強以下幾個基礎研究:(1)研究鞣花單寧的降解機制,特別是石榴皮鞣花單寧(安石榴苷)的降解機制,解析單寧酶和鞣花單寧酶在降解過程中的具體步驟,為提高鞣花單寧的降解效率奠定基礎;(2)進一步優化生物法制備鞣花酸的工藝,期望得到能大幅度提高鞣花酸產量的方法。
參考文獻
[1]I B,V B,S H,et al.Analytical methods for assay of ellagic acid and its solubility studies[J].Journal of Pharmaceutical and Biomedical Analysis,2006,40(1):206-210.
[2]Goriparti S,Harish MNK,Sampath S.Ellagic acid - a novel organic electrode material for high capacity lithium ion batteries[J].Chemical Communications,2013,49(65):7234-7236.
[3]Konczak I,Maillot F,Dalar A.Phytochemical divergence in 45 accessions of Terminalia ferdinandiana(Kakadu plum)[J].Food Chemistry,2014,151(5):248-256.
[4]Lu J,Yuan Q.A new method for ellagic acid production from pomegranate husk[J].Journal of Food Process Engineering,2008,31(4):443-454.
[5]黃文.橡椀單寧生物降解及其機理研究[D].成都:四川大學,2002.
[6]譚登航,王鵬嬌,張碩,等.刺梨不同藥用部位中鞣花酸的含量測定及其醇提物的體外抗氧化活性研究[J].中國藥房,2019,30(9):1236-1240.
[7]劉宇文.鞣花酸的生產制備工藝研究[D].北京:北京化工大學,2015.
[8]Saeed S,Aslam S,Mehmood T,et al.Production of gallic acid under solid-state fermentation by utilizing waste from food processing industries[J].Waste and Biomass Valorization,2021,12(1):155-163.
[9]Aguilar CN,Aguilera-Carbo A,Robledo A,et al. Production of antioxidant nutraceuticals by solid-state cultures of pomegranate(Punica granatum)peel and creosote bush(Larrea tridentata)leaves[J].Food Technology and Biotechnology,2008,46(2):218-222.
[10]Rajak RC,Singh A,Banerjee R.Biotransformation of hydrolysable tannin to ellagic acid by tannase from Aspergillus awamori[J].Biocatalysis and Biotransformation,2017,35(1):1-8.
[11]李素琴,袁其朋,徐健梅.鞣花酸的生理功能及工藝開發研究現狀[J].天然產物研究與開發,2001,52(5):71-74.
[12]Lei Z.Monomeric ellagitannins in oaks and sweetgum[D].Virginia Tech,2002.
[13]雷焱.五倍子單寧為原料制備鞣花酸及鞣花酸的純化[D].北京:北京化工大學,2007.
[14]Liu Z,Chen Z,Han F,et al.Microwave-assisted method for simultaneous hydrolysis and extraction in obtaining ellagic acid,gallic acid and essential oil from Eucalyptus globulus leaves using Brnsted acidic ionic liquid[HO3S(CH2)4 mim]HSO4 [J].Industrial Crops & Products,2016,81(1):152-161.
[15]崔珊珊,畢凱媛,吳杰,等.響應面法優化樹莓鞣花酸提取工藝及其體外抗氧化活性[J].食品工業科技,2019,40(1):149-155.
[16]劉麗娜.響應面法優化紅樹莓籽中鞣花酸的提取工藝[J].北方園藝,2020(2):107-112.
[17]郭葉瑩,吳小剛,陳品品,等.石榴皮鞣花酸的超聲波-微波協同堿水解提取工藝研究[J].浙江樹人大學學報(自然科學版),2019,19(1):38-42.
[18]王妙飛,程庚金生,張道英,等.水解法制取五倍子鞣花酸的研究[J].食品工業科技,2010,31(2):233-234.
[19]徐加喜,高迪,朱曉梅,等.高溫高壓條件制備石榴皮鞣花酸的試驗研究[J].食品工業科技,2017,38(17):174-177.
[20]鄧小莉,董翠月,吳羽晨,等.不同提取方法對石榴皮鞣花酸提取率的影響[J].云南農業大學學報(自然科學),2015,30(6):969-973.
[21]邸幼軍,賈光鋒.超聲強化提取石榴皮鞣花酸的工藝研究[J].現代生物醫學進展,2010,10(19):3703-3705.
[22]楊小玲,劉地發,劉偉,等.山香圓葉藥材中鞣花酸的提取分離與含量測定[J].中國實驗方劑學雜志,2014,20(10):54-57.
[23]柳靜.塔拉單寧及鞣花酸的制備工藝研究[D].北京:北京化工大學,2012.
[24]張亮亮,徐曼,汪詠梅,等.響應面優化化香樹果序中鞣花酸超聲波提取的研究[J].林產化學與工業,2011,31(2):19-24.
[25]黃娟.芡果實主要成分性質與應用[D].江蘇揚州:揚州大學,2014.
[26]An J-Y,Wang L-T,Lv M-J,et al.An efficiency strategy for extraction and recovery of ellagic acid from waste chestnut shell and its biological activity evaluation[J].Microchemical Journal,2021,160(4):105616.
[27]王佳寧,馬永強,王鑫,等.藍靛果鞣花酸超聲波輔助提取工藝的研究[J].農產品加工,2017(20):38-42.
[28]魏征,趙雅嬌,黃羽,等.響應面試驗優化超聲波輔助提取圓葉葡萄鞣花酸和總酚工藝[J].食品科學,2015,36(12):29-35.
[29]吳士龍,李敏,李小玢,等.響應曲面法優化樹莓葉中鞣花酸的提取工藝[J].中國新藥雜志,2014,23(6):692-697.
[30]劉艷,熊偉,田吉,等.可變波長同時測定瀘州龍眼沒食子酸和鞣花酸的含量[J].中國實驗方劑學雜志,2012,18(6):84-86.
[31]薛茗月,羅星曄,湛志華,等.甜茶根中鞣花酸的提取純化、表征及含量測定[J].林業科技,2011,36(4):25-28.
[32]劉玉革,劉勝輝,臧小平,等.高效液相色譜法測定番石榴葉提取物中的游離鞣花酸[J].食品科學,2011,32(8):252-254.
[33]王予祺,斯建勇,劉新民,等.蛇莓中鞣花酸和短葉蘇木酚羧酸的分離鑒定及含量測定[J].天然產物研究與開發,2008(4):667-671.
[34]Aguilera-Carbo A,Augur C,Prado-Barragan LA,et al.Microbial production of ellagic acid and biodegradation of ellagitannins[J].Applied Microbiology and Biotechnology,2008,78(2):189-199.
[35]Aguilera-Carbo A,Hernández JS,Augur C,et al.Ellagic acid production from biodegradation of creosote bush ellagitannins by aspergillus niger in solid state culture[J].Food and Bioprocess Technology,2009,2(2):208-212.
[36]Huang W,Niu H,Gong GH,et al.Individual and combined effects of physicochemical parameters on ellagitannin acyl hydrolase and ellagic acid production from ellagitannin by aspergillus oryzae[J].Bioprocess and Biosystems Engineering,2007,30(4):281-288.
[37]Wen H,Zhenshan L,Hai N,et al.Utilization of acorn fringe for ellagic acid production by aspergillus oryzae and Endomyces fibuliger[J].Bioresource Technology,2008,99(9):3552-3558.
[38]Armando R,Antonio A-C,Raúl R,et al.Ellagic acid production by aspergillus niger in solid state fermentation of pomegranate residues[J].Journal of Industrial Microbiology & Biotechnology,2008,35(6):507-513.
[39]Ascacio-Valdés JA,Buenrostro JJ,Cruz RDl,et al.Fungal biodegradation of pomegranate ellagitannins[J].Journal of Basic Microbiology,2014,54(1):28-34.
[40]Ascacio-Valdés JA,Aguilera-Carbó AF,Buenrostro JJ,et al.The complete biodegradation pathway of ellagitannins by aspergillus niger in solid-state fermentation[J].Journal of Basic Microbiology,2016,56(4):329-336.
[41]Wen H,Hai N,Zhenshan L,et al.Optimization of ellagic acid production from ellagitannins by co-culture and correlation between its yield and activities of relevant enzymes[J].Bioresource Technology,2008,99(4):769-775.
[42]郭麗,王鵬,張春華.食用菇發酵藍莓果渣代謝過程及抗氧化研究[J].食品工業,2016,37(10):75-79.
[43]Federica M,C F-GA,L C-GM,et al.Ellagic acid recovery by solid state fermentation of pomegranate wastes by aspergillus niger and saccharomyces cerevisiae:A comparison[J].Molecules(Basel,Switzerland),2019,24(20):1-11.
[44]Sepúlveda L,Wong-Paz JE,Buenrostro-Figueroa J,et al. Solid state fermentation of pomegranate husk:recovery of ellagic acid by SEC and identification of ellagitannins by HPLC/ESI/MS[J].Food Bioscience,2018,22(3):99-104.
[45]Sepúlveda L,Aguilera-Carbó A,Ascacio-Valdés JA,et al.Optimization of ellagic acid accumulation by aspergillus niger GH1 in solid state culture using pomegranate shell powder as a support[J].Process Biochemistry,2012,47(12):2199-2203.
[46]Robledo A,Aguilera-Carbo AF,Prado LA,et al.Kinetics of ellagic acid accumulation by solid-State fermentation[M].Theoretical Models and Experimental Approaches in Physical Chemistry,2018,35(7):268-278.
[47]Buenrostro-Figueroa J,Ascacio-Valdes A,Sepulveda L,et al.Ellagic acid production by solid-state fermentation influenced by the inert solid supports[J].Emirates Journal of Food and Agriculture,2018,30(9):750-757.
[48]Aguilar-Zárate P,Wong-Paz JE,Rodríguez-Duran LV,et al.On-line monitoring of aspergillus niger GH1 growth in a bioprocess for the production of ellagic acid and ellagitannase by solid-state fermentation[J].Bioresource Technology,2018,247(5):412-418.
[49]呂遠平,姚開,李慶.可降解橡碗單寧產鞣花酸的菌種篩選[J].食品與發酵工業,2003(2):38-41.
[50]Sepúlveda L,Laredo-Alcalá E,Buenrostro-Figueroa JJ,et al.Ellagic acid production using polyphenols from orange peel waste by submerged fermentation[J].Electronic Journal of Biotechnology,2020,43(12):1-7.
[51]孫雨晴.石榴皮多酚及其酶解產物的抗氧化活性和對氧化應激小鼠的保護作用研究[D].南京:南京農業大學,2016.
[52]Jr.JVM,Macedo GA.Simultaneous extraction and biotransformation process to obtain high bioactivity phenolic compounds from brazilian citrus residues[J].Biotechnology Progress,2015,31(5):1273-1279.
[53]程艷.石榴皮為原料酶法生產鞣花酸[D].北京:北京化工大學,2008.
[54]Aguilar CN,Augur C,Favela-Torres E,et al.Induction and repression patterns of fungal tannase in solid-state and submerged cultures[J].Process Biochemistry,2001,36(6):565-570.
[55]Paranthaman R,Kumaravel S,Singaravadivel K. Development of bioprocess technology for the production of bioactive compound,ellagic acid from tea waste[J].World Journal of Agricultural Sciences ,2009,5(3):2976-2984.
[56]Chávez-González ML,Guyot S,Rodríguez-Herrera R,et al.Exploring the degradation of gallotannins catalyzed by tannase produced by aspergillus niger gH1 for ellagic acid production in submerged and solid-state fermentation[J].Applied Biochemistry and Biotechnology,2018,185(2):476-483.
[57]Buenrostro-Figueroa J,Huerta-Ochoa S,Prado-Barragán A,et al.Continuous production of ellagic acid in a packed-bed reactor[J].Process Biochemistry,2014,49(10):1595-1600.
[58]Huang W,Ni J,Borthwick AGL.Biosynthesis of valonia tannin hydrolase and hydrolysis of valonia tannin to ellagic acid by Aspergillus SHL 6[J].Process Biochemistry,2004,40(3):1245-1249.
Research Progress on Preparation and Application of Ellagic Acid
QU Yan-jun1 ,WANG Wen-hui1 ,CAO Jia-nan1 ,WANG Yu-wen1 ,LIU Miao1,2 ,SHEN Cai-hong2,SONG Ping1
(1School of food and pharmaceutical engineering,Nanjing Normal University,Nanjing 211800,China;
2National Solid State brewing Engineering Technology Research Center,Luzhou 646000,China)
Abstract:ObjectiveTo review the structure and source of ellagic acid and ellagitannins and the research on the preparation of ellagic acid by extraction and biological methods, in order to provide reference for the application of ellagic acid in industrial production.MethodWe summarized research papers,reviews and books on preparation and application of ellagic acid.ResultThe advantages and disadvantages of solid fermentation, liquid fermentation and enzyme conversion methods for producing ellagic acid are different.ConclusionThe application prospect of ellagic acid is broad, and the production methods are diverse. The production of ellagic acid by biotechnology is a green and efficient production method.
Keywords:ellagic acid;ellagitannins;solid state fermentation;liquid fermentation;enzymatic conversion

