人參皂苷衍生化及生物活性研究進展
張浩然,葉安琪,張躍偉,成樂琴
吉林化工學院化學與制藥工程學院,吉林 吉林 132022
人參皂苷衍生化及生物活性研究進展
張浩然,葉安琪,張躍偉,成樂琴*
吉林化工學院化學與制藥工程學院,吉林 吉林 132022
人參皂苷是人參Panax ginseng的主要生物活性成分,特別是其降解產(chǎn)物次級稀有人參皂苷具有廣泛的抗癌、改善記憶、提高免疫力、神經(jīng)保護等作用,但由于水溶性低,生物利用度小,應用受到一定的限制。通過對人參皂苷分子的結(jié)構(gòu)進行修飾,可以有效提高人參皂苷的水溶性、靶向性,從而提高生物利用率,顯著提高人參皂苷的藥物活性和減少毒副作用。對人參皂苷結(jié)構(gòu)修飾策略及活性研究進行了綜述,為人參皂苷及其衍生物在食品、藥品等領(lǐng)域的深層次應用研究提供理論依據(jù)。
人參皂苷;次級人參皂苷;化學修飾;衍生化;生物活性
人參又稱亞洲人參或高麗參,是傘形目五加科人參屬植物人參Panax ginsengC. A. Mey的根,作為一種名貴中草藥在東亞國家有數(shù)千年使用歷史,被用作滋補藥品或用于抗炎[1]、護肝[2]、神經(jīng)保護[3]、美白[4]、抗腫瘤[5]等。人參皂苷是人參的重要活性成分,屬于三萜類糖苷化合物,可分為原人參二醇組皂苷(PPD型皂苷)、原人參三醇組皂苷(PPT型皂苷)和齊墩果烷型,文獻研究表明,已從人參根中分離出40多種人參皂苷[6]。
人參皂苷具有抗氧化、抗炎、血管舒張、抗過敏、抗糖尿病等多種治療作用[7]。一些人參皂苷通過減少DNA損傷、減少宿主對突變的易感性、增加免疫監(jiān)測和細胞凋亡等顯示其抗癌特性[8]。此外,人參皂苷還能有效改善傳統(tǒng)化療藥物的療效,防止對正常組織的損傷[9-10]。
人參皂苷水溶性較差[11]、血藥濃度低、口服吸收慢、生物利用度低[12],在一定程度上限制了人參皂苷的臨床應用。研究表明,通過對人參皂苷的分子結(jié)構(gòu)進行修飾,可以大幅度提高其水溶性[13]、穩(wěn)定性[14]、靶向性[15-16],從而有效提高其藥理活性[17]。近年來,對人參皂苷(特別是次級人參皂苷)的物理和化學修飾研究取得了一定進展,本文對人參皂苷的結(jié)構(gòu)修飾方法及其藥理活性進行綜述。
1 人參皂苷的酰基化修飾
人參皂苷藥動學研究表明,90%的口服人參皂苷經(jīng)過體內(nèi)腸道中結(jié)腸菌逐步裂解末端糖,得到20-O-β-D-吡喃葡萄糖基-達瑪-24-烯-3β,12β,20S-三醇(M1)、20-O-α-L-呋喃阿拉伯糖基-(1→6)-β-D-吡喃葡萄糖基達瑪-24-烯-3β,12β,20S-三醇(Mc)、20-O-β-D-吡喃葡萄糖基達瑪-24-烯-3β,6α,12β,20S-四醇(F1)、3-O-β-D-吡喃葡萄糖基-20-O-β-D-吡喃葡萄糖基達瑪-24-烯-3β,12β,20S-三醇(F2)、達瑪-24-烯-3β,12β,20S-三醇(PPD)、達瑪-24-烯-3β,6α,12β,20S-四醇(PPT)等稀有人參皂苷[18]。這些代謝產(chǎn)物經(jīng)消化道吸收,通過血液循環(huán)進入肝臟,進一步酯化為人參皂苷脂肪酸酯,可在體內(nèi)維持更長時間。現(xiàn)代藥理學研究表明,人參皂苷脂肪酸酯在體內(nèi)不良反應小、藥物活性高,可能是體內(nèi)真正的抗腫瘤活性物質(zhì),因此,脂肪酸酯化人參皂苷是一種極具潛力的候選藥物。
Wei等[19]將人參皂苷Rh2溶解在氯仿中,緩慢加入辛酰氯和三乙胺,室溫攪拌反應15 min合成了12,6′-二辛酰基人參皂苷Rh2即D-Rh2(2),見圖1。體外人肝細胞QSG7701細胞MTT實驗表明,D-Rh2對人肝細胞的細胞毒性作用明顯低于人參皂苷Rh2;而對H22肝癌小鼠的體內(nèi)抗腫瘤實驗表明,D-Rh2的抗腫瘤活性與人參皂苷Rh2相當。與人參皂苷Rh2相比,D-Rh2在體外能顯著降低對人肝細胞株QSG-7701的毒性,但不減弱體內(nèi)抗腫瘤活性。D-Rh2對胸腺指數(shù)的增強作用表明,D-Rh2可能通過刺激淋巴細胞對腫瘤細胞產(chǎn)生細胞毒性作用而間接影響腫瘤的生長。
很多抗癌藥物(如第3代鉑類藥物奧沙利鉑)對癌細胞有很好的殺傷作用,但同時殺傷正常細胞,產(chǎn)生神經(jīng)毒性、血液和胃腸道毒性、惡心和嘔吐等不良反應[20]。人參皂苷Rh2經(jīng)過羥基選擇性酯化,在不降低抗癌活性條件下,可以顯著降低QSG-7701細胞的毒性,減少對正常細胞的損傷,說明酯化可能是減少藥物不良反應的一種良好的方法。
Zhang等[21]以人參二醇為原料,選擇乙酸酐、棕櫚酰氯和硬脂酰氯為主要試劑,合成了3種脂肪酸酯衍生物3β-乙酰氧基人參二醇(4)、3β-棕櫚酸乙酰氧基人參二醇(5)和3β-硬脂酸乙酰氧基人參二醇(6)(圖2)。
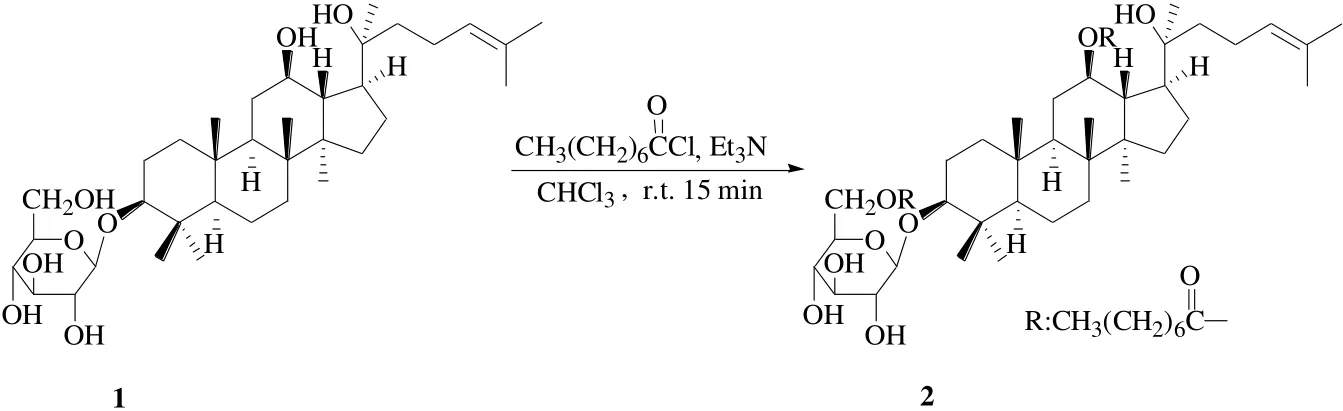
圖1 人參皂苷Rh2的12,6′-二辛酰基脂肪酸酯衍生化Fig. 1 Derivatization of ginsenoside Rh2 with 12,6′-dioctanoyl fatty acid ester
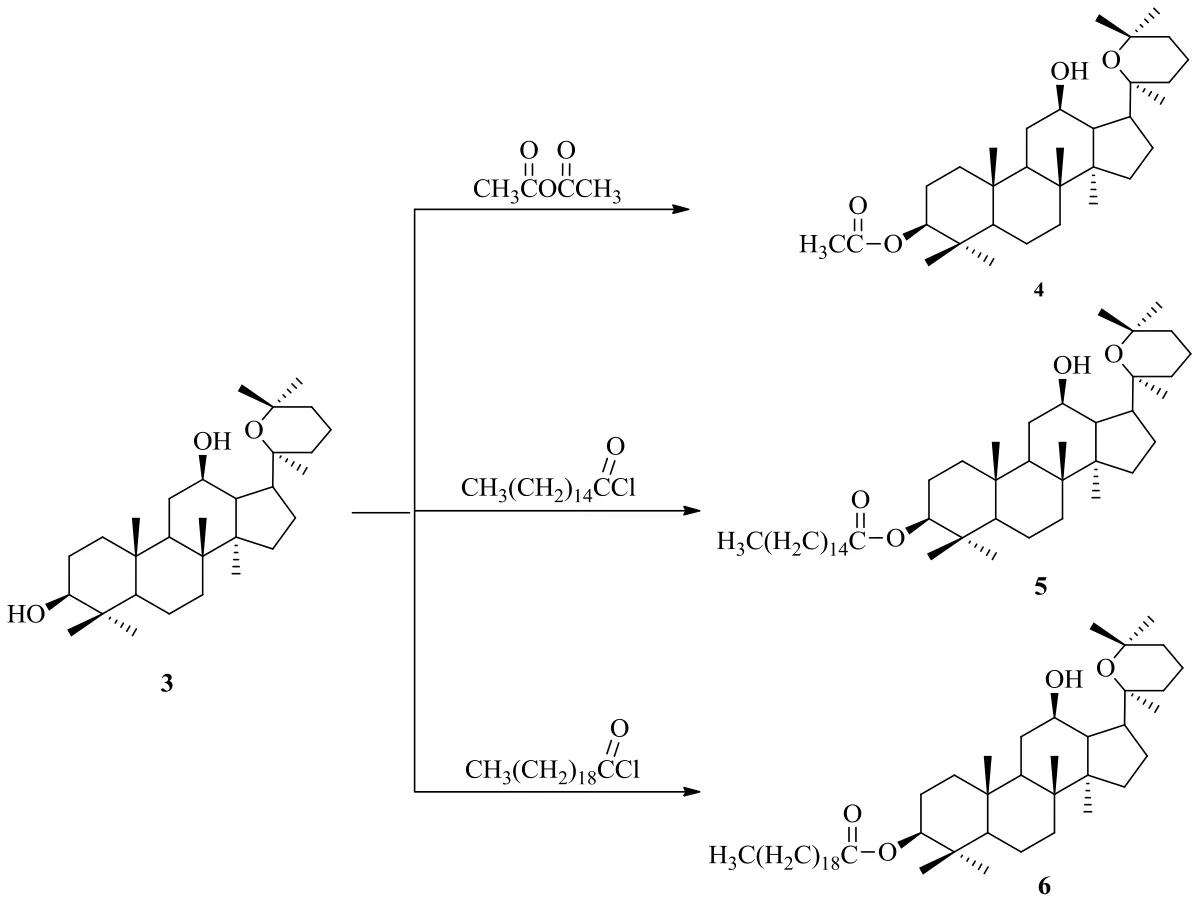
圖2 人參二醇的脂肪酸酯衍生化Fig. 2 Derivatization of ginsengdiol with fatty acid ester
Zhang課題組[21]以5-氟尿嘧啶(5-FU)為陽性對照,用Vero細胞系檢測了人參二醇脂肪酸酯的抗腫瘤增殖活性。MTT法檢測結(jié)果顯示,人參二醇的衍生物4具有較強的抗腫瘤作用,效果高于陽性對照5-FU,而化合物5和6的抑瘤作用均低于陽性對照組。這說明脂肪酸酯中脂肪鏈的長短對抗腫瘤效果影響顯著,脂肪鏈短,抗腫瘤效果好,脂肪鏈長,抗腫瘤效果下降。
乙酰水楊酸是世界上最常用的藥物之一。近年來有研究表明,乙酰水楊酸以及水楊酸均具有抗腫瘤活性[22-23]。Xu等[24]為提高人參皂苷和乙酰水楊酸的抗腫瘤活性,以三七皂苷的酸水解產(chǎn)物為原料,用水楊酸合成了人參皂苷水楊酸衍生物,在此基礎(chǔ)上,進一步與乙酸酐進行反應合成了人參皂苷乙酰水楊酸衍生物(圖3)。
對三七皂苷酸水解產(chǎn)物的水楊酸衍生化及乙酰水楊酸衍生化產(chǎn)物的細胞毒性測試以及衍生物對人類結(jié)腸癌HT-29細胞、胃癌bgc-823細胞、宮頸癌HeLa細胞、人類乳腺癌MCF-7細胞、人類肺癌A549細胞和2個普通癌癥細胞系的抗癌活性評價結(jié)果表明,所有化合物均顯示低毒性或無毒性(IC50>100μmol/L),進一步說明羥基的酯化是減少藥物不良反應的良好途徑。另外,人參皂苷乙酰水楊酸衍生物的抗癌活性明顯強于人參皂苷水楊酸衍生物,其中,當化合物3中R2為X2,R3為H時對MCF-7細胞的抑制活性最強,IC50=(2.56±0.09)μmol/L,同樣說明了乙酰化可以有效提高藥物抗腫瘤活性。
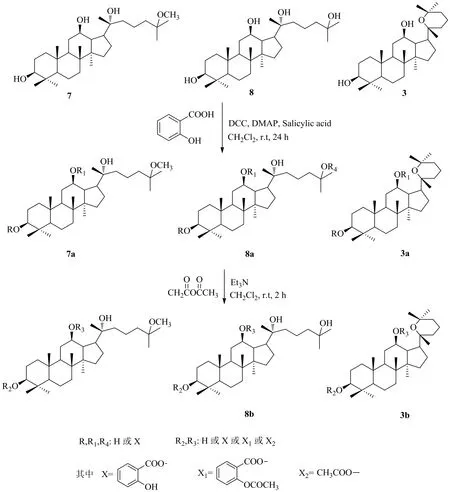
圖3 三七皂苷酸水解產(chǎn)物的水楊酸衍生化及乙酰水楊酸衍生化Fig. 3 Derivatization of the product of notoginsenoside by acid hydrolysis with salicylic acid and acetylsalicylic acid
人參皂苷的酰基化研究表明,羥基經(jīng)酰基化可以顯著降低毒性,而且對不同酰基化產(chǎn)物的抗癌活性研究表明,人參皂苷乙酰化衍生物以及人參皂苷乙酰水楊酸衍生物的抗癌活性明顯比其他酰基化產(chǎn)品好,而酰基的碳鏈增大時,抗癌活性明顯降低。
2 人參皂苷的硫酸化修飾
人參皂苷Rh2是一種原人參二醇型甾體皂苷,C-3位連有1個吡喃型葡萄糖,C-12和C-20位連有與仲碳和叔碳相連的羥基。Fu等[25]采用常見的氯磺酸-吡啶法對20(S)-人參皂苷Rh2的吡喃型葡萄糖的6位羥基和C-12位羥基進行了選擇性硫酸化反應,再通過堿中和得到了2種新型硫酸化衍生1a和1b(圖4)。1a和1b對LPS誘導小鼠RAW264.7巨噬細胞的抗炎作用結(jié)果顯示,經(jīng)過硫酸化處理后的1a和1b水溶性大幅度增強,而且以劑量相關(guān)方式顯著抑制炎癥細胞因子和介質(zhì),上調(diào)抗炎細胞因子,顯示出比人參皂苷Rh2更強的抗炎作用。
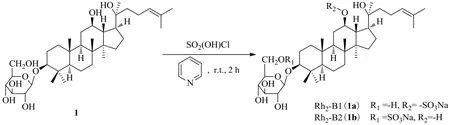
圖4 20(S)-人參皂苷Rh2的硫酸化Fig. 4 Sulfation of 20(S)-ginsenoside Rh2
人參皂苷的硫酸化研究表明,將人參皂苷轉(zhuǎn)變成硫酸氫酯,再將其轉(zhuǎn)變成鹽是提高其水溶性的良好的方法,水溶性的提高不僅提高了生物利用度,而且還增強了人參皂苷的抗炎活性。
隨著新世紀各大高校校區(qū)建設(shè)熱潮的掀起,國內(nèi)各高校普遍具備校區(qū)集中、設(shè)備先進、場所多樣、服務功能齊全的方形活動教室、圓形討論室、生活中心、體育館、多功能廳等,在這些便利條件的助推下,提高了學生之間的交往主動意愿,為實施朋輩導師制計劃提供了充分的硬件保障。
3 人參皂苷的PEG修飾
人參皂苷通常在胃腸道內(nèi)被水解酶降解[26-27]后吸收,因此其本身的口服生物利用率較低。隨著對人參皂苷藥動學的深入研究,人參皂苷的靶向給藥制劑成為了研究熱點。聚乙二醇(polyethylene glycol,PEG)是一種水溶性、非離子型、無毒的高分子材料,廣泛應用于高分子藥物的載體領(lǐng)域[28]。通過PEG對藥物進行表面改性,可以提高藥物的水溶性,保護藥物不被蛋白水解,延長藥物在血液中的循環(huán)時間,降低藥物的毒性[29],同時PEG改性藥物因存在酸敏感基團酯基,在腫瘤組織(通常顯示弱pH環(huán)境)中可以發(fā)生酯降解釋放出藥物,從而提高藥物的靶向性[30]。
Mathiyalagan等[31]為了提高CK(9)的溶解度,通過酯鍵在人參皂苷表面進行了PEG修飾(圖5)。采用MTT法分析,用HT-29細胞檢查了PEG-CK(10)和PEG的體外細胞毒性,發(fā)現(xiàn)與游離CK相比PEG-CK毒性較低,表明了親水性聚合物的生物相容性。在弱酸性條件下(病理生理條件pH 5.0~6.5),PEG-CK偶聯(lián)物釋放CK的量大于正常條件(生理條件pH 7.4),這種非常高的藥物溶解度、pH選擇性、以及PEG-CK偶聯(lián)物在病理生理位點的增強積累,可能會提高藥物的整體療效。
劉梅等[32]首先用PEG2000與丁二酸酐在吡啶存在下70 ℃反應24 h合成了單甲氧基聚乙二醇2000-琥珀酸單酯(mPEG2000-A),再利用人參皂苷Rg1(11)糖苷鍵上的羥基與單酯的酯交換反應合成了PEG-Rg1(圖6)。通過人參皂苷Rg1和PEG-Rg1(12)在大鼠離體胃中的穩(wěn)定性實驗,發(fā)現(xiàn)人參皂苷Rg1經(jīng)過PEG修飾后可以改善游離狀態(tài)時在胃中容易分解的問題,穩(wěn)定性大幅度提高。
與此同時,劉梅等[33]隨機取2組SD小鼠,分別尾靜脈注射人參皂苷Rg1和PEG-Rg1。通過2組小鼠在不同時間點各臟器及血漿中的藥物分布,計算人參皂苷Rg1和PEG-Rg1的靶向系數(shù)。結(jié)果表明,PEG-Rg1對腎、肝、肺、心、脾、肝都有靶向選擇性,肝、腎、肺組織的靶向系數(shù)分別為9.21、26.31、3.31,而未修飾人參皂苷Rg1只有肝的靶向系數(shù)大于1。由此可見,PEG-Rg1對各臟器的靶向選擇性明顯加強,其中腎組織的靶向選擇性最高。
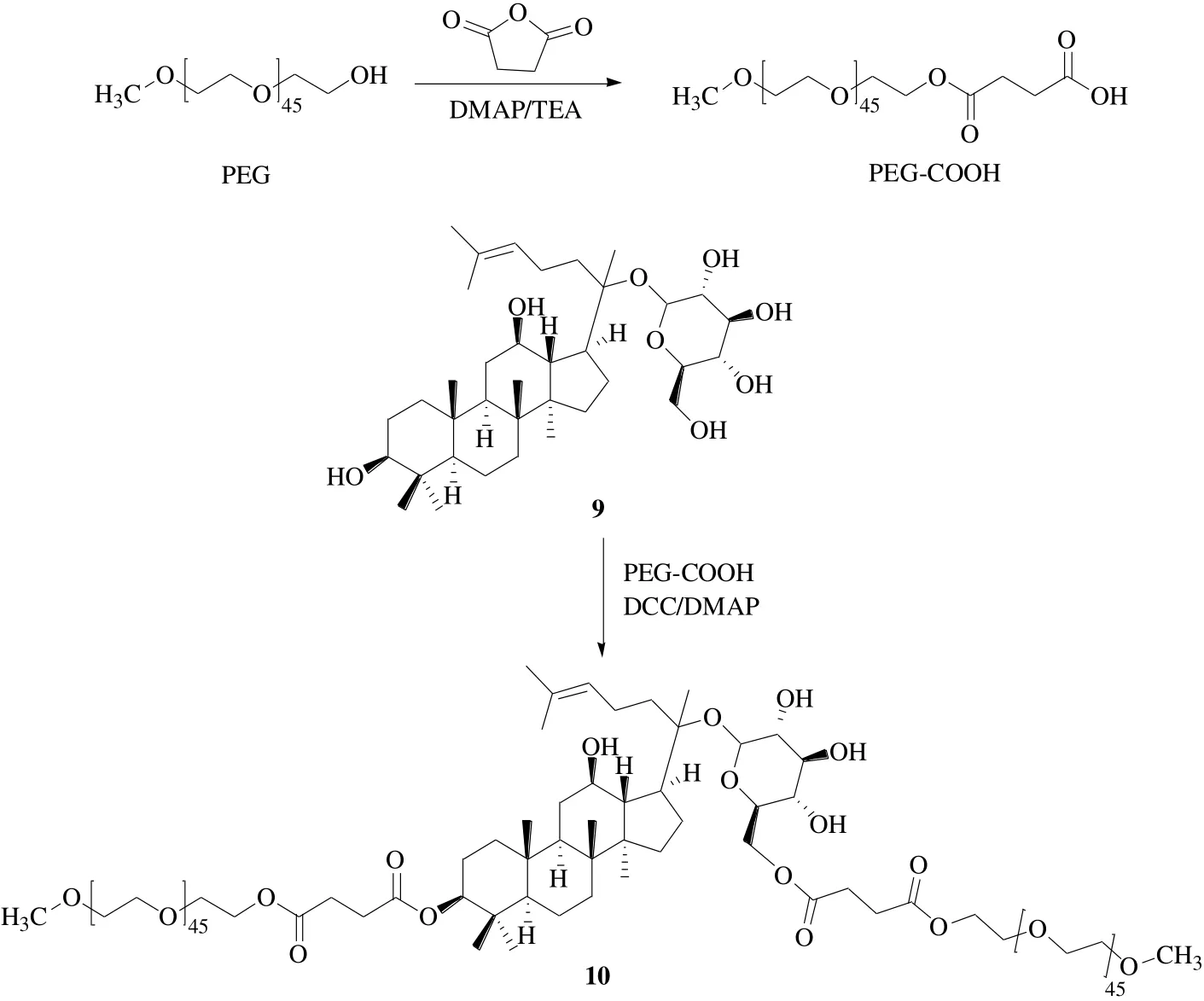
圖5 人參皂苷CK的PEG衍生化Fig. 5 Derivatization of ginsenoside CK with PEG
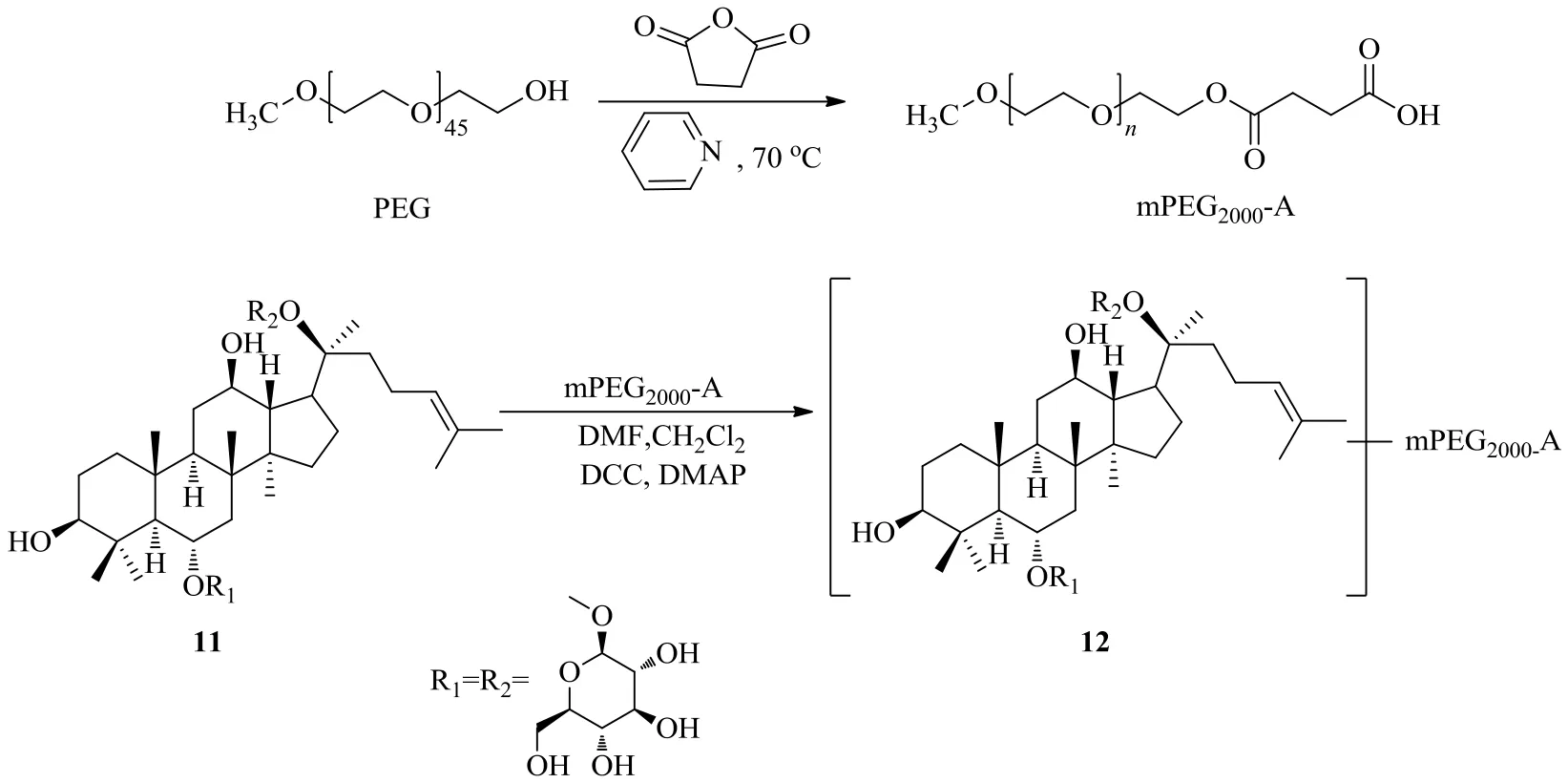
圖6 人參皂苷Rg1的PEG衍生化Fig. 6 Derivatization of ginsenoside Rg1 with PEG
趙海軍等[34]以對硝基苯氧酰化PEG為框架,利用硝基苯氧基易于離去的特性,在無水條件下將抗腫瘤特效藥依托泊苷(vp16)結(jié)構(gòu)中的酚羥基、人參皂苷Rh2(G-Rh2)糖結(jié)構(gòu)片段上的6-OH以及PEG鏈兩端的羥基共價連接,形成如圖7所示的“疏水-親水-疏水”的兩親性共聚物G-Rh2-PEG-vp16(13)。實驗結(jié)果發(fā)現(xiàn),化合物13體內(nèi)外穩(wěn)定性較好,且在pH 6.5的腫瘤組織環(huán)境下仍能釋放足量的藥物。化合物13共聚物采用中西藥物結(jié)合,能夠達到協(xié)同抗腫瘤的作用,是一種很有前景的新型抗腫瘤藥物。
PEG結(jié)構(gòu)中有重復的-OCH2CH2-結(jié)構(gòu)單元,據(jù)報道[35],在-OCH2CH2-結(jié)構(gòu)單元中的氧原子通過吸電子誘導效應使其周圍具有較高的電子云密度,從而加強與水分子的氫鍵能力,提高水溶性。人參皂苷通過酯基連接PEG,借助PEG的強親水性可有效提高水中溶解度和生物利用度,同時人參皂苷經(jīng)PEG修飾后毒性減弱,穩(wěn)定性增大,靶向性提高,特別是在腫瘤組織適宜存在的微酸性環(huán)境中容易分解釋放藥物,是癌癥靶向治療的良好途徑。
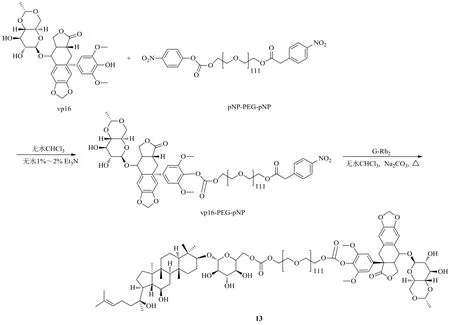
圖7 人參皂苷Rh2的G-Rh2-PEG-vp16衍生化Fig. 7 Derivatization of ginsenoside Rh2 with G-Rh2-PEG-vp16
4 人參皂苷的氨基酸化修飾
氨基酸是指分子中同時擁有氨基和羧基官能團的化合物,氨基酸的羧基可與人參皂苷中的羥基以酯基形式結(jié)合。劉繼華[36]以人參皂苷Rg3、人參皂苷Rh2、原人參二醇為原料,分別與叔丁氧羰基(Boc)或乙酰基保護的多種氨基酸進行反應,首次合成了原人參二醇型皂苷的氨基酸衍生物(圖8)。研究表明,氨基酸分子的結(jié)構(gòu)越大,與皂苷反應越困難;氨基酸化可以發(fā)生在1個羥基上生成單酯,也可以同時發(fā)生在多個羥基上生成多酯;與乙酰基保護相比,Boc保護的氨基酸反應后的產(chǎn)物相對少,后期分離純化更簡單。另外發(fā)現(xiàn),氨基酸更容易與葡萄糖側(cè)鏈的羥基發(fā)生反應,而且最容易發(fā)生反應的部位是Glc-6′位羥基。對氨基酸衍生物油水分配系數(shù)的測定表明,人參皂苷經(jīng)氨基酸衍生化后水溶性明顯提高,且蛋白結(jié)合率測定表明,衍生物抗癌活性作用可能提高。
25-OH-PPD是從人參果實中分離得到的一種有前途的抗腫瘤天然化合物。在研究中發(fā)現(xiàn)25-OH-PPD在體內(nèi)可以抑制胃癌細胞生長,引起細胞周期阻滯,誘導癌細胞凋亡,但沒有明顯的宿主毒性,因此25-OH-PPD有望成為治療癌癥的理想藥物[38]。為提高25-OH-PPD的抗腫瘤活性,Wang等[37]在25-OH-PPD的C-3和C-12處引入了可增加極性的氨基和可增加親脂性的受Boc保護的氨基(圖9),并研究了對MCF-7細胞、A549細胞和3種人類結(jié)直腸癌細胞增殖的抑制作用。在合成的20種25-OH-PPD的氨基酸化衍生物中,去保護氨基酸衍生物表現(xiàn)出更高的對癌細胞的毒性活性,此外衍生化所使用氨基酸側(cè)鏈的類型及其生物活性之間顯示出很強的相關(guān)性。
5 人參皂苷的氧化修飾
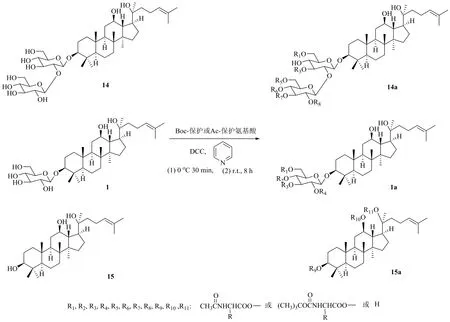
圖8 20S-Rg3、20S-Rh2、20S-PPD的氨基酸衍生化Fig. 8 Derivatization of 20S-Rg3, 20S-Rh2, 20S-PPD with amino acid
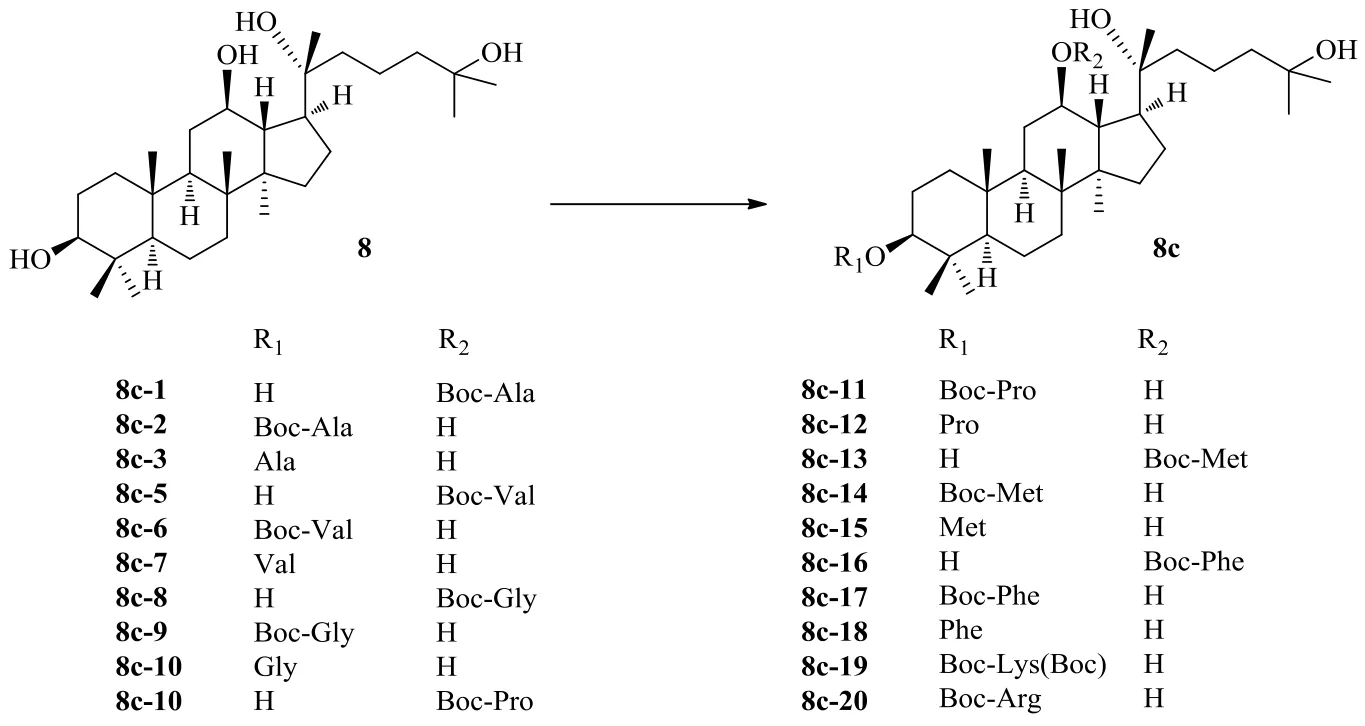
圖9 25-OH-PPD的氨基酸衍生化Fig. 9 Derivatization of 25-OH-PPD with amino acid
圖10 20(S)-Rg3、20(S)-Rh2、20(S)-PPD的過氧酸氧化Fig. 10 Peroxyacid oxidation of 20(S)-Rg3, 20(S)-Rh2, 20(S)-PPD
人參皂苷不僅可以在支鏈發(fā)生氧化,在環(huán)上也可以發(fā)生氧化。有報道顯示,PD環(huán)上的氧化產(chǎn)物和A環(huán)的開環(huán)產(chǎn)物對人類免疫缺陷病毒HIV和丙型肝炎病毒HCV蛋白酶有抑制作用[38]。受此啟發(fā),Zhang等[39]對PD進行了一系列有益的氧化合成反應(圖11),以提高其抗腫瘤活性,并采用MTT法檢測人參皂苷氧化產(chǎn)物對A549細胞、MCF-7細胞、人腦膠質(zhì)瘤U87細胞、HeLa細胞、人卵巢癌8901細胞和正常人卵巢細胞株IOSE144的增殖抑制作用。對U87細胞的細胞毒性篩選結(jié)果表明,化合物1a、3和3d比陽性對照有更強的細胞毒性作用,其中化合物3的IC50值為(19.51±1.00)μmol/L,顯示較強的抗腫瘤細胞增殖活性。對MCF-7細胞株的研究結(jié)果顯示,1a和2的IC50值為17.73~23.58 μmol/L,其抗腫瘤活性優(yōu)于IC50值為(29.4±0.7)μmol/L的5-氟尿嘧啶和IC50值為(52.62±2.39)μmol/L母體化合物PD。此外,3b對HeLa細胞的IC50值為11.65~19.60 μmol/L,表現(xiàn)出較好的抗增殖活性。
PD及其衍生化產(chǎn)品經(jīng)PCC、O2、H2O2進行3個不同階段氧化得到的產(chǎn)物的抗癌活性研究對比可知,第2階段用O2氧化得到的產(chǎn)品24、27和30的抗癌活性分別比與之對應的第3階段PCC氧化產(chǎn)物26和29以及第3階段H2O2氧化產(chǎn)物25、28和31更高,說明A環(huán)的3-位羰基的α-位引入烯醇結(jié)構(gòu)的活性優(yōu)于其他氧化產(chǎn)物。
6 人參皂苷的氮雜化修飾
在天然產(chǎn)物中,主要分布于海蠕蟲體內(nèi)的氮雜環(huán)化合物具有明顯的細胞毒性[40]。在齊墩果酸的結(jié)構(gòu)修飾過程中,嘧啶類化合物對乳腺癌細胞具有普遍的抑制活性,其活性優(yōu)于陽性藥物依托泊苷[41]。
Zhang等[39]設(shè)計合成了環(huán)A稠合氮雜環(huán)衍生物,并對其抗腫瘤活性進行了評價。首先用氯鉻酸吡啶(PCC)氧化PD,再用鄰苯二胺、乙二胺、硫、嗎啉、鹽酸聯(lián)氨等試劑進行反應得到氮雜環(huán)衍生物(圖12、13)。在所合成的人參二醇氮雜環(huán)衍生物中,20(R)-20,25-環(huán)氧-[5,4-b]-吡唑-12β-達瑪烷(41)與陽性對照5-Fu和母體化合物PD相比,顯示出優(yōu)越的抗腫瘤活性及抗增殖活性,而且活性明顯高于其他衍生物。根據(jù)SAR分析,對于A549細胞和8901細胞而言,20(R)-[2,3-b]-吡嗪-達瑪烷-12β,20,25-三醇(44)具有良好的抗癌細胞增殖活性,是陽性對照5-Fu的2.6倍。另外,細胞毒性研究結(jié)果表明,所有衍生物對正常細胞表現(xiàn)出較低的細胞毒活性。
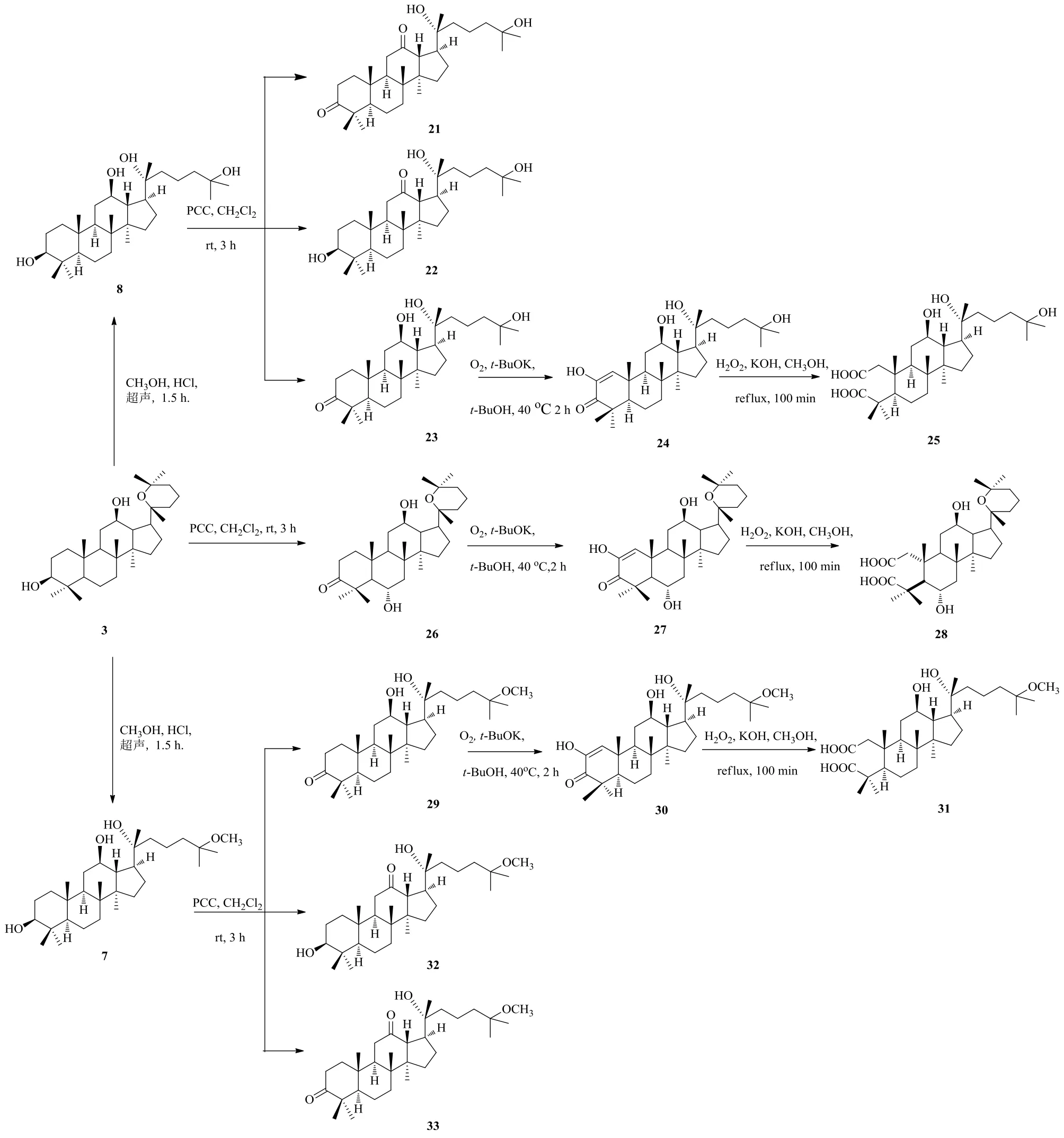
圖11 人參二醇的氧化路線圖Fig. 11 Oxidation route map of ginsengdiol
在所合成的化合物中,吡唑啉化合物41的活性比其他衍生物高得多,推測這與其特殊的A環(huán)稠合吡唑啉結(jié)構(gòu)有關(guān);C-17連有鏈狀結(jié)構(gòu)片段的吡嗪化合物44比C-17連有環(huán)狀結(jié)構(gòu)片段的吡嗪化合物21d具有更出色的抗癌增殖活性;化合物44與43相比,除了HeLa細胞以外,對其它癌細胞的抗癌效果顯著提高,這可能是由于其C-12位所連基團是羥基而非羰基有關(guān)[39]。
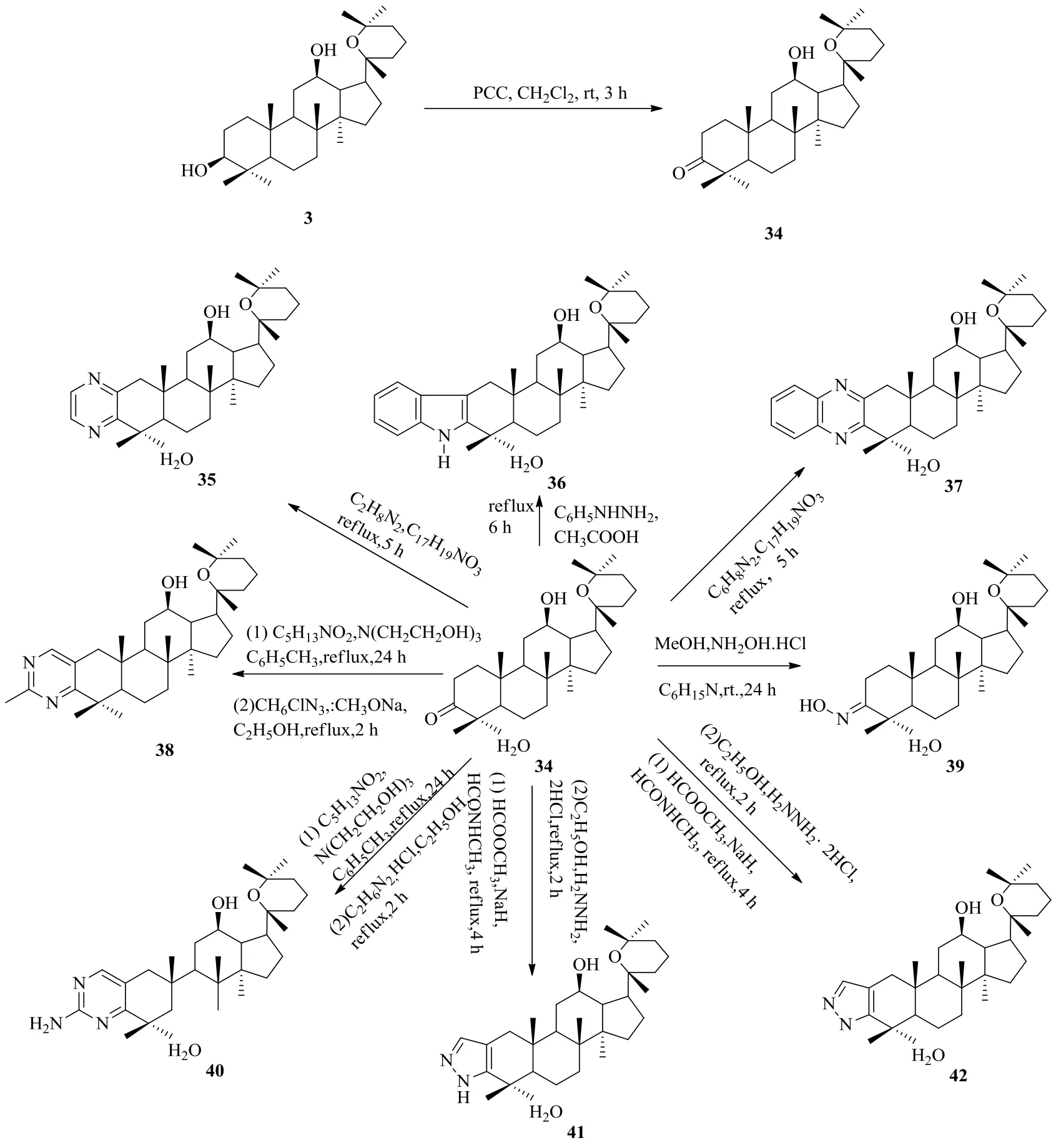
圖12 人參二醇氮雜環(huán)衍生化路線1Fig. 12 Route 1: Derivatization of ginsengdiol saponins via nitrogen heterocycle
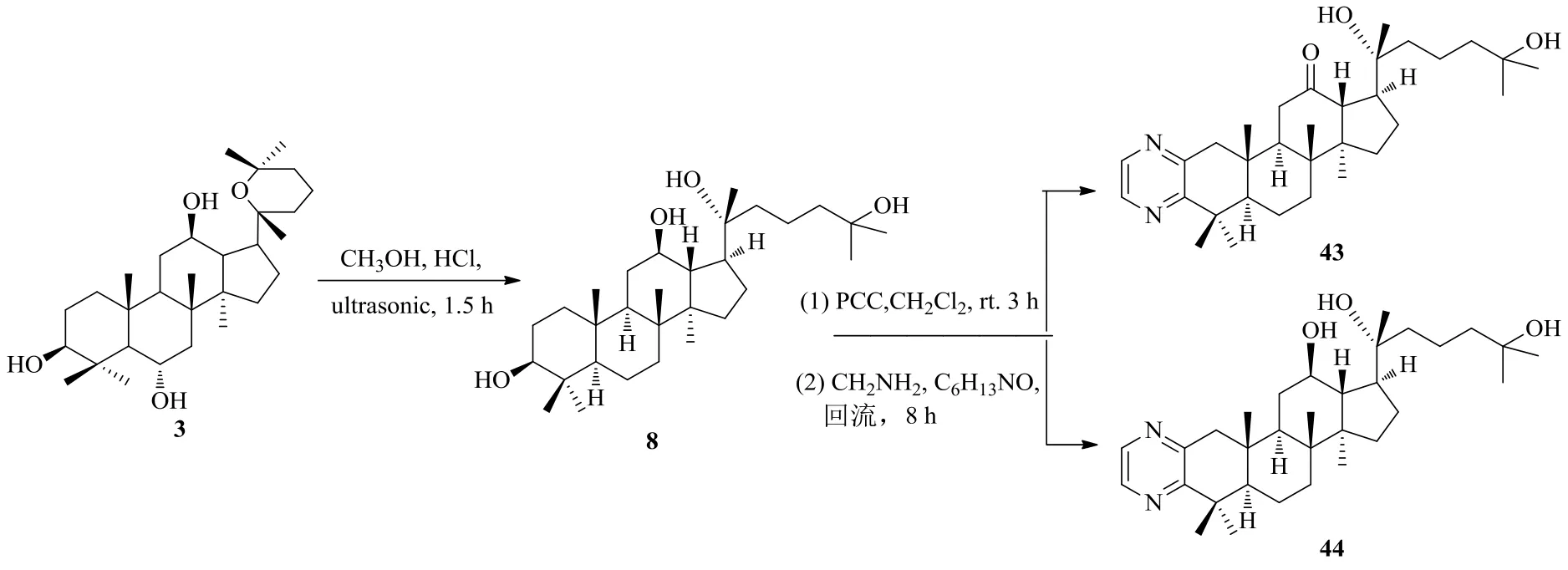
圖13 人參二醇氮雜環(huán)衍生化路線2Fig. 13 Route 2: Derivatization of ginsengdiol saponins via nitrogen heterocycle
咪唑具有2個sp2雜化氮原子的五元芳雜環(huán)化合物,具有獨特的藥理活性,如抗驚厥、抗菌、抗癌、抗炎、抗腫瘤、抗病毒、抗?jié)儭㈡?zhèn)痛等藥理活性。將咪唑基團引入藥物中,還會引發(fā)一些特殊的生物活性[42]。因此備受研究者關(guān)注。
甾體咪唑類化合物具有很高的醫(yī)用價值。張嚴磊[43]將具有達瑪烷甾體結(jié)構(gòu)的人參二醇、人參三醇與咪唑基團連接,設(shè)計了系列甾體咪唑衍生物。人參二醇未能合成咪唑衍生物,但人參三醇成功合成多個人參三醇氧化產(chǎn)物的咪唑衍生物及人參三醇氧化產(chǎn)物的咪唑鹽衍生物(圖14)。
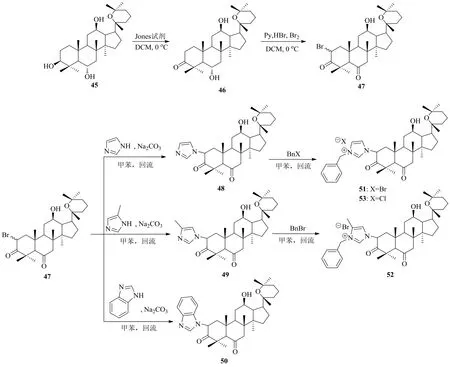
圖14 人參三醇酮的咪唑及取代咪唑衍生化Fig. 14 Derivatization of ginsengtriolone via imidazole and substituted imidazole
張嚴磊[43]首先用瓊斯試劑將人參三醇(45)的C-2位和C-6位的羥基氧化生成人參三醇酮(化合物46),再用溴代試劑對化合物46的C-2位進行溴代得化合物47,在甲苯中與咪唑及咪唑衍生物加熱回流,分別得到人參三醇-2-溴-3,6-二酮與咪唑、甲基咪唑和苯并咪唑的反應產(chǎn)物48、49和50。最后將生成的化合物48與鹵化芐反應合成了人參三醇酮溴代物咪唑鹽51和52;化合物24與氯化芐生成人參三醇酮氯代物咪唑鹽31。對HL60人急性髓系白血病細胞的抗癌活性研究表明,化合物48、51、52顯示較好的抗癌活性,其中化合物51的活性最強,其效果好于順鉑。
7 其他
人參皂苷的修飾方法還有烷基化、氚化還原等方法。例如姜竹韻[44]分別采用Purdie法、Haworth法、Hakomori法和Cicanu法對人參皂苷Rg2分子中的C-12位羥基進行了甲基化結(jié)構(gòu)修飾研究,以改變?nèi)藚⒃碥誖g2的極性,改善其功能。而吳久偉等[45]將原人參二醇溶解在氯仿中,用重鉻酸鉀氧化得到原人參二醇氧化物,再利用新制的硼氚化鈉對原人參二醇進行氚化還原,得到 [3,12-3H] 原人參二醇。所得還原產(chǎn)物經(jīng)過分析發(fā)現(xiàn),其各項指標均能滿足藥學和醫(yī)學相關(guān)研究要求,有助于提高人參皂苷在癌癥治療和診斷上的應用。
8 結(jié)語與展望
人參皂苷是人參的主要生物活性成分,特別是通過人參皂苷的降解得到的次級稀有人參皂苷顯示良好的抗癌[46-47]、改善記憶[48]、神經(jīng)保護[48]等藥理作用,受到廣泛關(guān)注。同時,因次級稀有人參皂苷水溶性低、生物利用度小的問題,應用受到一定限制,因此化學方法修飾人參皂苷逐漸成為國內(nèi)外研究的熱點。
通過人參皂苷的酰基化法、硫酸化法、PEG修飾法、氨基酸法、氧化法、氮雜化法、烷基化法、氚化還原法等對人參皂苷進行結(jié)構(gòu)修飾,可以有效提高人參皂苷的水溶性、穩(wěn)定性、靶向性、從而提高生物利用率,顯著提高人參皂苷的藥物活性。
人參皂苷的結(jié)構(gòu)修飾中,酰基化法、硫酸化法、PEG修飾法、氨基酸法均是通過人參皂苷中特定羥基與衍生化試劑通過酯化和酯交換反應引入酯基從而改變其物理和生物活性,不同的衍生化試劑根據(jù)其結(jié)構(gòu)的不同有不同的改性效果。人參皂苷通過酰基化法、硫酸化法、PEG修飾法、氨基酸法引入酯基,可以有效降低人參皂苷對正常細胞的毒副作用,提高抗癌、抗炎等藥物活性;酰基化衍生物中,短脂肪鏈酰基(如乙酰基)或乙酰水楊酰基的引入可以有效提高人參皂苷的抗癌活性,長脂肪鏈酰基的引入降低抗癌活性;人參皂苷通過PEG修飾、硫酸化和氨基酸修飾均能顯著提高人參皂苷水溶性和生物利用度,其中,PEG法還可以使人參皂苷穩(wěn)定性增大、在癌細胞適宜生存的微酸環(huán)境中可以有效釋放藥物,從而提高藥物的靶向性,是人參皂苷對癌細胞靶向治療的一種可行方法。
人參皂苷的氮雜化產(chǎn)品毒性較小,對人參皂苷的氮雜化研究表明,不同雜環(huán)結(jié)構(gòu)的引入可以影響人參皂苷抗癌活性的高低,即有些雜環(huán)的引入使抗癌活性顯著提高,有些雜環(huán)反而降低抗癌活性。另外,雜環(huán)的影響也與人參皂苷本身結(jié)構(gòu)有密切關(guān)系,說明人參皂苷的抗癌活性并不是分子結(jié)構(gòu)中單一結(jié)構(gòu)片段起作用,而是多官能團的共同協(xié)同作用。
綜上所述,良好的水溶性及靶向性可以提高藥效,改善藥物在人體內(nèi)的藥代動力學特性。人參皂苷的理化性質(zhì)與其羥基數(shù)量、母核結(jié)構(gòu)、所連基團大小和數(shù)量及連接位置等因素有關(guān)。使用化學方法對人參皂苷分子的結(jié)構(gòu)進行修飾,為提高人參皂苷生物利用率提供了重要方向。隨著近年來藥物領(lǐng)域的迅速發(fā)展,新的技術(shù)、新的方法層出不窮,人參皂苷的修飾技術(shù)也將不斷創(chuàng)新,更多的人參皂苷衍生化產(chǎn)品有望應用于臨床。
利益沖突 所有作者均聲明不存在利益沖突
[1] Kim J H, Yi Y S, Kim M Y,et al. Role of ginsenosides,the main active components ofPanax ginseng, in inflammatory responses and diseases [J].J Ginseng Res,2017, 41(4): 435-443.
[2] Gao Y, Chu S F, Zhang Z,et al. Hepataprotective effects of ginsenoside Rg1-A review [J].J Ethnopharmacol,2017, 206: 178-183.
[3] Shao J J, Zheng X Y, Qu L L,et al. Ginsenoside Rg5/Rk1ameliorated sleep via regulating the GABAergic/serotoninergic signaling pathway in a rodent model [J].Food Funct, 2020, 11(2): 1245-1257.
[4] Jin Y, Kim J H, Hong H D,et al. Ginsenosides Rg5and Rk1, the skin-whitening agents in black ginseng [J].J Funct Foods, 2018, 45: 67-74.
[5] Liang L D, He T, Du T W,et al. Ginsenoside?Rg5induces apoptosis and DNA damage in human cervical cancer cells [J].Mol Med Rep, 2015, 11(2): 940-946.
[6] Tam D N H, Truong D H, Nguyen T T H,et al.Ginsenoside Rh1: A systematic review of its pharmacological properties [J].Planta Med, 2018, 84(3):139-152.
[7] Kim J H. Pharmacological and medical applications ofPanax ginsengand ginsenosides: A review for use in cardiovascular diseases [J].J Ginseng Res, 2018, 42(3):264-269.
[8] Xie J T, Wang C Z, Wang A B,et al. Antihyperglycemic effects of total ginsenosides from leaves and stem ofPanax ginseng[J].Acta Pharmacol Sin, 2005, 26(9):1104-1110.
[9] Wang X D, Su G Y, Zhao C,et al. Anticancer activity and potential mechanisms of 1C, a ginseng saponin derivative, on prostate cancer cells [J].J Ginseng Res,2018, 42(2): 133-143.
[10] 王浩, 鄒茜. 人參皂苷Rg1調(diào)節(jié)沉默信息調(diào)節(jié)因子1對抗晶狀體上皮細胞衰老的影響 [J]. 世界中醫(yī)藥, 2021,16(7): 1095-1098.
[11] 劉海宇, 張慶賀, 劉金平, 等. 達瑪烷型三萜皂苷結(jié)構(gòu)修飾研究進展 [J]. 中國實驗方劑學雜志, 2011, 17(22):269-273.
[12] 楊萍, 崔云秋, 于婷, 等. 人參皂苷Rg3劑型的研究進展 [J]. 國際藥學研究雜志, 2017, 44(6): 514-517.
[13] 周武喜, 楊寧, 趙余慶. 人參皂苷類化合物水溶性提升方法的研究進展 [J]. 藥物評價研究, 2016, 39(2): 322-327.
[14] Tao C, Zhang J J, Wang J X,et al. Ginsenoside drug nanocomposites prepared by the aerosol solvent extraction system for enhancing drug solubility and stability [J].Pharmaceutics, 2018, 10(3): 95.
[15] Yang L, Zhang Z H, Hou J,et al. Targeted delivery of ginsenoside compound K using TPGS/PEG-PCL mixed micelles for effective treatment of lung cancer [J].Int J Nanomedicine, 2017, 12: 7653-7667.
[16] Wang L F, Cao T T, Chen H T. Treatment of glaucomatous optic nerve damage using ginsenoside Rg1mediated by ultrasound targeted microbubble destruction[J].Exp Ther Med, 2018, 15(1): 300-304.
[17] Chen F, Deng Z Y, Zhang B,et al. Esterification of ginsenoside Rh2enhanced its cellular uptake and antitumor activity in human HepG2 cells [J].J Agric Food Chem, 2016, 64(1): 253-261.
[18] 劉發(fā)貴. 人參稀有皂苷脂肪酸修飾及其生物活性研究[D]. 長春: 吉林農(nóng)業(yè)大學, 2011.
[19] Wei G Q, Zheng Y N, Li W,et al. Structural modification of ginsenoside Rh(2) by fatty acid esterification and its detoxification property in antitumor [J].Bioorg Med Chem Lett, 2012, 22(2): 1082-1085.
[20] Bruno P M, Liu Y P, Park G Y,et al. A subset of platinum-containing chemotherapeutic agents kills cells by inducing ribosome biogenesis stress [J].Nat Med,2017, 23(4): 461-471.
[21] Zhang C H, Li X G, Gao Y G,et al. Synthesis and primary research on antitumor activity of three new panaxadiol fatty acid esters [J].Chem Res Chin Univ,2007, 23(2): 176-182.
[22] Spitz G A, Furtado C M, Sola-Penna M,et al.Acetylsalicylic acid and salicylic acid decrease tumor cell viability and glucose metabolism modulating 6-phosphofructo-1-kinase structure and activity [J].Biochem Pharmacol, 2009, 77(1): 46-53.
[23] Dachineni R, Ai G Q, Kumar D R,et al. Cyclin A2 and CDK2 as novel targets of aspirin and salicylic acid: A potential role in cancer prevention [J].Mol Cancer Res,2016, 14(3): 241-252.
[24] Xu L, Xiao S N, Yuan W H,et al. Synthesis and anticancer activity evaluation of hydrolyzed derivatives of panaxnotoginseng saponins [J].Molecules, 2018, 23(11):3021.
[25] Fu B D, Bi W Y, He C L,et al. Sulfated derivatives of 20(S)-ginsenoside Rh2and their inhibitory effects on LPS-induced inflammatory cytokines and mediators [J].Fitoterapia, 2013, 84: 303-307.
[26] Li L, Chen X Y, Li D,et al. Identification of 20(S)-protopanaxadiol metabolites in human liver microsomes and human hepatocytes [J].Drug Metab Dispos, 2011, 39(3): 472-483.
[27] Xiong J, Sun M J, Guo J X,et al. Active absorption of ginsenoside Rg1in vitroandin vivo: The role of sodium-dependent glucose co-transporter 1 [J].J Pharm Pharmacol, 2009, 61(3): 381-386.
[28] Knop K, Hoogenboom R, Fischer D,et al. Poly(ethylene glycol) in drug delivery: Pros and cons as well as potential alternatives [J].Angew Chem Int Ed Engl, 2010,49(36): 6288-6308.
[29] Sun Y, Yan X L, Yuan T M,et al. Disassemblable micelles based on reduction-degradable amphiphilic graft copolymers for intracellular delivery of doxorubicin [J].Biomaterials, 2010, 31(27): 7124-7131.
[30] Thambi T, Deepagan V G, Yoo C K,et al. Synthesis and physicochemical characterization of amphiphilic block copolymers bearing acid-sensitive orthoester linkage as the drug carrier [J].Polymer, 2011, 52(21): 4753-4759.
[31] Mathiyalagan R, Subramaniyam S, Kim Y J,et al.Synthesis and pharmacokinetic characterization of a pH-sensitive polyethylene glycol ginsenoside CK(PEG-CK) conjugate [J].Biosci Biotechnol Biochem,2014, 78(3): 466-468.
[32] 劉梅, 王莉, 胡凱莉, 等. 人參皂苷Rg1PEG修飾及其穩(wěn)定性實驗研究 [J]. 中國中藥雜志, 2012, 37(10):1378-1382.
[33] 劉梅, 王莉, 胡凱莉, 等. 人參皂苷Rg1經(jīng)PEG修飾前后的組織分布研究 [J]. 中國中藥雜志, 2012, 37(12):1747-1750.
[34] 趙海軍, 趙維英, 洪澤輝. 聚乙二醇兩端修飾依托泊苷及人參皂苷Rh2的自組裝膠束構(gòu)建及其理化性質(zhì)表征[J]. 中國新藥雜志, 2016, 25(17): 2027-2035.
[35] Ensing B, Tiwari A, Tros M,et al. On the origin of the extremely different solubilities of polyethers in water [J].Nat Commun, 2019, 10(1): 2893.
[36] 劉繼華. 具有抗癌活性人參皂苷的結(jié)構(gòu)修飾研究 [D].長春: 吉林大學, 2008.
[37] Wang P, Bi X L, Xu J,et al. Synthesis and anti-tumor evaluation of novel 25-hydroxyprotopanaxadiol analogs incorporating natural amino acids [J].Steroids, 2013,78(2): 203-209.
[38] Urban M, Sarek J, Klinot J,et al. Synthesis of A-seco derivatives of betulinic acid with cytotoxic activity [J].J Nat Prod, 2004, 67(7): 1100-1105.
[39] Zhang Y M, Yuan W H, Wang X D,et al. Synthesis,characterization and cytotoxic activity evaluation of ginsengdiol oxidation and nitrogen hybrid derivatives [J].MedChemComm, 2018, 9(11): 1910-1919.
[40] Pettit G R, Inoue M, Kamano Y,et al. Antineoplastic agents. 147. Isolation and structure of the powerful cell growth inhibitor cephalostatin 1 [J].J Am Chem Soc,1988, 110(6): 2006-2007.
[41] Mallavadhani U V, Vanga N R, Jeengar M K,et al.Synthesis of novel ring-A fused hybrids of oleanolic acid with capabilities to arrest cell cycle and induce apoptosis in breast cancer cells [J].Eur J Med Chem,2014, 74: 398-404.
[42] Soni J, Sethiya A, Sahiba N,et al. Contemporary progress in the synthetic strategies of imidazole and its biological activities [J].Curr Org Synth, 2019, 16(8): 1078-1104.
[43] 張嚴磊. 小桐子化學成分研究及人參二醇、人參三醇結(jié)構(gòu)修飾研究 [D]. 昆明: 云南大學, 2010.
[44] 姜竹韻. 人參皂苷Rg2的甲基化修飾研究 [D]. 長春:東北師范大學, 2018.
[45] 吳久偉, 廖莎, 沈德存. [3,12-3H]原人參二醇的合成[J]. 核化學與放射化學, 2005, 27(3): 190-192.
[46] Zhang D M, Wang A F, Feng J P,et al. Ginsenoside Rg5induces apoptosis in human esophageal cancer cells through the phosphoinositide?3 kinase/protein kinase B signaling pathway [J].Mol Med Report, 2019, doi:10.3892/mmr.2019.10093.
[47] An K S, Choi Y O, Lee S M,et al. Ginsenosides Rg5and Rk1enriched cultured wild ginseng root extract bioconversion ofPediococcus pentosaceusHLJG0702:Effect on scopolamine-induced memory dysfunction in mice [J].Nutrients, 2019, 11(5): 1120.
[48] Shao J J, Zheng X Y, Qu L L,et al. Ginsenoside Rg5/Rk1ameliorated sleep via regulating the GABAergic/serotoninergic signaling pathway in a rodent model [J].Food Funct, 2020, 11(2): 1245-1257.
Research progress on ginsenoside derivatization and its biological activities
ZHANG Hao-ran, YE An-qi, ZHANG Yue-wei, CHENG Le-qin
Department of Pharmacy and Applied Chemistry, Jilin Institute of Chemical Technology, Jilin 132022, China
Ginsenosides are the main biologically active components of ginseng, especially the secondary rare ginsenosides which are degradation products, have extensive biological activities. However, due to the characteristics of their structures, the low water solubility and the low bioavailability largely limit their applications. Modification of the molecular structure of ginsenosides by chemical methods can effectively improve the water solubility and targeting properties of ginsenosides, thereby increasing the bioavailability and significantly improving the drug activity of ginsenosides. This article reviews and compares the latest research advances in the modification methods and biological activity research of ginsenosides, which provides references for further studies on the chemical modification and potential utilization value of ginsenosides and their applications in food, medicine and other fields.
ginsenosides; secondary rare ginsenosides; chemical modification; derivatization; biological activity
R284
A
0253-2670(2022)14-4554-14
10.7501/j.issn.0253-2670.2022.14.033
2021-11-08
吉林省科技廳重點科技研發(fā)項目(20180201073YY);吉林化工學院重大研發(fā)項目(吉化院合字[2015]第005號)
張浩然(1998—),女,內(nèi)蒙古通遼人,碩士研究生,主要從事人參皂苷結(jié)構(gòu)修飾研究。E-mail: 1656248294@qq.com
*通信作者:成樂琴(1969—),女(朝鮮族),黑龍江林口人,教授,主要從事天然產(chǎn)物結(jié)構(gòu)修飾及藥物合成。E-mail: chengleqin@126.com
[責任編輯 王文倩]