轉 GhB301基因棉花抗枯萎病機理研究
朱金成,劉戈輝,張鵬飛,郭文婷,張 薇
(石河子大學 農學院/新疆生產建設兵團綠洲生態農業重點實驗室,新疆石河子 832003)
棉花是重要的經濟作物,中國是世界上最大的棉花生產和消費國。棉花枯萎病是棉花的重要病害之一,由于常年連作,病害逐年加重,嚴重影響棉花的產量和品質,制約著棉花產業的可持續發展,培育抗枯萎病的棉花新品種是解決這個問題的最經濟有效的方法。分子生物學的迅速發展,為利用轉基因技術培育棉花抗病品種提供了新的途徑[1]。
AP2/ERF轉錄因子是一種具有特殊結構、行使調控基因表達功能的蛋白質分子[2]。Guo等[3]從海島棉‘7124’克隆得到一個ERF類轉錄因子GbERF1-like,可以通過激活木質素合成提高對黃萎病菌的抗性。Liu等[4]發現在煙草中過表達GbERFb可以提高煙草對大麗輪枝菌的抵抗力。在擬南芥中,過量表達B3亞組的AtERF14能增強防衛基因的表達,并能調控ERF1、ERF2等其他抗病相關ERF基因的表達。進一步的研究發現erf14突變體對枯萎病菌更加感病,且AtERF14的功能缺失不能被其他ERF互補;表明AtERF14在枯萎病抗性中表現出很重要的作用[5]。過量表達GbERF1可以提高棉花對大麗輪枝菌的抗性,而下調GbERF1基因則增加棉花對大麗輪枝菌的敏感性[6]。此外,ERF(亞)家族轉錄因子在信號轉導途徑中也起到了重要作用。ERF(亞)家族轉錄因子的基因受多種信號分子的誘導而表達[7]。Guo等[8]研究發現,棉花等多種高等植物受到黃萎病等真菌侵染時會發生應激反應而產生許多小分子物質,如乙烯和水楊酸等。Zhang等[9]研究發現,小麥中的ERF(亞)家族轉錄因子TaERF3在對病原物白粉菌的抗性反應途徑中發揮作用,從而激活植物對病原物的防衛相關基因的表達。
綜上所述,AP2/ERF轉錄因子作為植物特有的一類轉錄因子,在植物對病原菌脅迫響應中具有重要的調控作用。近年來,雖然人們已克隆了一些與抗枯萎病相關的ERFs家族基因,但仍有許多調控棉花抗枯萎病反應的關鍵基因的功能尚不清楚。劉戈輝等[10]從高抗枯萎病的棉花品種中克隆了1個ERF轉錄因子基因GhB301,通過農桿菌介導法將其導入野生型棉花品種YZ-1并獲得純合株系,枯萎病抗性鑒定結果表明,過表達GhB301的轉基因棉花株系病情指數為 14.77%,顯著低于野生型對照(病情指數為 37.50%),顯著提高棉花對枯萎病的抗性。本研究在此基礎上,通過分析GhB301基因對棉花抗病相關基因的表達及酶活性的影響,探討GhB301基因在棉花抗枯萎菌中的功能,為棉花抗枯萎病分子育種提供理論依據和基因資源。
1 材料與方法
1.1 棉花材料的種植
供試棉花材料為過表達GhB301轉基因棉花純合株系(OE)與野生型對照YZ-1(WT),其中棉花轉基因純合株系在石河子大學綠洲生態農業重點實驗室前期試驗中獲得。將轉基因株系和野生型對照材料的種子分別用50~60 ℃的溫水浸泡30 min,放在發芽盒中于37 ℃培養箱中暗培養 3 d。然后將發芽的種子清理好種植于營養缽中[V(花土)∶V(蛭石)=3∶1)],放置于光照培養箱(光照16 h、25 ℃,黑暗8 h、23 ℃,濕度65%)中進行培養,待棉苗第1片真葉完全展平時進行接菌處理。
1.2 枯萎病菌的活化及接菌處理
供試菌株為枯萎病菌7號生理小種強致病菌株F430,由石河子大學農學院棉花分子育種實驗室提供。活化后挑取單菌落于查氏液體培養基中,28 ℃、200 r/min暗培養7~10 d,待菌液達到1×107個孢子/mL時對營養缽中棉苗進行傷根處理,用注射器吸取10 mL菌液注射到傷口處,對照注射10 mL的去離子水。每次處理30株,重復3次,用于后續指標測定。
1.3 抗病相關酶活性的測定
分別取轉基因棉花材料和野生型材料接菌后0、1、3、5、7 d的葉片,液氮速凍后,保存于-80 ℃冰箱。過氧化物酶(POD)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)的活性測定參考汪紅等[11]的方法,超氧化物歧化酶(SOD)、過氧化氫酶(CAT)活性測定參考Bailly等[12-13]的方法。
1.4 抗病相關基因的表達分析
提取枯萎病菌處理后24 h的轉基因株系和對照系的根部RNA,反轉錄成cDNA后,進行qRT-PCR檢測。內參基因為GhUBQ7,qRT-PCR反應體系及程序設計參考TransStart Tip Green qPCR SuperMix說明書。共設置3個重復,采用2-ΔΔCt法計算基因相對表達量[14]。用primer 5軟件設計引物(表1),引物由北京華大基因公司合成。
1.5 數據分析
使用Excel 2010、SPSS 22軟件對數據進行處理分析。
2 結果與分析
2.1 棉花葉片防御酶活性分析
2.1.1 SOD活性變化 在接種棉花枯萎病菌后,無論是轉基因材料(OE)還是野生型材料(WT)中超氧化物歧化酶(SOD)活性都比相應的接水對照(CK-OE、CK-WT)高,并且都隨著接菌時間的延長而出現先升高后降低的變化趨勢,但其SOD活性大小與峰值出現時間不同(圖1)。其中轉基因材料的峰值出現較早,在接菌后的第3天,是同期轉基因接水的2.66倍,野生型材料峰值出現的較晚,在接菌后的第5天,是同期野生型接水的1.78倍。
2.1.2 POD活性變化 由圖2可知,兩個接水處理的棉花材料葉片中過氧化物酶(POD)活性均呈現先升高后降低的趨勢,并且轉基因材料(OE)的POD活性均高于野生型材料(WT),尤其是在第3天,是野生型接水對照(CK-WT)的2.20倍。在接菌處理后,轉基因材料和野生型材料POD活性均呈現先升高后降低的變化趨勢,且轉基因材料的POD活性均高于相應的野生型材料,轉基因材料在第3天達到峰值,而野生型材料在第5天才達到峰值;在接種后3 d時,轉基因接菌材料是轉基因接水材料的2.26倍,野生型接菌材料是野生型接水材料的1.56倍。
2.1.3 CAT活性變化 由圖3可以看出,在接菌處理條件下,轉基因材料(OE)葉片CAT活性與野生型(WT)相比顯著增加;隨著接菌時間的延長,兩個棉花材料葉片CAT活性均呈現先升高后降低的趨勢,轉基因材料葉片峰值出現在接菌后的第3天,是同期轉基因接水對照(CK-OE)的2.57倍,野生型材料葉片CAT活性在第5天出現峰值,是同期野生型接水對照(CK-WT)的1.41倍。在接水處理的條件下,轉基因材料葉片的過氧化氫酶(CAT)活性與野生型材料無明顯差異;隨著處理時間的延長,野生型棉花葉片CAT活性呈現先升高后降低的趨勢,并且在第5天達到峰值,轉基因材料葉片中CAT活性變化不明顯。
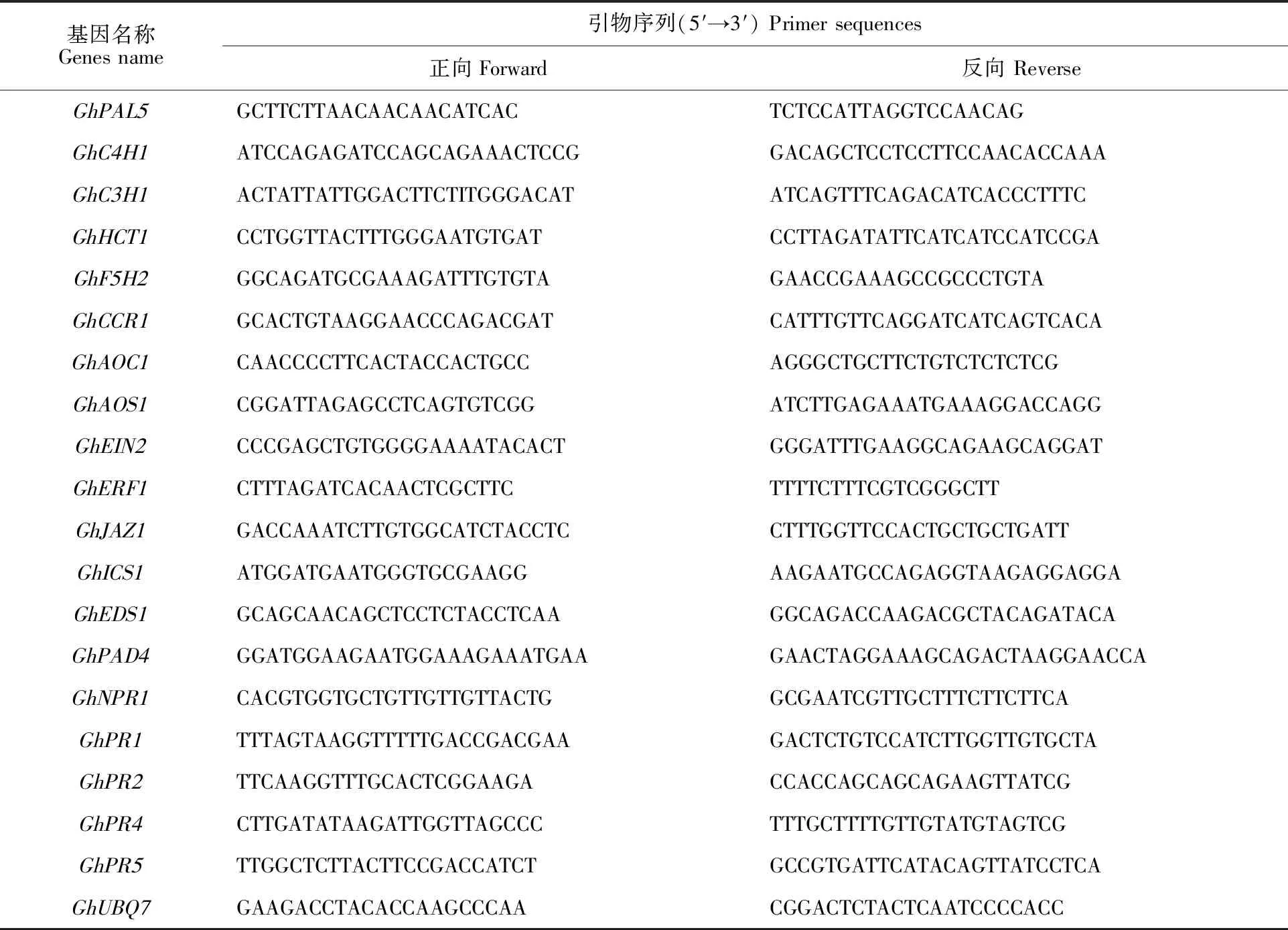
表1 qRT-PCR所用引物Table 1 Primers used for qRT-PCR
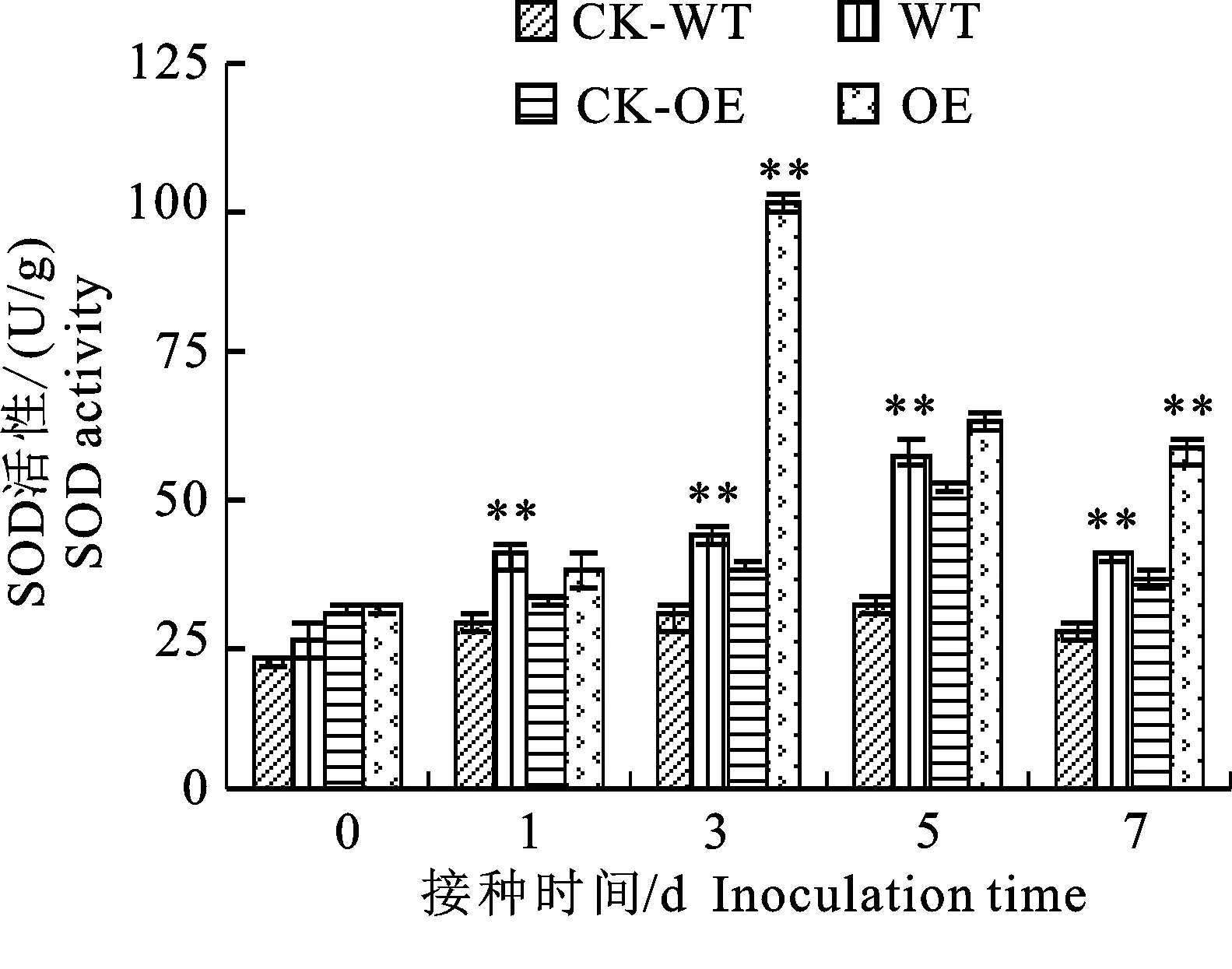
*和**分別表示同期接菌處理與接水對照間在0.05和 0.01水平存在顯著性差異;下同

圖2 轉基因材料與野生型材料接種枯萎病菌后POD活性變化Fig.2 Changes of peroxidase activity in transgenic and wild-type cotton plants after inoculation with Fusarium oxysporum
2.1.4 PAL活性變化 如圖4所示,在接菌處理條件下,兩個材料PAL活性均出現先升高后降低的變化趨勢,與POD、SOD活性不同的是,轉基因材料(OE)在第5天達到峰值,是同期轉基因接水材料(CK-OE)的3.04倍,但在野生型材料(WT)中PAL活性在第3天達到峰值,是同期野生型接水對照(CK-WT)的1.75倍。在接水處理條件下,兩個材料也都表現出先升高后降低的趨勢,但不明顯。
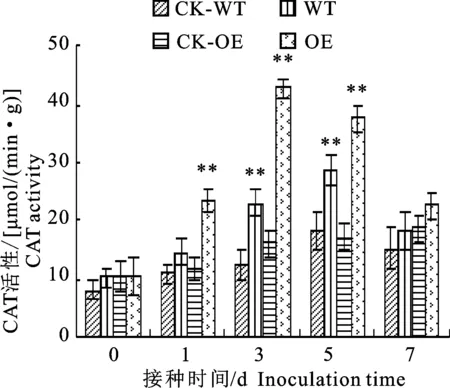
圖3 轉基因材料與野生型材料接種枯萎病菌后CAT活性變化Fig.3 Change of catalase activity in transgenicand wild-type cotton plants after inoculation with Fusarium oxysporum
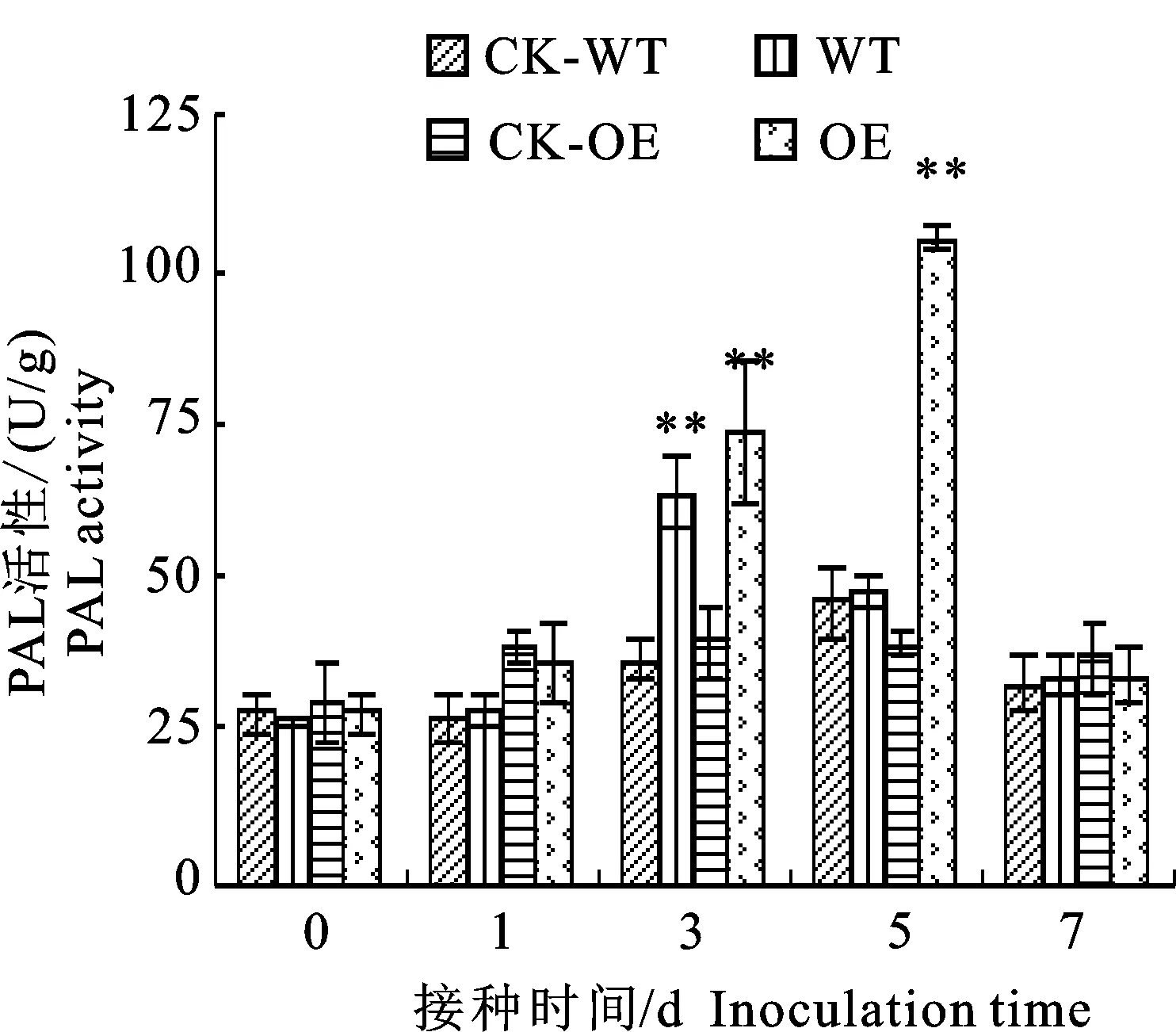
圖4 轉基因材料與野生型材料接種枯萎病菌后PAL活性變化Fig.4 Change of phenylalanine ammonia lyase activity in transgenic and wild-type cotton plants after inoculation with Fusarium oxysporum
2.1.5 PPO活性變化 圖5顯示,在接種棉花枯萎病菌后,轉基因材料(OE)和野生型材料(WT)中多酚氧化酶(PPO)活性都比相應的接水對照(CK-WT、CK-OE)顯著增加,并且都隨著接菌時間的延長而出現先升高后降低的變化趨勢,兩個材料的PPO活性峰值均出現在第3天,但其PPO活性大小不同。在第3天轉基因接菌材料是同期轉基因接水材料的2.98倍,野生型接菌材料是同期野生型接水材料的2.02倍。在接水處理的條件下,兩個材料的PPO活性變化也呈現先升高后降低的趨勢,峰值均出現在第5天,并且在第5天時轉基因接水材料的PPO活性顯著高于野生型接水材料,是野生型接水材料的 1.22倍。
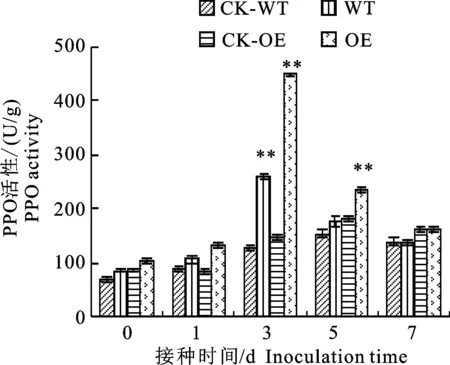
圖5 轉基因材料與野生型材料接種枯萎病菌后PPO活性變化Fig.5 Change of polyphenol oxidase activity in transgenic and wild-type cotton plants after inoculation with Fusarium oxysporum
2.2 抗病相關基因的表達分析
為了進一步闡明GhB301在棉花枯萎病抗性中的功能,利用qRT-PCR方法測定轉基因棉花材料(OE)和野生型材料(WT)在接種枯萎病菌24 h后苯丙烷代謝途徑相關基因、JA/ET路徑相關基因、SA路徑相關基因、PR基因等抗病相關基因的表達,如圖6所示。結果表明,與野生型材料相比,轉基因材料在枯萎病菌處理后除GhERF1、GhJAZ1、GhNPR1外,大多數基因均上調表達。
在苯丙烷代謝途徑中(圖6-A),共檢測6個基因,其中GhPAL5、GhC4H1、GhC3H1、GhF5H2在轉基因材料中的相對表達量均極顯著高于野生型材料,GhCCR1在轉基因材料中的相對表達量顯著高于野生型材料,GhHCT1在轉基因材料和野生型材料中無明顯差異。
在JA/ET路徑中(圖6-B),共檢測5個基因,其中乙烯合成的兩個關鍵基因GhAOS1在轉基因材料中的相對表達量極顯著高于野生型材料,GhAOC1在轉基因材料中的相對表達量顯著高于野生型材料;GhEIN2在轉基因材料和野生型材料中無明顯差異,僅略高于野生型材料,而GhERF1和GhJAZ1在轉基因材料中的相對表達量均低于野生型材料,特別是GhJAZ1在轉基因株系中的相對表達量顯著低于野生型材料。
在SA路徑中(圖6-C),共檢測4個基因,其中GhICS1和GhEDS1在轉基因材料中的相對表達量極顯著高于野生型材料,GhPAD4在轉基因材料中的相對表達量顯著高于野生型材料,GhNPR1在轉基因材料和野生型材料中無明顯差異。
在PR基因中(圖6-D),共檢測4個基因,其中只有GhPR4在轉基因材料中的相對表達量顯著高于野生型材料,另外3個基因在轉基因材料中僅略高于野生型材料。
綜上所述,在接種枯萎病菌24 h后,過表達GhB301棉花中與苯丙烷代謝途徑、JA/ET路徑、SA路徑、PR基因等多個抗病相關基因被激活,僅有個別基因的表達無明顯差異,由此推測過表達GhB301的轉基因棉花增強對枯萎病抗性的原因可能與抗病相關基因的激活有關。
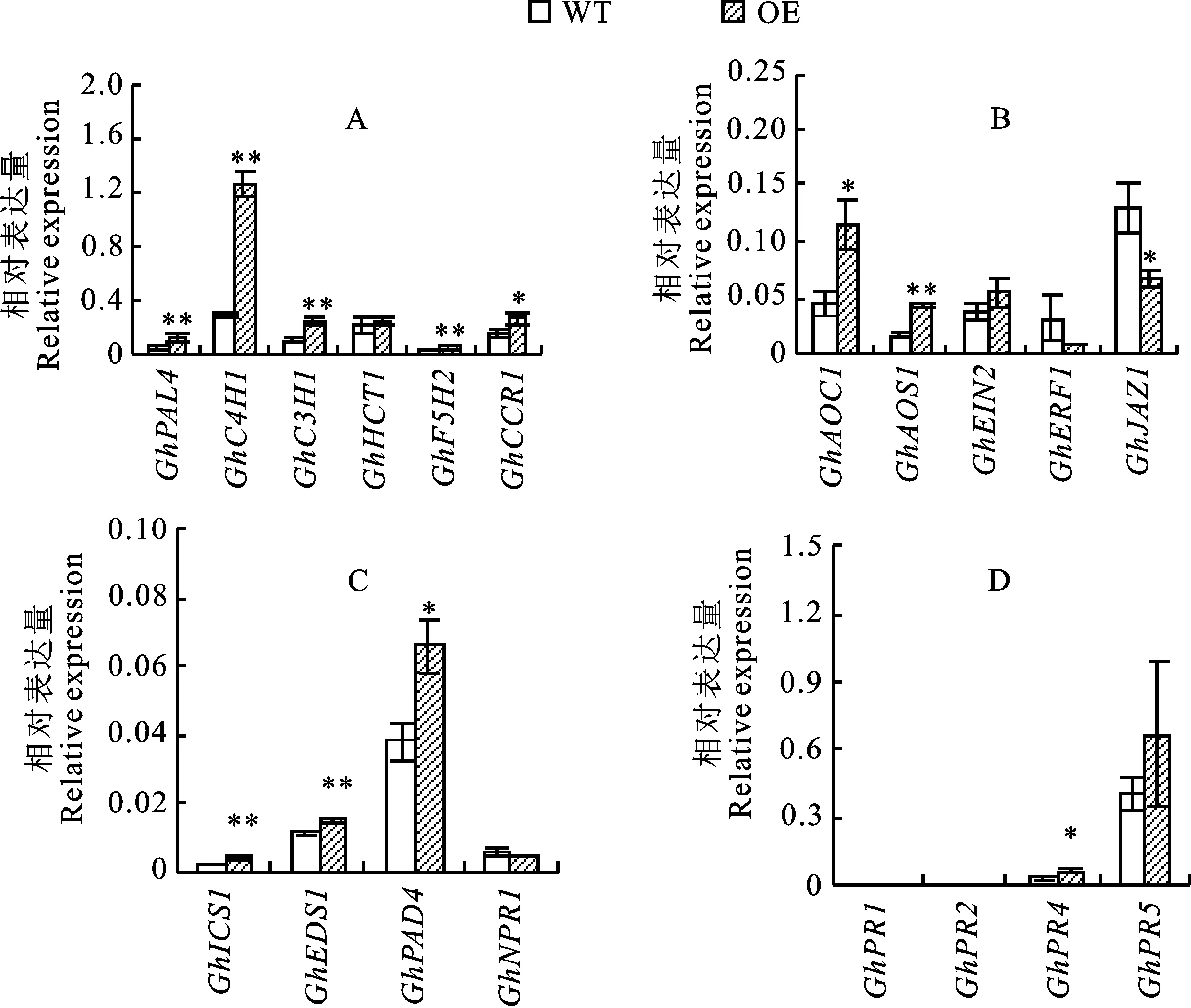
A.苯丙烷代謝途徑相關基因相對表達量;B.JA/ET路徑相關基因相對表達量;C.SA路徑相關基因相對表達量;D.PR基因相對表達量
3 討 論
當植株受到病原菌侵害時體內會發生一系列的生理生化變化,包括組織細胞結構形態的改變,以及相應的物理化學的抗病反映[15-16]。研究發現接種大麗輪枝菌后不同抗性棉花品種的PAL、POD、PPO、CAT等的酶活性隨著品種抗病性的增強而升高[17]。Gayoso等[18]研究發現,攜帶有Ve基因的抗黃萎病番茄在受到黃萎病菌侵染后,PAL和POD的活性升高并且木質素含量增加。SOD、GPX、CAT和APX可以清除細胞中的活性氧,以保護細胞免受過氧化傷害,并且轉基因植株的酶活性更高[19]。李娟[20]對轉基因抗病棉花品種與對照材料進行接種枯萎病菌處理,發現其PAL、POD活性的變化趨勢基本一致,呈現先增加后降低的趨勢,但轉基因抗病棉花的酶活性變化更快,峰值更高。本研究以過表達GhB301轉基因棉花純合株系和野生型對照為試驗材料,接種棉花枯萎病菌后,發現棉花葉片SOD、CAT、PAL、PPO、POD活性逐漸增高,均呈先增加后降低的變化趨勢,轉基因棉花材料的SOD、CAT、POD、PAL、PPO活性均高于野生型材料,且SOD、POD、CAT活性峰值均早于野生型材料2 d左右,這與前人研究結果基本一致。
前人研究發現棉花代謝途徑相關基因表達量變化與植物抗病性相關。苯丙氨酸/酪氨酸代謝途徑是苯丙烷途徑的重要分支,通過此途徑可以合成木質素[21]。植物木質化程度越高,相應的抗病性就越強[22]。木質素合成相關基因可以通過正向調節木質素合成和提高木質素含量,來提高棉花對枯萎病的抗性[23]。JA/ET和SA現已被證明是植物與病原菌互作中重要的激素,植物受病原菌脅迫后能夠顯著改變這些激素的生物合成和下游信號相關基因的表達[24-25]。ERF1作為JA/ET響應應答調控因子起作用,超表達ERF1的擬南芥對枯萎病菌及其他一些腐生型真菌的抗性增強,ERF2也具有類似的功能[26]。研究發現GbERF1的表達受黃萎病的強烈誘導,過量表達GbERF1的轉基因擬南芥能增強多個病程相關蛋白基因的表達,與野生型擬南芥相比,對黃萎病的抗性也明顯提高[27]。李超[28]發現棉花和擬南芥通過增強 JAZ1 來抑制茉莉酸通路激活赤霉素通路,從而降低棉花抗病性來調節植物正常的生長發育。本研究利用實時熒光定量PCR技術測定接種枯萎病菌后轉基因棉花株系和野生型株系中抗病相關基因的表達,被檢測基因中大部分在轉基因株系中的相對表達量顯著高于野生型對照,推測接菌后有效提高苯丙烷代謝途徑、JA/ET途徑、SA途徑中相關基因和PR基因的表達,且JAZ1作為一個負調控因子表達量降低也得到驗證。結合前期對轉基因棉花株系抗病性的鑒定,推測轉GhB301棉花株系對枯萎病抗性增強可能是由于GhB301基因的過表達引起棉花抗病相關基因表達量升高進而增加了防御相關酶活性所致。

